蓝圆鲹肝脏酯酶的分离纯化与性质分析
2022-03-30孙乐常文嘉欣林怡晨刘光明曹敏杰
孙乐常,文嘉欣,杜 瀚,林怡晨,刘光明,曹敏杰,*
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.水产品深加工技术国家地方联合工程中心,福建 厦门 361021;3.大连工业大学 海洋食品精深加工关键技术省部共建协同创新中心,辽宁 大连 116034)
酯酶(EC 3.1.1.1)是一类具有催化水解酯键能力的水解酶,它能够参与包括酯化反应、转酯反应以及对光活性物质进行动力学拆分等多种反应[1],其催化底物和催化特性与脂肪酶(EC3.1.1.3)相似。酯酶通常水解水溶性酯,如短链脂肪酸甘油三酯,一般酯酶催化水解短链(<C10)甘油酯,而脂肪酶优先水解以长链脂肪酸(>C12)构成的甘油三酯[2]。在动物体内,脂肪酶与酯酶参与机体中脂质的运输与代谢,如催化脂肪酰甘油、脂肪酰肉毒胆碱与脂酰CoA酯的水解,以及生物信号分子的跨膜转运、保持生物膜的功能完整性等[3]。由于能催化多种酯类底物水解,且催化特异性高,近年来,酯酶被广泛应用于手性药物分离筛选、药物合成、脂精炼以及食品风味控制等诸多行业领域[4-5]。另一方面,鱼内脏中不仅富含蛋白质资源,还含有大量高附加值的鱼油以及ω-3系多不饱和脂肪酸[6]。这些高丰度的多不饱和脂肪酸被认为是海洋鱼类在进食了藻类或浮游植物后在体内富集而形成的,而鱼肝脏中酯酶与脂肪酶在这过程中起到至关重要的作用[7-9]。
迄今为止,国外关于海洋动物内脏中脂肪酶的报道仅见于太平洋磷虾(Euphausia superba)[7]、海鲈鱼(Lates calcarifer)[8]、太平洋蓝鳍金枪鱼(Thunnus orientalis)[9]、沙丁鱼(Sardinella aurita)[10]、海螺(Hexaplex trunculus)[11]、凡纳滨对虾(Litopenaeus vannamei)[12]、海蟹(Carcinus mediterraneus)[13]、王鲑(Oncorhynchus tshawytscha)与新西兰鳕鱼(Macruronus novaezelandiae)[14]。目前,关于酯酶的研究大多集中于在微生物来源[15],相比之下,动物源的酯酶,特别是海洋动物来源的酯酶的相关分离纯化与性质研究尤为少见。而对于水产动物酯酶,仅见于Smichi等[16]对灰鲻鱼的研究。
蓝圆鲹(Decapterus maruadsi)是我国重要的低值海洋经济鱼类之一,其价格低廉、味道鲜美、营养丰富,深受消费者的喜爱。据统计,2019年蓝圆鲹全国捕捞总量达44.87万 t,其中福建捕捞量为21.37万 t,居全国首位[17],具有巨大的开发价值。本研究拟以蓝圆鲹为对象,从其肝脏中分离纯化天然酯酶,并对其性质进行分析,旨在为海水鱼内脏中酯酶的应用提供理论参考。
1 材料与方法
1.1 材料与试剂
新鲜蓝圆鲹由厦门高崎水产批发市场购得,平均质量约150 g/尾,置于碎冰中,运回实验室后,立即用剪刀小心从鱼肛门处向头部方向剪开鱼肚,并分选出肝脏备用。
Q-Sepharose、Q-HP、Phenyl Fast Flow、Superdex G75美国GE Healthcare公司;脂肪酸对硝基苯酚酯底物、对硝基苯酚、N,N,N’,N’-四甲基乙二胺(N,N,N’,N’-tetramethylethylenediamine,TEMED) 美国Sigma公司;标准蛋白 美国Thermal公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS,电泳纯)、丙烯酰胺美国Bio-Rad公司;其他试剂均为国产分析纯。
1.2 仪器与设备
UPC900 AKTA蛋白层析系统 美国GE公司;5800 MALDI-TOF/TOF串联飞行时间质谱仪 美国AB SCIEX公司;ND-1000紫外-可见分光光度计 美国NanoDrop公司;Avanti JA-25高速冷冻离心机、pH计美国Beckman公司;759s紫外-可见分光光度计 上海棱光技术有限公司;垂直电泳系统 美国Bio-Rad公司;超纯水系统 美国Millipore公司。
1.3 方法
1.3.1 酶活性测定
蓝圆鲹肝脏酯酶活性测定参考Chen Chengcheng等[15]方法并适当修改。以4-丁酸对硝基苯酚酯(p-nitrophenyl butyrate,p-NPB)为底物,取50 μL样品液加入900 μL预热至37 ℃的20 mmol/L Tris-HCl缓冲液(pH 8.0)中,充分混匀后加入50 μL的5 mmol/Lp-NPB溶液,并继续在37 ℃条件下孵育10 min,随后立即用冰水冷却终止反应并测定其在410 nm波长处的吸光度。其酯酶活性单位(U)定义为每分钟分解p-NPB并释放1 μmol对硝基苯酚所需的酶量。
蓝圆鲹肝脏脂肪酶活性测定参考Kurtovic等[14]方法并适当修改。以4-棕榈酸对硝基苯酯(4-nitrophenyl palmitate,p-NPP)为底物,取50 μL的样品液加入900 μL预热至37 ℃的20 mmol/L Tris-HCl缓冲液(pH 8.0,含20 mmol/L CaCl2、5 mmol/L胆酸钠、0.01%阿拉伯胶)中,充分混匀后加入50 μL的5 mmol/Lp-NPP溶液,并继续在37 ℃条件下孵育10 min,随后立即用冰水冷却终止反应并测定其在410 nm波长处的吸光度。其脂肪酶活性单位(U)定义为每分钟分解p-NPP并释放1 μmol对硝基苯酚所需的酶量。
1.3.2 蓝圆鲹肝脏酯酶的分离纯化
参考Smichi等[16]方法并适当修改,纯化过程均在4 ℃环境下进行。取100 g新鲜肝脏加入4 倍体积的20 mmol/L Tris-HCl pH 8.0冰缓冲液(缓冲液A),充分组织捣碎后,12 000×g离心20 min,上清液用4 层绢布过滤去除漂浮在液面的油脂与变性蛋白,得到粗酶液样品。得到的粗酶液进行40%~60%的(NH4)2SO4盐析,离心后收集沉淀部分用少量缓冲液A充分溶解后,用相同缓冲液透析48 h。透析后的样品,上样于DEAE-Sepharose阴离子交换层析柱(2.5 cm×15 cm),用含0~1.0 mol/L NaCl溶液(缓冲液A)进行线性洗脱,收集活性峰组分,在缓冲液A透析48 h。透析充分后的样品上样于Q-HP(1 mL)阴离子交换层析柱,用含0~1 mol/L NaCl的缓冲液A进行线性洗脱,收集活性峰部分,用含2 mol/L (NH4)2SO4的20 mmol/L Tris-HCl pH 8.0(缓冲液B)透析过夜。透析充分后的样品上样于Phenyl Fast Flow(1 mL)疏水层析柱,用含2.0~0.0 mol/L (NH4)2SO4的20 mmol/L Tris-HCl pH 8.0缓冲液进行线性洗脱,收集活性峰组分,用10 kDa超滤膜置换缓冲液成含0.15 mol/L NaCl的50 mmol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)中并进一步浓缩。浓缩后的组分上样于预先用含0.15 mol/L NaCl的50 mmol/L PBS (pH 7.4)平衡的Superdex G75凝胶过滤柱层析,收集活性峰部分即为高度纯化的酯酶。
1.3.3 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分析
参照Laemmli[18]的方法,并适当改动。配制的SDSPAGE凝胶为12%分离胶和5%浓缩胶。电泳结束后,凝胶参照Marshak等[19]方法进行质谱银染色。
1.3.4 肽指纹图谱鉴定纯化酯酶
将纯化的酯酶上样于12%聚丙烯酰胺凝胶,电泳结束后,进行质谱银染色,再小心将目的蛋白条带切下。将样品使用胰蛋白酶酶解处理后,使用串联飞行时间质谱仪进行测试分析,设置激光源为Nd:YAG 激光器(波长335 nm),加速电压为2 kV,扫描范围为800~4 000 u,采用正离子模式和自动获取数据的模式采集数据。其中,一级质谱中选择信噪比大于50的母离子进行二级质谱分析,二级质谱激光累计叠加2 500 次。 质谱结果用Mascot 2.2软件在NCBI数据库检索,最后得到鉴定的蛋白质结果,根据Mascot 2.2标准(P<0.05)对目的蛋白进行评分。
1.3.5 蓝圆鲹肝脏酯酶的性质分析
1.3.5.1 蓝圆鲹肝脏酯酶的最适温度及热稳定性
在不同温度(10、20 、30、40、50、60、70 ℃)条件下,以p-NPB为底物测定酯酶活性。以最高酶活性为100%,计算其他温度下的相对酶活性,考察酯酶的最适温度。
将蓝圆鲹肝脏酯酶在不同温度(30、40、50、55、60 ℃)条件下放置0.5 h后,在37 ℃、pH 8.0条件下以p-NPB为底物测定酯酶活性。以最高酶活性(4 ℃放置)为100%,计算其他温度下的相对酶活性,考察酯酶的热稳定性。
1.3.5.2 蓝圆鲹肝脏酯酶的最适pH值及pH值稳定性
在不同pH值(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0)条件下,以p-NPB为底物测定酯酶活性。以最高酶活性为100%,计算其他pH值条件下的相对酶活性,考察酯酶的最适pH值。
将蓝圆鲹肝脏酯酶在不同pH值(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0)条件下放置0.5 h后,在37 ℃、pH 8.0条件下以p-NPB为底物测定酯酶活性。以最高酶活性为100%,计算其他pH值下的相对酶活性,考察酯酶的pH值稳定性。
各pH值所用缓冲液:pH 3.0~5.0为20 mmol/L HAc-NaAc缓冲液,pH 6.0为20 mmol/L PBS,pH 7.0~9.0为20 mmol/L Tris-HCl缓冲液,pH 10.0为20 mmol/L Na2CO3-NaHCO3缓冲液,pH 11.0~12.0为20 mmol/L NaHCO3-NaOH缓冲液。
1.3.5.3 金属离子对蓝圆鲹肝脏酯酶活性的影响
在20 mmol/L Tris-HCl(pH 8.0)缓冲液中分别加入终浓度为5 mmol/L的 BaCl2、CaCl2、ZnCl2、MnCl2、CuCl2、KCl、NaCl、MgCl2、AlCl3、CoCl2、FeCl2,在37 ℃、pH 8.0条件下以p-NPB为底物测定酯酶活性。
1.3.5.4 Na+对蓝圆鲹肝脏酯酶活性的影响
在20 mmol/L Tris-HCl(pH 8.0)缓冲液中分别加入NaCl至终浓度为0.005、0.05、0.1、0.2、0.5、1.0、2.0 mol/L。在37 ℃、pH 8.0条件下以p-NPB为底物测定酯酶活性。
1.3.5.5 表面活性剂及有机溶剂对蓝圆鲹肝脏酯酶活性的影响
分别将50 μL 2%和20%的甲醇、乙醇、丙酮、异丙醇、SDS、TritonX-100、Tween 20与50 μL纯化后的样品混匀,使其终体积分数分别为1%和10%,在4 ℃条件下孵育0.5 h,再从中取50 μL以p-NPB为底物,测定酯酶活性。其中,酶活性测定条件均为pH 8.0和37 ℃。
1.3.5.6 SDS对蓝圆鲹肝脏酯酶活性的影响
向纯化后样品中添加不同含量SDS使其终质量分数分别为0%、0.1%、0.5%、1%、2%,混匀,4 ℃孵育0.5 h后,取50 μL以p-NPB为底物,测定酯酶活性。其中,测定条件均为pH 8.0和37 ℃。
1.3.5.7 蓝圆鲹肝脏酯酶的底物特异性
为了确定目的酯酶是否具有脂肪酶的功能,将酯酶在pH 8.0和37 ℃的相同条件下,分别采用脂酶和脂肪酶活力测定方法测定其催化不同底物(C链长度的差别)水解的酶活性变化确定其底物特异性。选用的不同底物为4-硝基乙酸酯(4-nitrophenyl acetic,p-NPA)、p-NPB、4-硝基苯基癸酸酯(4-nitrophenyl decanoate,p-NPD)、p-NPP,它们分别是C2、C4、C10、C16的脂肪酸酯。
1.4 数据统计与分析
所有的实验均至少重复3 次以上,用Excel软件进行数据录入和图表制作,用IBM SPSS Statistics 21进行统计学分析,数据以表示。
2 结果与分析
2.1 蓝圆鲹肝脏酯酶的分离纯化与鉴定
蓝圆鲹肝脏粗酶液经过40%~60% (NH4)2SO4盐析后上样于Q-Sepharose阴离子交换层析柱。如图1A所示,在0~1.0 mol/L NaCl线性洗脱过程中,出现2 个较高的酯酶活性峰,收集酶活性较高而蛋白含量较低的第2个酶活性峰组分(133~143管)。将活性峰用缓冲液A透析后上样于Q-HP阴离子交换层析预装柱,如图1B所示,目的蛋白在NaCl浓度约0.5 mol/L下被洗脱(31~37管)。将其收集后用缓冲液B透析后上样于Phenyl Fast Flow疏水层析预装柱。如图1C所示,大量的杂蛋白在(NH4)2SO4浓度约为0.8 mol/L之前被洗脱下来,而目的蛋白在(NH4)2SO4浓度约0.5 mol/L被洗脱下来。收集的活性组分最终通过Superdex G75凝胶过滤层析柱得到纯化(图1D)。由表1可知,经40%~60% (NH4)2SO4分级沉淀、Q-Sepharose、Q-HP、Phenyl Fast Flow和Superdex G75后获得了高纯度的酯酶,最终的纯化倍数为1 150,回收率为0.69%。

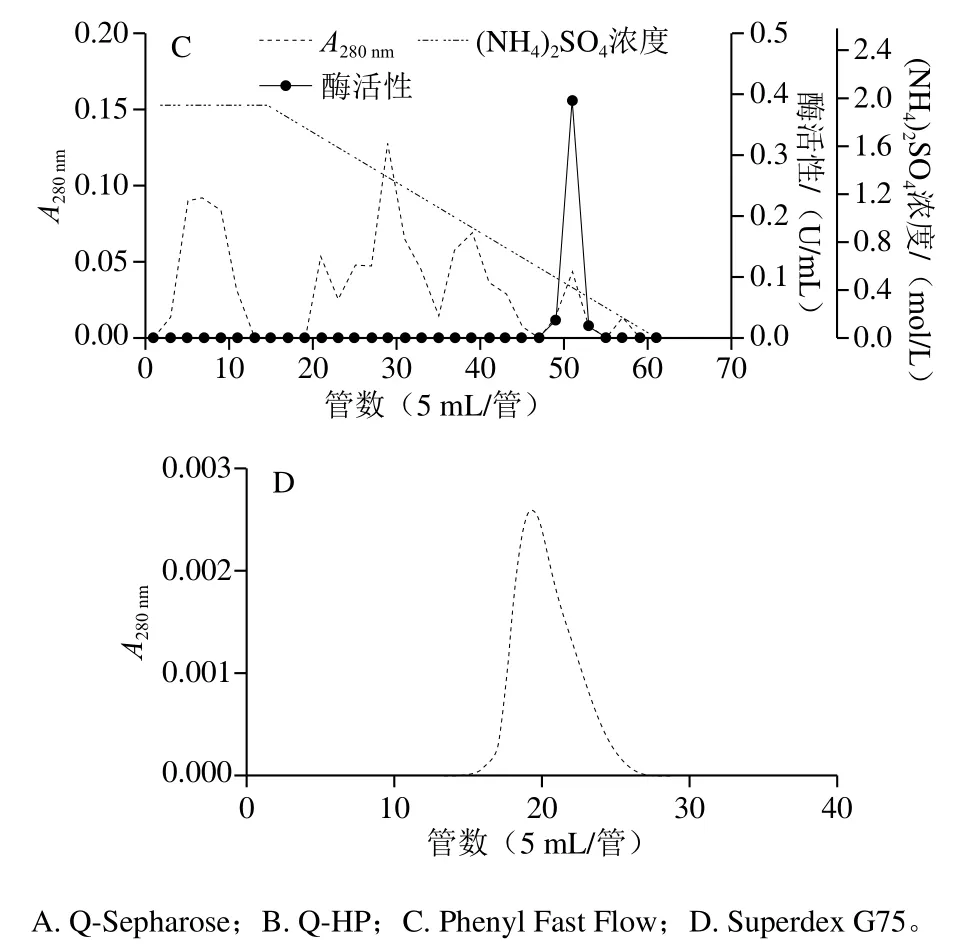
图1 蓝圆鲹肝脏酯酶分离纯化柱层析图Fig. 1 Chromatographic patterns for the purification of esterase from liver of blue round scads

表1 蓝圆鲹肝脏酯酶的纯化Table 1 Summary of the purification steps of esterase from liver of blue round scads
通过银染结果(图2A)可知,纯化的蛋白在还原与非还原条件均显示分子质量为61.18 kDa的单一条带,说明该酶不存在二聚体。该结果与Superdex G75凝胶过滤层析后对照标准蛋白所测算的分子质量一致(图2B),也与其他来源酯酶的分子质量相近,如:鸡肝酯酶的分子质量为63 kDa和58 kDa[20],灰鲻鱼(Mugil auratus)内脏酯酶的分子质量为55 kDa[16]。然而,本实验得到的酯酶分子质量与微生物来源的酯酶存在较大差异,如:曲霉(Aspergillus westerdijkiae)的酯酶分子质量为32 kDa[21],革兰氏阳性链霉菌(Streptomyces lividansTK64)的酯酶分子质量为31.43 kDa[22],伊丽莎白菌(Elizabethkingiasp.)中的酯酶TT1分子质量为103 kDa[5]。对纯化得到的蛋白进行蛋白质串联质谱的肽指纹图谱鉴定,得到一条含14 个氨基酸残基的肽段(LAAPQPVEGWEGVR),检测m/z为1 508.858 3。在NCBInr数据库中进行序列比对,发现其与红鳍东方鲀假定脂酰辅酶A水解酶(序列号:XP_003967349.2 )一致,进一步表明纯化的酶为一种新型酯酶。实验中酯酶鉴定匹配的多肽数量较少可能是由于目前数据库中缺乏足够的鱼类内脏酯酶的蛋白一级序列数据。

图2 纯化酯酶的SDS-PAGE分析(A)、Superdex G75分子质量测定(B)和肽指纹图谱(C)Fig. 2 SDS-PAGE analysis (A), determination of molecular mass by Superdex G75 column chromatography (B) and peptide mass fingerprinting (C) of esterase from liver of blue round scads
2.2 蓝圆鲹酯酶的性质
2.2.1 温度和pH值对酯酶活性的影响
如图3A所示,蓝圆鲹肝脏酯酶的最适温度为50 ℃,在30~60 ℃有较强的活性,当温度上升至70 ℃,酯酶活性明显降低。该酶在4~40 ℃之间有较高的稳定性,随着温度升高,酶稳定性降低,当温度上升到60 ℃后,只保留约30%的酶活性,这与灰鲻鱼内脏酯酶[16]、苏门答腊青霉(Penicillium sumatrense)碱性阿魏酰酯酶[23]、蜡样芽孢杆菌(Bacillus cereusWZZ006)中嗜热性酯酶[24]以及海鲈鱼(Lates calcarifer)肝脏中的脂肪酶[8]相似。而Zhang Yinjun等[4]从芽孢杆菌(Bacillus aryabhattaiB8W22)中分离得到一种新型酯酶,其最适温度仅为30 ℃。Castro等[21]从曲霉(Aspergillus westerdijkiae)中纯化得到一种新型酯酶,其最适温度则为40 ℃。由此可见,鱼和微生物的酯酶在不同温度下的活性可能与其生理活动特性相关。
如图3B所示,蓝圆鲹肝脏酯酶的最适pH值为8.0,在7.0~8.0有较强的活性,当pH值超过9.0时,酶活性快速下降,并在pH 10.0时完全失活。该酶在pH值在6.0~10.0之间具有较高的稳定性,在酸性环境下不稳定,在pH 4.0时,该酶活性完全丧失。相比之下,在碱性条件下较稳定,当pH值达到11.0时,依然能保留50%以上的活力。这与灰鲻鱼[16]、西葫芦(Cucurbita pepo)[25]以及微生物来源的酯酶[15]相似。酯酶的催化位点通常存在Gly-X-Ser-XGly保守序列,其活性中心由Ser/Cys/Asp-His-Asp/Glu组成的催化三联体构成,而中性偏弱碱性的pH值环境更有利于催化三联体形成电荷中继网,使Ser残基上的—OH表现出亲核特性,进而攻击底物的酯键[21,26]。

图3 温度和pH值对蓝圆鲹肝脏酯酶活性的影响Fig. 3 Effects of temperature and pH on the activity of esterase from liver of blue round scads
2.2.2 金属离子和Na+对酯酶活性的影响
如图4A所示,金属离子Al3+、K+、Zn2+、Fe2+和Cu2+会使酯酶活性显著下降,其中Fe2+和Cu2+对该酶有强烈抑制作用。Mn2+、Ba2+、Ca2+、Co2+和Mg2+则会促进酶的活性,其中Mn2+对酶的激活作用最强,而Mg2+和Co2+对酶活性的影响较小。二价金属离子对酯酶活性影响的内在机制复杂,其抑制作用可能是由于部分二价金属离子会优先结合到酶的活性中心,进而影响酶与底物的结合与催化[22]。本实验Ca2+对酯酶活性的激活作用与西葫芦酯酶[25]以及灰鲻鱼内脏脂肪酶[27]类似,这可能是由于Ca2+不仅能稳持酯酶空间结构的稳定,还能与Gly-X-Ser-X-Gly相结合,进而增强Ser残基—OH基团的亲核活性[22,26]。而Wang Baojuan等[22]发现Ca2+对革兰氏阳性霉菌TK64酯酶没有激活作用,可能是因为该酶的氨基酸序列中没有Ca2+的结合位点。
为评估酯酶在食品加工中的潜在应用前景,探究了不同浓度Na+对酯酶活性的影响。如图4B所示,在0~2 mol/L范围内,不同浓度Na+对酯酶活性都具有促进作用,在0.02~0.5 mol/L范围内,Na+对酯酶活性具有较强的促进作用,在浓度为0.2 mol/L时促进作用最显著,为空白对照的1.9 倍。这可能是因为Na+改变了溶液的极性,促进了底物与酶活性中心的相互作用,从而使酶活性升高,而高浓度Na+会使酶发生盐析作用,使酶活性降低[16]。
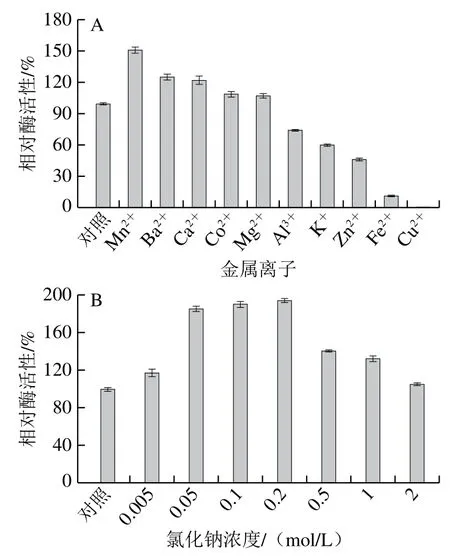
图4 不同金属离子(A)和Na+(B)对酯酶活性的影响Fig. 4 Effects of metal ions (A) and sodium chloride (B) on the activity of esterase from liver of blue round scads
2.2.3 表面活性剂和有机溶剂对酯酶活性的影响
如图5A所示,当用量为1%时,4 种有机溶剂对酯酶活性几乎没有影响,而用量为10%时,4 种有机溶剂对酯酶活性都起到了不同程度的促进作用,其中,丙酮的促进作用较小。值得注意的是,王洁[28]研究发现乙醇和异丙醇会使猪脑乙酰胆碱酯酶活性降低。这类现象被认为是由于水溶性有机溶剂能将水从酯酶中剥离,导致蛋白分子的展开,其内部的疏水残基发生暴露,进而使酶发生了变性失活[29]。而本实验有机溶剂对酶具有激活作用,可能是因为适量的有机溶剂导致酶蛋白空间结构展开反而促进了底物与活性中心的结合,从而提高了酶活性[30]。
表面活性剂经常用于酶的纯化和表征,它们能通过破坏酶的三级结构而引起酶变性,也能防止酶的聚集,从而提高酶活性。因此,在纯化过程中,表面活性剂的选择都是至关重要的。非离子型的表面活性剂曲拉通和吐温20对酯酶活性有较强的抑制作用,其用量越高,抑制作用越强。与吐温20相比,曲拉通对酯酶的抑制作用更强,这可能是因为曲拉通的亲水性更低,导致与酶的亲和性更差[30]。相比之下,曲拉通对芽孢杆菌中的酯酶具有激活作用[4],这也说明蓝圆鲹酯酶与芽孢杆菌酯酶的催化机制不同。另一方面,阴离子表面活性剂SDS对酯酶活性有极强的抑制作用,在1%和10%条件下都使酯酶完全失活。进一步探究不同浓度SDS对酯酶活性的影响,结果如图5B所示,当SDS质量分数为0.1%时就使酯酶完全失活,这可能是SDS能够使酯酶中的氢键和疏水键被破坏从而使其空间构象发生改变从而使酯酶失活[28]。

图5 表面活性剂、有机溶剂(A)和SDS(B)对酯酶活性的影响Fig. 5 Effects of surfactants, organic solvents (A) and SDS (B) on the activity of esterase from liver of blue round scads
2.2.4 酯酶的底物特异性
酯酶的底物特异性是指酯酶在水解不同脂肪酸(不同长度碳链)时表现的特殊反应性[31],一般来说,酯酶对短链脂肪酸(<C10)表现出优先活性,而脂肪酶催化水解和合成不溶于水的长链脂肪酸(>C10)[26]。如表2所示,蓝圆鲹肝脏酯酶在水溶液中对短链脂肪酸的特异性较高,随着底物碳链的增长,其水解能力有所下降。该酶在水溶液中对p-NPA(C2)的水解活性最高,其次是p-NPB(C4),其相对酶活性接近90%,而该酶在水溶液中对p-NPD(C10)和p-NPP(C16)脂肪酸的水解作用微弱。而在乳化体系中,酯酶对p-NPD(C10)和p-NPP(C16)也有较高的水解能力,相对酶活性达到70%以上。以上结果说明,纯化的酶为一种新型酯酶,在界面活化后同时拥有酯酶和脂肪酶的功能,具有较大的应用价值。

表2 酯酶的底物特异性Table 2 Substrate specificity of esterase from liver of blue round scads
3 结 论
通过色谱分离从蓝圆鲹肝脏中分离纯化出一种新型酯酶,分子质量约为60 kDa,最适温度和最适pH值分别为50 ℃和8.0,高温和酸性条件下不稳定,对有机试剂和盐的耐受性高。Zn2+、Cu2+和Fe2+会使酯酶活性显著下降,而Ba2+、Ca2+和Mn2+能显著提高酶活性。该酶在乳化体系中,对短链和长链酯都具有较强的水解能力,同时具备酯酶与脂肪酶活性。
