磁珠提取技术在副溶血弧菌检测中的应用
2021-12-31肖雨诗吴立冬
肖雨诗, 曹 强, 黄 蓉, 程 雷, 刘 娜, 刘 欢, 吴立冬,*
(1.上海海洋大学 水产与生命学院, 上海 201306;2.中国水产科学研究院 农业农村部水产品质量安全控制重点实验室, 北京 100141;3.北京工商大学 北京市食品添加剂工程技术研究中心, 北京 100048)
副溶血弧菌(Vibrioparahaemolyticus)是一种革兰氏阴性嗜盐菌,常见于海水环境以及鱼、虾、蟹、贝等水产品中[1]。近年来,副溶血弧菌中毒事件呈上升趋势,人类误食副溶血弧菌污染的水产品会引起食物中毒,导致肠胃不适、上吐下泻、发热等症状,严重者可能危及生命。调查显示上海市水产样品中副溶血弧菌平均检出率为38.5%,甲壳类水产样品检出率高达51%[2]。邓传燕等[3]对广西、广东沿海等地的对虾进行抽样调查,副溶血弧菌的平均检出率为41.7%,严重影响水产品的食用安全。在我国,副溶血弧菌已被列为水产品安全卫生主要检测项目,尤其是鱼虾类和贝类海产品。目前,副溶血弧菌检测方法主要是分离培养鉴定法(GB 4789.7—2013《食品安全国家标准 食品微生物学检验 副溶血性弧菌检验》)、免疫学检测法、分子生物学检测法。分离培养鉴定法是行业的“黄金标准”,技术成熟、检测成本低,但检测过程耗时长,检测全过程需要7 d左右。免疫学检测法是基于抗原与抗体结合[4],与分离培养鉴定方法相比提高了检测灵敏度,但仍需昂贵的仪器设备和复杂的操作流程。分子生物学检测法克服了上述方法的瓶颈,在副溶血弧菌检测过程中有广阔的应用前景。分子生物学检测通过对待测菌的基因序列进行扩增从而完成检测,与前两种方法相比,该检测方法灵敏度高,特异性好,应用范围广[5]。分子生物学法检测水产样品中副溶血弧菌的关键在于,是否能快速地获得纯净的核酸。因此,开发一种快速,简便的核酸提取方法是解决副溶血弧菌的分子生物学检测的关键[6]。
现阶段,核酸提取方法分为有机法和介质法。有机法通过有机试剂萃取实现核酸提取纯化,此方法可以得到较高纯度的核酸,但操作复杂、费时费力且需接触有毒有害试剂。介质法包括硅胶柱提取法和磁珠法。硅胶柱法提取核酸需要多次高速离心,不利于实现操作的自动化、高通量。磁珠法利用磁性纳米材料的超顺磁性,通过外加磁场控制磁珠分散和聚集以实现核酸与杂质的分离。该方法方便快速,无需离心机等装置,便于自动化操作,有利于副溶血弧菌的快速检测和高通量检测。随着磁性纳米技术的发展,磁珠提取技术被广泛应用于蛋白质[7-8]、核酸[9]、细菌[10]、病毒[11]的分离检测。本研究通过Fe3O4@SiO2磁珠对牡蛎、对虾和贻贝的DNA进行提取纯化,并将提取的DNA用于PCR检测,开发了一种磁珠提取与PCR联用的副溶血弧菌快速检测方法。
磁珠提取技术是通过Fe3O4@ SiO2磁珠表面的硅羟基与DNA形成氢键完成吸附,吸附DNA后在磁场作用下完成DNA与基质杂质的分离[12]。磁珠制备的常见方法包括碱性共沉淀法[13]、溶胶- 凝胶法[14]、溶剂热法[15-16]等。本研究通过碱性共沉淀法在20 min内完成Fe3O4磁珠的制备,Fe3O4@SiO2磁珠在室温条件下3 h完成制备。Fe3O4@SiO2磁珠表面光滑、分散性良好、饱和磁化强度高,在磁场的作用下可快速完成DNA与杂质的分离,副溶血弧菌DNA提取率高达80%。采用优化后的Fe3O4@SiO2磁珠进行DNA提取,结合PCR联用技术,对市售水产样品(对虾、牡蛎、贻贝)进行副溶血弧菌筛查。结果表明,Fe3O4@SiO2磁珠提取的DNA均可直接用于PCR检测,此技术与国标检测方法(GB 4789.7—2013)相比,检测时间由一周缩短至4 h,提高了副溶血弧菌的检测效率。磁珠提取结合PCR联用技术可检测不同食品中的多种微生物菌种,研究为食品中的微生物快速检测提供了一种实用新方法。
1 材料与方法
1.1 材料与试剂
FeCl3·6H2O、FeCl2·4H2O、柠檬酸钠、正硅酸乙酯(TEOS),上海麦克林公司;氨水(优级纯)、氯化钠、无水乙醇(99.5%)、异丙醇,国药上海沪试公司;盐酸,北京化工厂;蛋白酶K、RNA酶、缓冲液、漂洗液、去蛋白液、洗脱液、组织消化液,北京天根生化科技公司;副溶血弧菌DNA溶液,蓝景科信河北生物科技公司;Qubit buffer、染料,新加坡赛默飞公司;2×EasyTaq PCR SuperMix,北京全式金生物科技公司。除特殊标记外,其他试剂均为分析纯。
实验所测92份市售水产样品(32份对虾、25份牡蛎、35份贻贝)购于河北黄骅地区海鲜农贸市场。
1.2 仪器与设备
IRTracer-100型傅里叶变换红外分光光度计,日本Shimadzu公司;HT7700型透射电子显微镜,日本Hitachi公司;VSM3900型振动样品磁力仪,美国Lake Shore Cryotronics公司;PLUS210型紫外分光光度仪,德国 Analytik Jena公司;D8 Advance型X-射线衍射仪,德国布鲁克光谱公司;Zetasizer Nano Zs型粒度分析仪,英国马尔文科技公司;MS-200型多管漩涡混匀仪,杭州瑞诚仪器有限公司;PL2002型分析天平、S220型pH计,上海梅特勒- 托利多仪器有限公司;4-20R型台式高速冷冻离心机,湖南恒诺仪器设备有限公司;N-EVAP 112型水浴氮吹仪,美国OA公司;SB-5200 DTN型超声机,宁波新芝生物科技公司;Milli-Q型超纯水机,美国Millipore公司;Qubit4 Fluorometer型荧光分析仪,新加坡赛默飞有限公司;044BR7592型电泳仪,美国BIO-RAD公司;0I-600MF Touch型化学发光凝胶成像系统,广州光仪生物科技有限公司;THZ-82N型台式恒温振荡器,上海跃进医疗器械有限公司;Veriti 96-Well Thermal Cycler型PCR仪,新加坡赛默飞有限公司。
1.3 实验方法
1.3.1Fe3O4@SiO2磁珠的制备与表征
1.3.1.1 Fe3O4@SiO2磁珠的制备
通过碱性共沉淀法法制备Fe3O4磁珠,FeCl3·6H2O和FeCl2·4H2O在乙醇和水的混合溶液中与氨水反应,制得Fe3O4磁珠。在碱性条件下通过水解TEOS对Fe3O4磁珠进行SiO2壳包覆。反应示意图见图1。
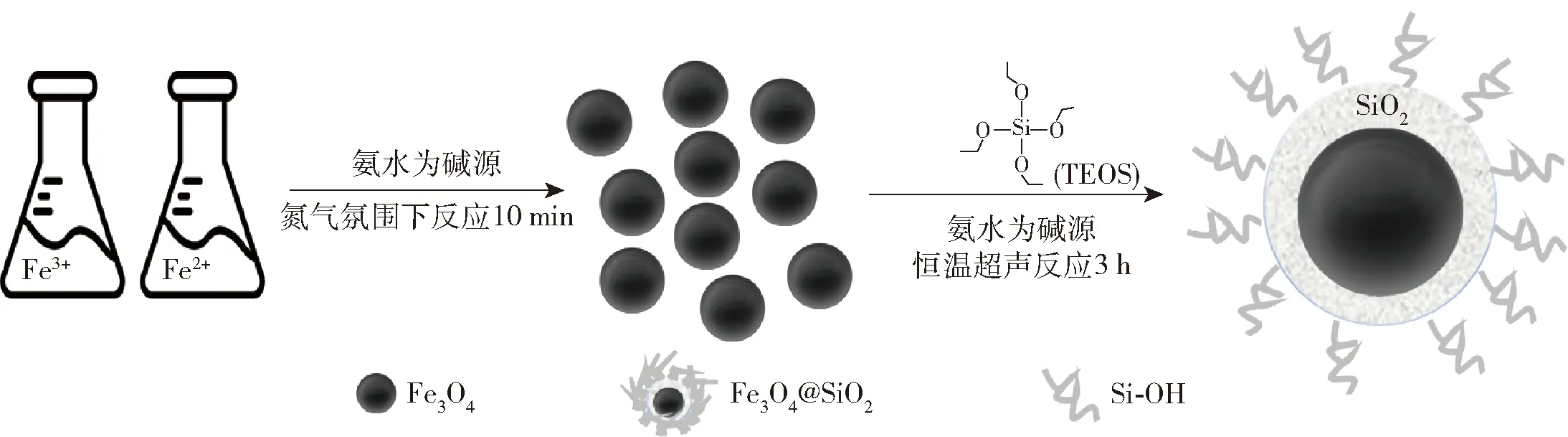
图1 Fe3O4@SiO2磁珠制备流程
分别称取0.448 g FeCl3·6H2O和0.163 g FeCl2·4H2O,将其溶于V(H2O)∶V(乙醇)=1∶1的20 mL混合溶液中,搅拌均匀后转移至50 mL离心管中并氮吹30 min。氮吹结束后,向50 mL离心管中加入1 mL氨水随后将其迅速转移至多管涡旋混匀仪中以1 200 r/min速度剧烈震荡10 min,震荡期间,向离心管中插入氮吹针保持氮气氛围。震荡结束后,将上述溶液装入离心管并转移至磁力架中静置1 min,去除上清液后,离心管内璧表面的黑色物质即为产物Fe3O4磁珠。将Fe3O4磁珠分散于φ=1%的柠檬酸钠水溶液中,通过震荡使Fe3O4磁珠在溶液中均匀分散。再次重复磁分离步骤,将Fe3O4磁珠从柠檬酸钠溶液中分离,随后使用去离子水洗涤Fe3O4磁珠,并将其溶于20 mL去离子水中,最终将Fe3O4磁珠浓度调整为10 mg/mL。
Fe3O4磁珠包SiO2采用超声法,研究中制备了不同粒径的Fe3O4@SiO2磁珠。在50 mL离心管中加入40 mLV(H2O)∶V(乙醇)=4∶1的混合溶液、5 mL Fe3O4磁珠(10 mg/mL)、1 mL氨水并将体系混匀。将反应体系放入超声机,此时缓慢加入不同体积(0、0.5、1.0、1.5、2.0 mL)的TEOS。向超声机中加入冰袋,保持反应在低温中进行,每20 min更换一次冰袋,反应时间为3 h。反应结束后,调节pH值至8±0.5,此时体系中出现沉淀,将产物以10 000 r/min的速度离心5 min,除去上清液并用去离子水和乙醇对产物洗涤3~5次,将产物溶于去离子水。
1.3.1.2 Fe3O4@SiO2磁珠的表征
对Fe3O4磁珠和较佳制备条件下的Fe3O4@SiO2磁珠进行形貌和结构表征。通过粒度分析仪对Fe3O4和Fe3O4@SiO2两种磁珠进行粒径测试,测试前将材料低温超声30 min。Fe3O4和Fe3O4@SiO2磁珠的红外光谱图波长测试范围为400~4 000 cm-1。两种磁珠的晶体结构测试通过X射线衍射仪获得,测试条件为:电流40 mA,电压20 kV,扫描范围为20°~70°。利用振动样品磁力仪对两种磁珠进行磁性分析。将稀释后的Fe3O4和Fe3O4@SiO2磁珠修饰至铜网中,通过透射电子显微镜观察其微观形貌。
1.3.2Fe3O4@SiO2磁珠提取副溶血弧菌DNA能力测定
1.3.2.1 提取前处理方法
用乙醇和去离子水反复洗涤Fe3O4@SiO2磁珠,至上清液澄清透明。除去上清液,随后将Fe3O4@SiO2磁珠在空气中干燥20 min,以m(Fe3O4@SiO2)和m[氯化钠水溶液(200 mmol·L-1)]=4∶15的比例制得磁珠悬浮液,保证不同粒径反应条件下Fe3O4@SiO2磁珠的质量浓度一致。
1.3.2.2 提取副溶血弧菌DNA方法
为了研究Fe3O4@SiO2磁珠与副溶血弧菌DNA的结合能力,本研究首先使用Fe3O4@SiO2磁珠吸附纯净的副溶血弧菌DNA,随后对Fe3O4@SiO2磁珠进行磁分离,并将Fe3O4@SiO2磁珠吸附的DNA洗脱。通过后续测试,研究Fe3O4@SiO2磁珠提取副溶血弧菌DNA的能力。
1) 取2 mL离心管,向离心管中依次加入150 μL缓冲液、300 μL异丙醇和15 μL Fe3O4@SiO2磁珠悬浮液,震荡均匀后分别调节pH值至5.0、7.0、9.0。
2) 向离心管中加入副溶血弧菌DNA溶液并摇匀,将离心管放入磁力架中静置1 min,待Fe3O4@SiO2磁珠贴壁后,移除离心管内液体。
3) 将离心管从磁力架中取下,向离心管中加入600 μL漂洗液,随后震荡均匀。将离心管放入磁力架中静置30 s,Fe3O4@SiO2磁珠贴壁后,移除管内液体。
4) 将离心管从磁力架中取下,向离心管中加入600 μL去蛋白液,随后震荡均匀。将离心管放入磁力架中静置30 s,Fe3O4@SiO2磁珠贴壁后,移除管内液体。
5) 将离心管从磁力架中取下,加入100 μL洗脱液,震荡混匀,随后在水浴锅内65 ℃下孵育3 min。将离心管放入磁力架,待Fe3O4@SiO2磁珠贴壁后,取出上清液,上清液中的DNA,即Fe3O4@SiO2磁珠吸附的副溶血弧菌DNA。
1.3.2.3 副溶血弧菌DNA提取率的计算
通过便携式Qubit4型荧光分析仪测定副溶血弧菌DNA浓度。以V(Qubit buffer)∶V(染料)=200∶1的比例配制Mix溶液。随后以V(Mix溶液)∶V(VP基因组DNA溶液)=199∶1配置浓度测试液。取5 μL测试液放入便携式Qubit4荧光分析仪,测试副溶血弧菌DNA浓度,并计算副溶血弧菌DNA提取率。
副溶血弧菌DNA提取率计算见式(1)。
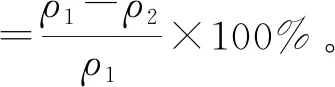
(1)
式(1)中,ρ1为待提取的DNA浓度,ng/mL;ρ2提取后所得DNA浓度,ng/mL。
1.3.2.4 Fe3O4@SiO2磁珠粒径和提取体系pH值的优化
以副溶血弧菌DNA提取率为考察指标,对Fe3O4@SiO2磁珠粒径和提取体系pH值进行优化。优化Fe3O4@SiO2磁珠粒径时,使用不同粒径的Fe3O4@SiO2磁珠同时提取相同副溶血弧菌DNA溶液,不调节pH值,其他实验流程及条件均与1.3.2.2节相同;优化pH值时,使用相同粒径的Fe3O4@SiO2磁珠在不同pH值的提取体系下进行实验,其他流程和条件均与1.3.2.2节相同。
1.3.3水产样品中副溶血弧菌DNA的提取和检测
1.3.3.1 水产样品副溶血弧菌DNA的提取
1) 水产样品前处理方法。将实验水产样品用纯净水冲洗干净,牡蛎和贻贝去壳后取全部内容物,在无菌的条件下将样品搅碎并称取100 mg放入5 mL离心管中。向离心管中依次加入400 μL组织消化液和40 μL蛋白酶K,随后使用均质机匀浆1 min,备用。
2) 水产样品副溶血弧菌DNA提取方法。取2 mL离心管,依次向管内加入400 μL缓冲液和5 μL RNA酶,混合均匀后向离心管内加入300 μL匀浆液,随后将其放入70 ℃水浴锅中孵育10 min。孵育结束后,将混合物以12 000 r/min,离心4 min。转移300 μL上清液到新的2 mL离心管中。向离心管中依次加入150 μL缓冲液、300 μL异丙醇和15 μL Fe3O4@SiO2磁珠悬浮液。随后重复1.3.2.2节中的3)~5)步骤,可获得水产样品中的副溶血弧菌DNA。
3) DNA纯度检测方法。通过紫外分光光度仪测试通过磁分离提取得到的DNA纯度,测试DNA在紫外波长230、260、280 nm的紫外吸收并计算A260/A280和A260/A230,通过比值分析DNA纯度。
1.3.3.2 水产样品副溶血弧菌DNA的检测
1) PCR检测体系和条件。PCR的反应体系为2×EasyTaq PCR SuperMix 15 μL、上下引物各1 μL、DNA模板1 μL(0.1 ng/μL)、灭菌水12 μL。PCR程序最终设定为95 ℃预变性5 min;95 ℃,30 s;60 ℃,30 s;72 ℃,30 s;30个反应循环。在反应中设置阴性、阳性对照,阴性对照以灭菌水代替DNA模板,阳性对照使用待测DNA序列为模板。
2) 引物序列及来源。不耐热溶血素(Thermolabile haemolysin,tlh)是副溶血弧菌的主要致病因子,tlh基因具有特异性[17],针对tlh基因利用primer 5.0进行引物设计。委托中美泰和生物技术有限公司合成副溶血弧菌的特异性引物。上引物序列:5′-AAAGCGGATTATGCAGAAGCACTG-3′,下引物序列:5′-GCTACTTTCTAGCATTTTCTCTGC-3′,扩增片段长度为450 bp。
3) 琼脂糖凝胶电泳实验。PCR产物通过琼脂糖凝胶电泳进行观察,10 μL PCR 产物与2 μL loading buffer 6×充分混合并点样于1%的琼脂糖凝胶。在170 V电压下电泳25 min随后染色10 min,在紫外凝胶成像系统中观察结果,并得到琼脂凝胶电泳图。
2 结果与分析
2.1 TEOS加入量对Fe3O4@SiO2磁珠的影响
2.1.1对Fe3O4@SiO2磁珠的粒径影响
研究TEOS添加量对Fe3O4@SiO2磁珠粒径的影响,利用Zetasizer Nano Zs型马尔文粒度仪分析Fe3O4@SiO2磁珠粒径分布,分析结果见图2。
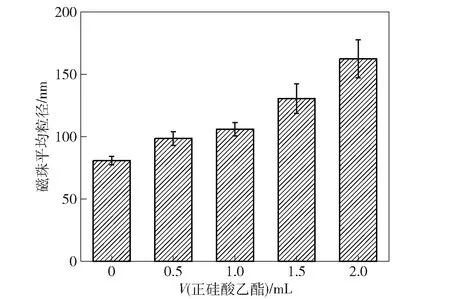
图2 正硅酸乙酯添加量对Fe3O4@SiO2磁珠平均粒径的影响
由图2可知,Fe3O4磁珠的平均粒径为80.74 nm,当TEOS添加量为0、0.5、1.0、1.5、2.0 mL时,Fe3O4@SiO2磁珠平均粒径为98.46、105.89、130.51、162.31 nm。随着TEOS的加入Fe3O4磁珠的粒径逐渐变大,证明SiO2成功包覆在了Fe3O4磁珠表面。TEOS添加量为1.5、2.0 mL时Fe3O4@SiO2磁珠粒径增长幅度突然增加,可能是过量的TEOS碱性条件下水解形成了SiO2聚集体。
2.1.2对Fe3O4@SiO2磁珠的磁性影响
研究TEOS添加量对Fe3O4@SiO2磁珠的磁性影响,通过VSM3900型振动磁力仪分析Fe3O4@SiO2磁珠的磁性,5种磁珠的磁滞回线的分析结果见图3。
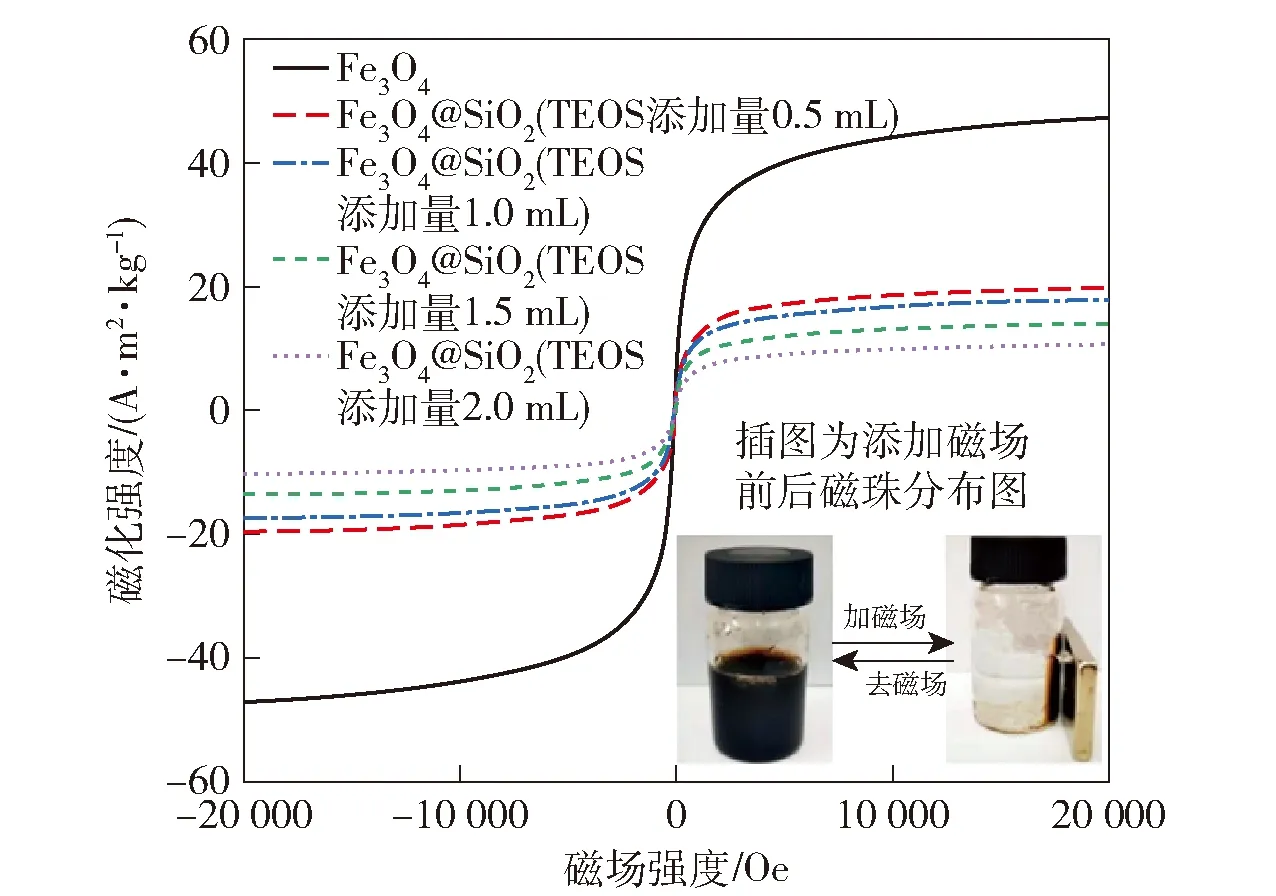
图3 正硅酸乙酯添加量对Fe3O4@SiO2磁珠磁性的影响
由图3可知,5种磁珠均无矫顽力和剩磁,说明这5种磁珠均表现出超顺磁性[18]。5种磁珠的饱和磁化强度为47.27、19.65、17.58、13.78、10.55 A·m2/kg。随着TEOS增加,Fe3O4@SiO2磁珠的饱和磁化强度逐渐降低,原因是磁性Fe3O4核被SiO2包覆在中心,TEOS增加导致了Fe3O4@SiO2磁珠的SiO2层变厚,Fe3O4@SiO2磁珠对磁场的响应能力降低。图3中插图为Fe3O4@SiO2磁珠溶液(TEOS添加量为1 mL)加磁场前后的对比图,在无磁场条件下Fe3O4@SiO2磁珠能均匀分散于去离子水中,在外加磁场条件下可以在10 s内迅速完成固液分离。通过控制磁场有无可以控制Fe3O4@SiO2磁珠快速地分散和聚集,为副溶血弧菌DNA的高效提取奠定了基础。
2.2 Fe3O4@SiO2磁珠提取副溶血弧菌DNA条件的优化
2.2.1Fe3O4@SiO2磁珠粒径对DNA提取率的影响
研究不同粒径的Fe3O4@SiO2磁珠对副溶血弧菌DNA提取率的影响,结果见图4。
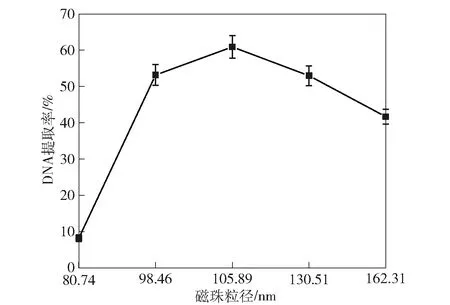
图4 Fe3O4@SiO2磁珠粒径对DNA提取率的影响
由图4可知,当Fe3O4@SiO2磁珠粒径为105 nm、SiO2层为25 nm时,Fe3O4@SiO2磁珠对副溶血弧菌DNA的提取率最高。Fe3O4@SiO2磁珠表面的SiO2含有大量的硅羟基,硅羟基可以与DNA结合形成氢键,从而完成对副溶血弧菌DNA的提取。
随着Fe3O4@SiO2磁珠粒径增大,Fe3O4@SiO2磁珠提取副溶血弧菌DNA的能力先升高再降低。Fe3O4@SiO2磁珠表面硅羟基来源为TEOS水解,当Fe3O4@SiO2磁珠粒径为80.74 nm时(TEOS添加量为0 mL),磁珠实质上为Fe3O4磁珠,其表面无硅羟基,几乎不能吸附DNA;当Fe3O4@SiO2磁珠粒径为98.46 nm 时(TEOS添加量为0.5 mL),DNA提取率升高是由于Fe3O4@SiO2磁珠表面修饰了18 nm的SiO2层,其表面含硅羟基可以结合DNA;当Fe3O4@SiO2磁珠粒径为105.89 nm时(TEOS添加量为1.0 mL),Fe3O4@SiO2磁珠SiO2层为25 nm,此时DNA提取率升高并达到峰值,原因可能是25 nm的SiO2层抑制了Fe3O4@SiO2磁珠之间的相互吸引,Fe3O4@SiO2磁珠表面所有的硅羟基位点都可结合DNA,18 nm的SiO2层较薄,在磁场作用下Fe3O4@SiO2磁珠之间可能发生吸引,占用了Fe3O4@SiO2磁珠与DNA结合的位点,减小了磁珠的比表面积;当Fe3O4@SiO2磁珠粒径为130.51 nm和162.31 nm时(TEOS添加量为1.5 mL和2.0 mL),Fe3O4@SiO2磁珠粒径大,比表面积小,不利于DNA与磁珠的结合,此时Fe3O4@SiO2磁珠的SiO2层厚度为50 nm和80 nm,较厚的SiO2层减弱Fe3O4@SiO2磁珠的磁性,不利于Fe3O4@SiO2磁珠的磁性分离。因此,当Fe3O4@SiO2磁珠粒径为105.89 nm、SiO2层为25 nm时(TEOS添加量为1.0 mL),Fe3O4@SiO2磁珠对副溶血弧菌DNA的提取率最高。
2.2.2体系pH值对DNA提取率的影响
研究不同pH值对Fe3O4@SiO2磁珠提取副溶血弧菌DNA的影响,结果见图5。
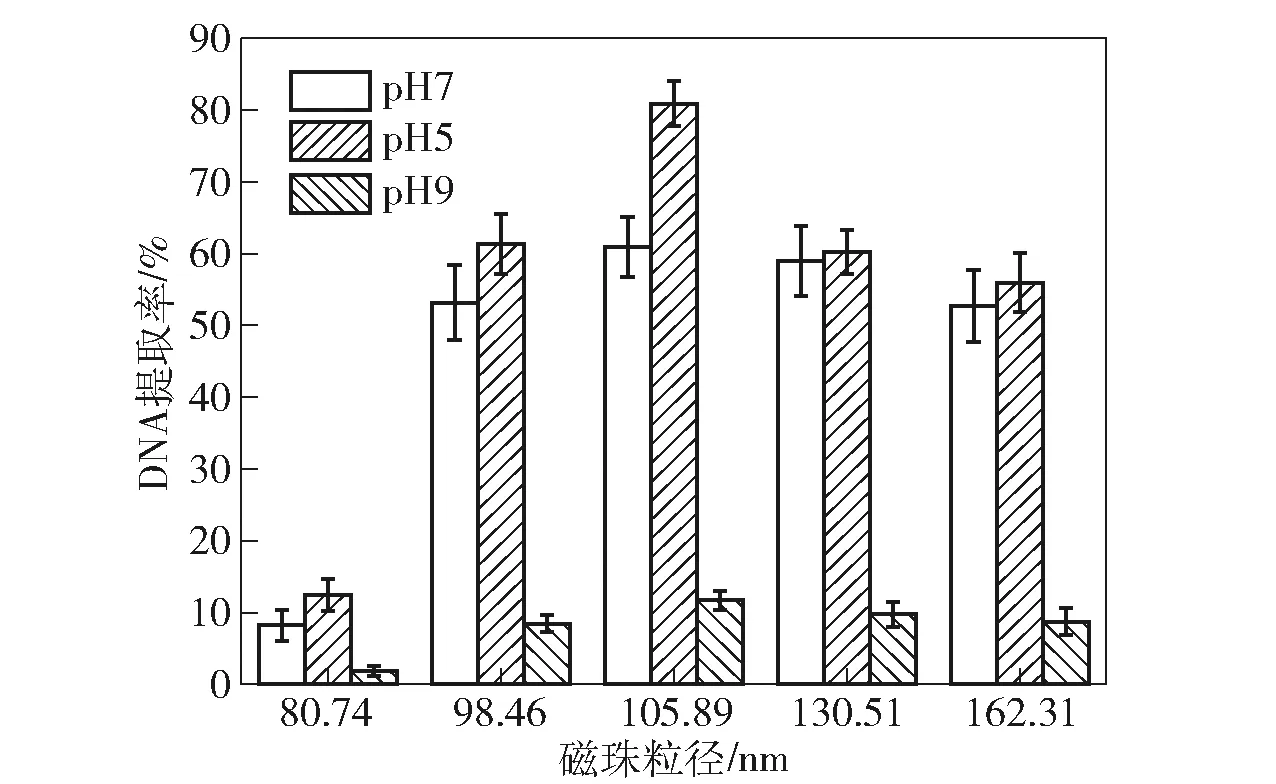
图5 pH值和磁珠粒径对DNA提取率的影响
在碱性条件下DNA易析出,酸性条件下Fe3O4@SiO2磁珠表面的硅羟基易结合DNA[19]。pH值低于5.0时Fe3O4@SiO2磁珠会发生降解并产生杂质,所以在研究中酸性条件下选择pH值为5.0作为测试条件。为了观察酸性、中性、碱性条件下Fe3O4@SiO2磁珠吸附副溶血弧菌DNA的规律,研究中均匀地选取了pH值为5.0、7.0、9.0进行测试。由图5可知,pH值为5.0时副溶血弧菌DNA的提取率为80%左右,高于pH值为7.0和pH值为9.0时副溶血弧菌DNA的提取率,所以pH值为5.0时是本体系中副溶血弧菌DNA提取的较佳条件。pH值为5.0为DNA的较佳提取条件与Xu等[20]的研究结果一致。在3种pH值条件下Fe3O4@SiO2磁珠粒径为105.89 nm时,副溶血弧菌DNA提取率最高。因此,在PCR检测实际样品副溶血弧菌过程中使用平均粒径为105.89 nm的Fe3O4@SiO2磁珠,在pH值为5.0的条件下进行副溶血弧菌DNA富集。
2.3 较佳吸附能力的Fe3O4@SiO2磁珠表征
通过对磁珠性能测试,得到TEOS添加量为1 mL时的Fe3O4@SiO2磁珠对副溶血弧菌DNA吸附能力最强,在后续研究中对TEOS添加量为1 mL,粒径为105.89 nm的Fe3O4@SiO2磁珠进行表征。
2.3.1Fe3O4@SiO2磁珠的微观形貌
通过Ht7700型透射电子显微镜观察Fe3O4磁珠和较佳粒径Fe3O4@SiO2磁珠的形貌和大小,结果见图6。
由图6(a)可知Fe3O4磁珠粒径约为30 nm,未修饰的磁珠不稳定,磁珠间易发生团聚,所以在马尔文粒度仪测量结果中Fe3O4磁珠的粒径稍大;由图6(b)可见,Fe3O4@SiO2磁珠为80~120 nm的球形结构,Fe3O4@SiO2磁珠分散性良好且无团聚现象。由于Fe3O4@SiO2磁珠分散性好,Fe3O4@SiO2磁珠表面的所有硅羟基位点都可结合DNA,提高了DNA的富集能力。图6(c)为高倍镜下单个Fe3O4@SiO2磁珠的透射电镜图,Fe3O4@SiO2磁珠粒径约为120 nm。通过图6(c)可以清晰地观察到Fe3O4@SiO2磁珠为核壳结构,中间为Fe3O4核,核外浅色薄层为SiO2层,SiO2层约25 nm。

图6 磁珠的透射电镜图
2.3.2Fe3O4@SiO2磁珠的结构测试结果
通过傅里叶变换红外分光光度计和X射线衍射仪对Fe3O4和Fe3O4@SiO2两种磁珠进行结构测试,结果见图7。
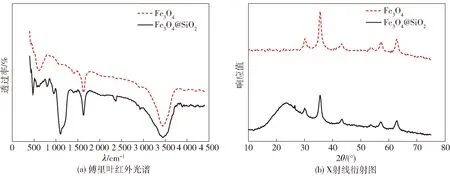
图7 Fe3O4和Fe3O4@SiO2磁珠的傅里叶红外和X射线衍射图
Fe3O4@SiO2磁珠红外测试结果如图7(a),在波长572 cm-1处对应的是Fe3O4四面体的Fe—O键吸收峰;在波长1 100 cm-1处对应的是硅羟基(Si—OH)的特征峰;波长3 514 cm-1处的振动对应O—H伸缩振动。Fe3O4的峰出现在波长550 cm-1左右处,Fe3O4@SiO2磁珠在550 cm-1、1 100 cm-1,均出现较强吸收,说明本研究成功制备了Fe3O4@SiO2磁珠。Fe3O4和Fe3O4@SiO2磁珠的XRD谱图如7(b)所示,在2θ为30.4°、35.5°、43.3°、57.4° 和 62.8°处分别有5个特征衍射峰,分别为Fe3O4尖晶石结构的晶面衍射峰,2θ为23.6°处的宽峰是SiO2的特征峰[21],XRD结果表明本研究制备得到的Fe3O4@SiO2磁珠中Fe3O4和SiO2晶体结构完整。
结合马尔文粒度分析仪、振动磁力分析仪、透射电子显微镜、傅里叶变换红外分光光度计、X-射线衍射仪分析结果可得,本研究制备得到的磁珠为Fe3O4为核SiO2为壳的复合纳米粒子。在TEOS添加量1 mL时,Fe3O4@SiO2磁珠的粒径为105.89 nm、饱和磁化强度为19.65 A·m2/kg。
2.4 水产样品副溶血弧菌DNA的提取和检测结果
2.4.1水产样品副溶血弧菌DNA的提取纯度分析
通过测试本研究提取DNA的紫外吸收值,进一步得到本研究提取的DNA纯度情况,结果见表1。
A280代表蛋白质的吸光值,A260代表核酸的吸光值,A230代表杂质吸光值。当A260/A280比值大于2说明有RNA污染;A260/A280比值小于1.6时,则代表有蛋白质残留;A260/A280比值在1.8~2.0之间代表DNA纯度较高。A230处如果出现强烈吸收说明存在酚类、盐离子等污染,A260/A230在2左右代表DNA纯度较高。由表1可得,所有样品A260/A280比值均在1.8左右,A260/A230比值均在2左右,所以提取的DNA纯度较高,在抽样测试中所有样品A260/A280和A260/A230均在最佳范围内,同时证明了本研究中磁分离DNA方法的稳定性。
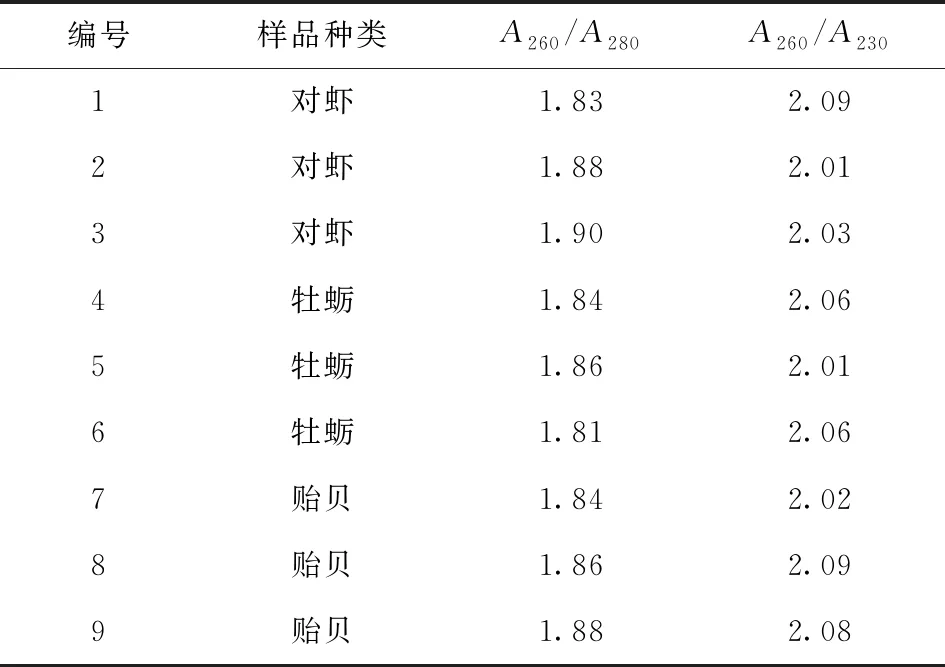
表1 不同种类的部分样品DNA纯度测定结果
2.4.2水产样品副溶血弧菌DNA的检测结果
TEOS添加量为1 mL时制备的Fe3O4@SiO2磁珠,在pH值为5.0的条件下提取对虾、牡蛎、贻贝中副溶血弧菌DNA。目的基因tlh扩增产物条带长度为450 bp,通过PCR检测水产样品中的副溶血弧菌,图8为部分样品的PCR扩增电泳图。
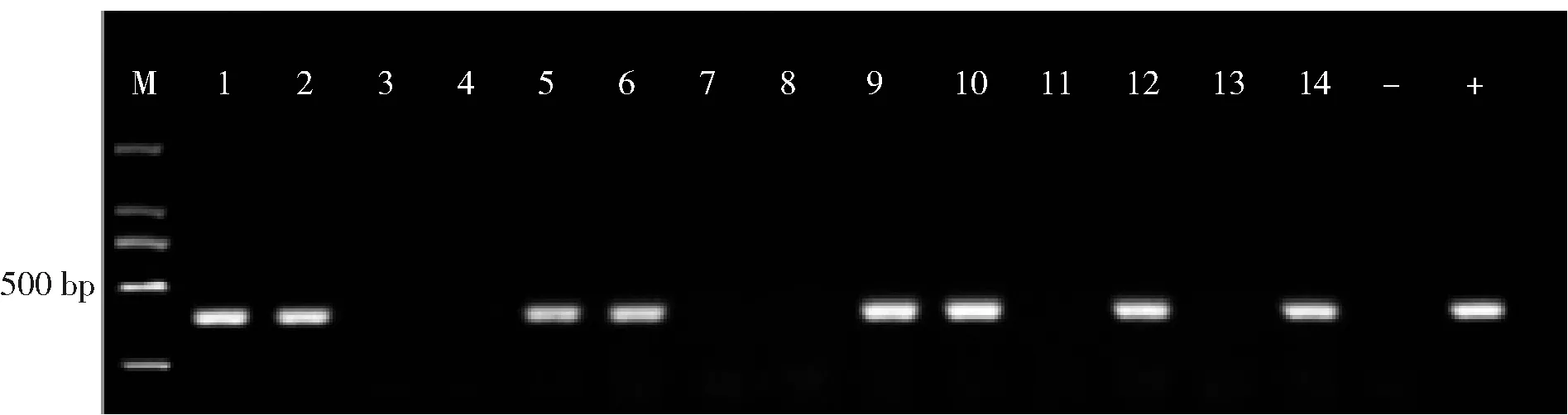
M为2 000 bp DNA marker;-和+为阴性和阳性对照;泳道1、2、5、6、9、10、12、14为tlh基因。
通过DNA磁分离与PCR联用技术对92份水产样品进行副溶血弧菌筛查,对虾、牡蛎和贻贝样品采集量及检出结果见表2。
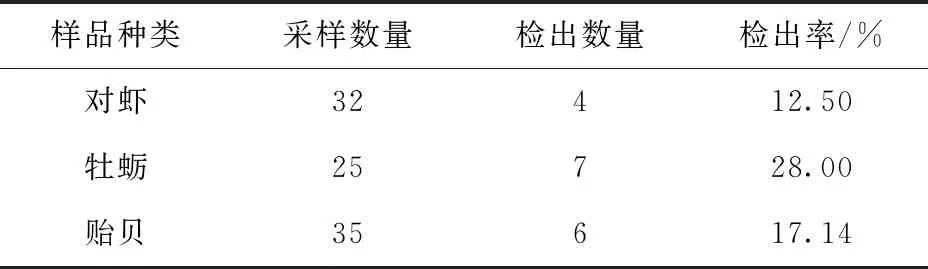
表2 不同水产样品中副溶血弧菌的检测结果
PCR鉴定结果显示,采集的92份样品中有17份样品检测结果呈阳性,检出率为18.4%。其中对虾阳性数为4,占对虾样品总数的12.5%;牡蛎阳性数为7,占牡蛎样品总数的28.0%;贻贝阳性数为6占贻贝样品总数的17.1%。副溶血弧菌检测全流程耗时6 h左右,此方法整体提高了水产样品中副溶血弧菌的检测效率,但同时也存在一定缺陷,此方法无法鉴定活菌与死菌,会出现一定的假阳性概率,只能进行副溶血弧菌的初步筛查。在遇到突发性事件,传统的增菌培养鉴定法无法迅速做出判断时,通过此方法可对副溶血弧菌感染情况进行快速预估,并及时做出相应治理策略。
3 结 论
本研究开发了一种Fe3O4@SiO2磁珠制备方法,利用磁珠提取与PCR联用技术快速检测食品中的副溶血弧菌。此方法的关键是副溶血弧菌DNA的高效分离。通过碱性共沉淀法在20 min内完成Fe3O4磁珠的制备,Fe3O4@SiO2磁珠在室温条件下3 h完成制备。Fe3O4@SiO2磁珠表面光滑、分散性良好、饱和磁化强度高,在磁场的作用下可快速完成DNA与杂质的分离,DNA提取率高达80%。研究过程中,探明了提取体系的pH值和SiO2层厚度对副溶血弧菌DNA提取的影响,确定了pH值为5.0,Fe3O4@SiO2磁珠粒径为105 nm,SiO2层厚度为25 nm是副溶血弧菌DNA提取的较佳条件。在较佳条件下通过磁珠提取与PCR联用技术检测92份市售水产品(牡蛎、对虾、贻贝)其中17份为阳性。该方法耗时短,整个检测过程用时4 h左右,DNA磁提取与PCR联用技术为水产样品中副溶血弧菌的快速检测提供了新的解决思路。本研究开发的副溶血弧菌检测方法具有普遍适用性,此磁珠提取结合PCR联用技术可检测不同食品中的多种微生物菌种,配合核酸自动提取仪可实现高通量自动化检测,此研究为食品中的微生物快速检测提供了一种实用新方法。
