子痫前期孕妇胎盘中HO-1、NF-κB表达与胎儿脐动脉血流的相关性分析
2022-04-19谢程李文亚彭莉
谢程,李文亚*,彭莉
子痫前期作为妊娠期特发疾病,其临床症状主要表现为妊娠20周以后开始出现的高血压,易引发各种母婴不良结局[1]。因此,寻找相关基因修饰靶点,从而采取针对性措施,可能是改善围生儿不良预后的有效措施。目前研究表明,胎儿脐动脉血流参数检测可有效预测围生儿预后情况[2]。血红素氧合酶-1(heme oxygenase-1,HO-1)又称为热休克蛋白32(heat shock protein 32,HSP32),是目前已知的最易受诱导型基因,在胎盘绒毛滋养层细胞、胎盘血管内皮细胞中均有分布[3]。核因子-κB(nuclear factor-κB,NF-κB)是影响细胞正常生长发育的应激转录因子,主要存在于细胞胞浆内[4]。林培红等[5]研究表明,NF-κB和HSP70可能参与子痫前期的发生发展。本研究主要探讨子痫前期孕妇胎盘中HO-1、NF-κB表达水平与胎儿脐动脉血流的关系,以期为改善围生儿不良结局提供新的基因修饰靶点。
1 资料与方法
1.1 一般资料
回顾性分析2019年7月至2020年12月于长江大学附属仙桃市第一人民医院住院分娩的152例子痫前期孕妇,根据病情程度将其分为轻度组74例和重度组78例,同期选取79例正常妊娠孕妇作为正常妊娠组。
纳入标准:① 子痫前期孕妇符合第九版《妇产科学》[6]诊断标准及分度标准;② 孕妇分娩方式为剖宫产;③ 病历资料齐全者;④ 孕妇妊娠期间无其它妊娠内科合并症;⑤ 均为单胎头位妊娠。排除标准:① 孕妇近1个月内有手术外伤史;② 孕妇妊娠期间存在饮酒及吸烟史;③ 已参与其他临床试验或因其它原因中途退出者;④ 孕妇有结核、肝炎或其他传染病史。
本研究经本院临床研究伦理委员会批准,且符合伦理学标准,所有受试者及家属均自愿参加,并签署知情同意书。
1.2 主要试剂与仪器
RNA提取试剂盒(货号:R1200-100)购自北京索莱宝科技有限公司;qPCR SYBR®Green Mix(货号:11203ES03)购自上海高创化学科技有限公司;反转录试剂盒(货号:KL266)购自上海康朗生物科技有限公司。qRT-PCR仪(型号:CFX384)购自美国Bio-Rad公司;彩色多普勒超声诊断仪(型号:Voluson-E8)购自美国GE公司。
1.3 研究方法
1.3.1 样品采集及保存 采集新鲜胎盘,无菌操作取胎盘滋养层组织1 cm×1 cm×1cm(脐带附着处至胎盘另一面中央区1/2处),放入经焦炭酸二乙酯处理的冷冻管中保存待测;同时采集孕妇产前外周静脉血,离心收集血清,-80℃保存待测。
1.3.2 一般资料收集 收集整理受试者一般资料,主要包括孕妇年龄、孕前BMI、孕中期BMI增加、入院孕周、孕次、产次、收缩压、舒张压。同时统计围生儿预后情况,主要包括早产、低出生体质量、围生儿死亡、胎儿宫内窘迫、新生儿窒息。
1.3.3 胎盘中HO-1 mRNA、NF-κB mRNA表达水平测定 采用实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)法检测胎盘及产前血清中HO-1 mRNA、NF-κB mRNA表达水平。采用试剂盒提取胎盘总RNA并反转录为cDNA,采用qRT-PCR仪对HO-1、NF-κB及其内参(GAPDH)进行扩增,引物由上海生工生物工程有限公司合成,引物序列见表1。反应条件:95℃预变性 10 min;95℃ 30 s,60℃ 30 s,72℃ 30 s,40个循环。qRT-PCR反应体系:cDNA(50 ng/μL)2 μL,上下游引物(10 μM)各0.8 μL,qPCR SYBR®Green Mix 10 μL,ddH2O 6.4 μL。每份样品均设3个重复孔,采用2-ΔΔCT法计算胎盘及产前血清中HO-1 mRNA、NF-κB mRNA相对表达量。
1.3.4 胎儿脐动脉血流参数检测 采用彩色多普勒超声诊断仪检测胎儿脐动脉血流参数。探头频率3.5 MHz,受试者取仰卧位,呼吸平静,常规检查羊水指数、胎盘、胎儿各项发育指标,于胎儿安静时检测脐动脉,取样点选取脐带距胎盘附着点2 cm处,脐动脉与取样点夹角小于15°,频谱纵轴显示血流方向及流速,横轴表示时间,获取5个连续且清晰的多普勒频谱后冻结图像,通过仪器自带的软件测量计算脐动脉搏动指数(pulsation index,PI)、阻力指数(resistance index,RI)、收缩末期最大流速与舒张末期最大流速比值(maximum end-systolic flow rate and end-diastale the maximum flow rate ratio,S/D)。当PI≥1.5、RI≥0.8、S/D≥3时判定为脐动脉血流动力学异常,根据胎儿脐动脉血流动力学是否异常将子痫前期孕妇分为血流动力学正常组103例和血流动力学异常组49例。
1.4 统计学分析
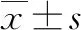
2 结果
2.1 正常妊娠组、轻度组、重度组一般资料比较
正常妊娠组、轻度组、重度组年龄、孕前BMI、孕中期BMI增加、入院孕周、孕次、产次比较,差异无统计学意义(P>0.05);重度组收缩压、舒张压高于轻度组和正常妊娠组,轻度组收缩压、舒张压高于正常妊娠组,差异有统计学意义(P<0.05)。详见表2。
2.2 正常妊娠组、轻度组、重度组胎盘中HO-1 mRNA、NF-κB mRNA表达水平比较
重度组胎盘中NF-κB mRNA水平高于轻度组和正常妊娠组,HO-1 mRNA水平低于轻度组和正常妊娠组,差异有统计学意义(P<0.05);轻度组胎盘中NF-κB mRNA水平高于正常妊娠组,HO-1 mRNA水平低于正常妊娠组,差异有统计学意义(P<0.05)。详见下页表3。
2.3 正常妊娠组、轻度组、重度组胎儿脐动脉血流参数比较
重度组PI、RI、S/D水平高于轻度组和正常妊娠组,轻度组PI、RI、S/D水平高于正常妊娠组,差异有统计学意义(P<0.05),详见下页表4。

表1 qRT-PCR引物序列
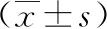
表2 正常妊娠组、轻度组、重度组一般资料比较
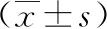
表3 正常妊娠组、轻度组、重度组胎盘中HO-1 mRNA、NF-κB mRNA表达水平比较
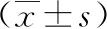
表4 正常妊娠组、轻度组、重度组胎儿脐动脉血流参数比较
2.4 子痫前期孕妇胎盘中HO-1 mRNA、NF-κB mRNA表达水平与胎儿脐动脉血流参数的相关性
Pearson法分析结果显示,子痫前期孕妇胎盘中HO-1 mRNA表达水平与NF-κB mRNA表达水平呈负相关(r=-0.672,P<0.05),且HO-1 mRNA表达水平与PI、RI、S/D均呈负相关(P<0.05),NF-κB mRNA表达水平与PI、RI、S/D均呈正相关(P<0.05)。详见图1、表5。
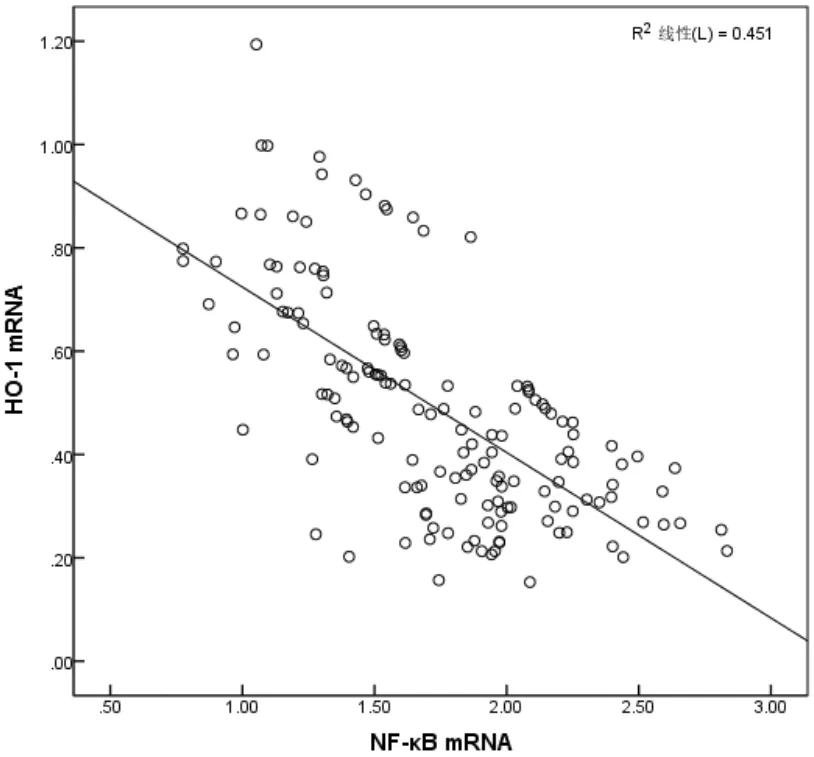
图1 子痫前期孕妇胎盘中HO-1 mRNA表达水平与NF-κB mRNA表达水平的相关性
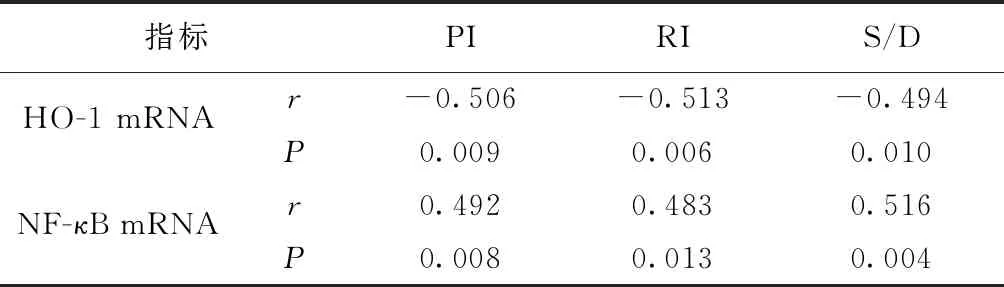
表5 子痫前期孕妇胎盘中HO-1 mRNA、NF-κB mRNA表达水平与胎儿脐动脉血流参数的相关性
2.5 子痫前期孕妇中血流动力学正常组和血流动力学异常组围生儿预后情况比较
子痫前期孕妇中血流动力学异常组不良妊娠结局总发生率高于血流动力学正常组,差异有统计学意义(P<0.05),详见表6。
2.6 子痫前期孕妇中不同围生儿预后组产前血清HO-1 mRNA、NF-κB mRNA表达水平比较
根据围生儿预后情况将子痫前期孕妇分为预后良好组102例和预后不良组50例,预后不良组产前血清NF-κB mRNA水平高于预后良好组,HO-1 mRNA水平低于预后良好组,差异有统计学意义(P<0.05)。详见下页表7。
3 讨论
子痫前期的发病机制目前主要有炎症学说、免疫失衡学说、血管内皮受损学说、胎盘缺血缺氧及氧化应激学说、遗传学说等[7]。有研究推测子痫前期胎盘局部缺血,导致滋养层细胞侵入不足而发生免疫失衡,而免疫失衡又进一步引发氧化应激及慢性炎症反应[8]。子痫前期具有发病早、病情发展迅速、新生儿存活率低等特点,属于妇科临床中难治性疾病类型[9]。
子痫前期会出现全身小动脉痉挛、内皮细胞功能障碍、靶器官血流灌注减少等病理生理变化,进而使肾脏、肝脏以及子宫胎盘灌流等功能下降,最终影响胎儿生长发育,使其出现早产、低出生体质量、胎儿宫内窘迫、新生儿窒息,甚至死亡[10]。而脐动脉是连接胎儿和母体的重要物质交换通道,其血流情况可反映胎儿及胎盘的病理生理变化[11]。彩色多普勒超声技术可对胎儿脐动脉血流参数进行检测和分析,其中PI值主要反映血管搏动性,可辅助判定血管顺应性[12];RI值主要反映血管灌注阻力(血供情况),血供越丰富,RI值越低;而S/D也可间接反映血流灌注量及胎盘的血供情况[13]。本研究结果显示,重度子痫前期孕妇、轻度子痫前期孕妇及正常妊娠孕妇PI、RI、S/D值依次降低,且血流动力学异常的子痫前期孕妇不良妊娠结局总发生率高于血流动力学正常的子痫前期孕妇,与朱薇等[14]研究结果基本一致。提示重度子痫前期孕妇血管灌注阻力高、血管弹性差、血供差,推测其可能原因为:重度子痫前期孕妇病理改变导致血管内皮细胞出现损伤,造成胎盘绒毛小动脉痉挛、血管腔狭窄,胎盘功能降低,脐动脉舒张末期血流减少(PI、RI、S/D值增高),最终使得进入胎盘内部与母体物质交换的血流量减少,影响胎儿正常发育,不良预后发生率增加。
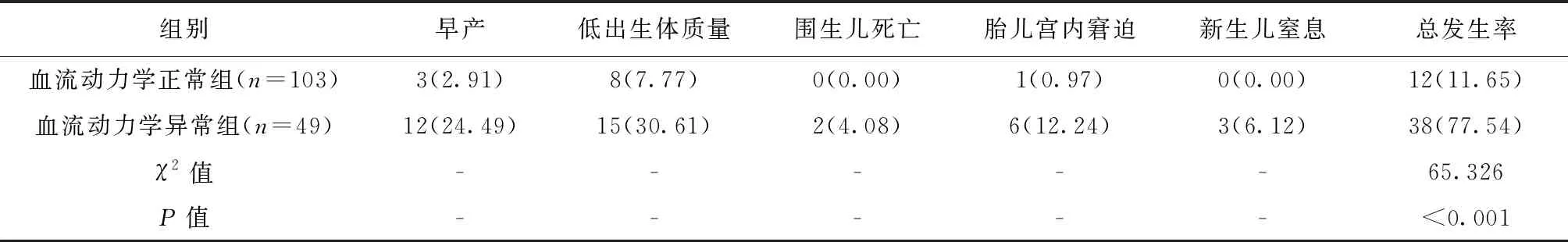
表6 血流动力学正常组和血流动力学异常组围生儿预后情况比较[例(%)]
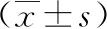
表7 子痫前期孕妇中不同围生儿预后组产前HO-1 mRNA、NF-κB mRNA表达水平比较
HSP是一组热休克反应中合成的蛋白,在各种不利因素刺激下可启动内源性保护机制,发挥应激保护效应[15]。HO-1是HSP家族中的一员,其在胎盘组织中主要参与血流调控、血管生成、抗脂质过氧化、抗炎等过程[16]。本研究结果显示,子痫前期孕妇胎盘中HO-1 mRNA表达水平随着患者病情加重而降低,与王莹等[17]研究结果一致。提示HO-1 mRNA低表达与子痫前期病情进展可能有关,推测子痫前期孕妇体内过度炎症反应可能导致体内HO-1消耗过多,从而发挥应激保护效应。NF-κB是一种普遍存在于细胞和组织中的转录因子,当细胞受到刺激时NF-κB可被诱导激活,继而激活其他炎性因子的表达[18]。本研究结果中子痫前期孕妇胎盘中NF-κB mRNA表达增加,且与疾病严重程度有关。提示NF-κB可能通过高表达参与子痫前期孕妇体内炎症反应。本研究中子痫前期孕妇胎盘中HO-1 mRNA表达水平与NF-κB mRNA表达水平呈负相关,且二者均与血流参数PI、RI、S/D值相关。进一步提示HO-1、NF-κB的相互作用及平衡失调可能参与了子痫前期的发病,进而使得子痫前期孕妇病情加重,胎盘功能下降,用于物质交换的血流量减少,且本研究中围生儿预后不良孕妇产前血清NF-κB mRNA水平高于预后良好孕妇,HO-1 mRNA水平低于预后良好孕妇,初步推测HO-1、NF-κB可能在评估围生儿预后情况中有重要作用。
综上所述,子痫前期孕妇胎盘中HO-1表达水平降低、NF-κB表达水平升高,二者与胎儿脐动脉血流参数PI、RI、S/D均相关。HO-1、NF-κB与子痫前期病情进展有密切联系,且可能是评估围生儿不良预后的重要指标,为临床开发预后评估指标开辟新思路,同时也为今后围生儿不良预后的预防和干预起到积极的推动作用。但还需进一步加大样本量来明确HO-1、NF-κB影响子痫前期疾病的分子基础及其临床应用价值。
