胎盘及脂肪组织中HMGB1表达与胰岛素抵抗程度及产后糖代谢异常的相关性研究
2022-04-19杨斌葛迎春吉冬梅李蓉
杨斌,葛迎春,吉冬梅,李蓉
妊娠期糖尿病(gestational diabetes mellitus,GDM)是妊娠期常见的并发症,表现为妊娠期首次发生的糖尿病及糖耐量异常,一方面危害孕妇及胎儿的健康,另一方面增加孕妇远期发生糖代谢异常及心血管疾病的风险[1-2]。胰岛素抵抗是与GDM发病及未来发展为产后糖代谢异常密切相关的病理生理机制,母体血液循环中的多种激素、细胞因子均会影响胰岛素生物信号转导。胎盘和内脏脂肪组织具有极强的内分泌功能,是孕期母体血液循环中激素和细胞因子的重要来源,研究胎盘和内脏脂肪组织内分泌特征的变化是近些年探究GDM发病机制的热门靶点。
高迁移率族蛋白 B1(high mobility group box 1,HMGB1)是参与炎症反应调控的细胞因子,有研究报道GDM和2型糖尿病患者血清中HMGB1的含量均明显升高且与胰岛素抵抗程度相关[3-4],提示HMGB1的过度分泌可能与胰岛素抵抗的产生或加重有关,进而可能参与GDM及2型糖尿病的发病。脂肪和胎盘均表达HMGB1,但GDM发病过程中脂肪和胎盘中HMGB1所起的作用尚不完全清楚。因此,本研究将收集胎盘组织和大网膜脂肪组织,围绕HMBG1表达的变化展开研究,通过对照研究及相关性分析来阐明HMGB1表达与GDM患者胰岛素抵抗程度及产后糖代谢异常的相关性。
1 对象与方法
1.1 研究对象
选择2018年1月至2020年3月在海安市中医院诊断为GDM并接受剖宫产的58例患者作为GDM组,入组标准:① 孕24~28周时接受口服葡萄糖耐量试验(oral glucose tolerance test,OGTT),符合GDM诊断标准[5];② 孕期进行饮食控制、运动锻炼控制血糖;③ 符合剖宫产指征并行剖宫产,剖宫产当天留取外周静脉血,术中留取大网膜脂肪组织,术后留取胎盘组织;④ 产后6~8周门诊复诊。排除标准:① 孕前患有糖尿病;② 合并子痫前期、肝内胆汁淤积等其他妊娠期并发症;③ 孕期接受胰岛素治疗。另取同期在我院产检并接受剖宫产的60例健康孕妇作为对照组。本研究取得医院伦理委员会批准,获得入组对象知情同意。
1.2 临床样本收集
剖宫产当天抽取空腹肘静脉血5~6 mL置入含有促凝胶的生化采血管内,离心分离血清后放置在-80℃保存;剖宫产术中,切取大网膜脂肪组织块、大小约1 cm×1 cm×1 cm,4~5块,生理盐水清洗后吸干水分,放置在-80℃保存;剖宫产术后,在胎盘母体面、脐带周围2~3 cm处剪取绒毛组织块、大小约1 cm×1 cm×1 cm,4~5块,生理盐水清洗后吸干水分,放置在-80℃保存。
1.3 胎盘及脂肪组织中HMGB1表达的检测
采用RIPA裂解液对胎盘组织和脂肪组织进行匀浆,12 000 r/min、4℃离心10 min,分离上清得到蛋白样本,采用BCA试剂盒检测蛋白浓度,将30 μg蛋白样本用于western blot检测。在SDS-聚丙烯酰胺凝胶中电泳,电转移至PVDF膜,5%脱脂牛奶室温孵育PVDF膜1 h,HMGB1抗体(Abcam公司、1∶1 000稀释)或β-actin抗体(Sigma公司、1∶5 000稀释)4℃孵育PVDF膜过夜,HRP二抗(Abcam公司、1∶2 000稀释)室温孵育PVDF膜1 h,最后在凝胶成像系统(上海天能公司)中显影得到HMGB1及β-actin的条带,根据HMGB1与β-actin条带灰度值的比值计算HMGB1 的蛋白表达水平。
1.4 血清指标检测
采用全自动生化分析仪(美国罗氏公司)检测空腹血糖(fasting blood glucose,FBG),采用电化学发光仪(美国罗氏公司)检测空腹胰岛素(fasting insulin,FINS),代入公式FBG×FINS/22.5计算稳态模型胰岛素抵抗指数(homeostasis model assessment insulin resistance,HOMA-IR);采用酶联免疫吸附法试剂盒(上海西唐公司)检测HMGB1的含量。
1.5 产后糖代谢异常的随访
产后第6~8周时门诊复诊,行OGTT检查,根据结果判断是否存在产后糖代谢异常,糖代谢异常包括:① 糖尿病:FBG≥7.0 mmol/L和/或OGTT 2 h血糖≥11.1 mmol/L;② 空腹血糖受损:FBG 6.1~7.0 mmol/L且OGTT 2 h血糖<7.8mmol/L;③ 葡萄糖耐量受损:FBG 6.1~7.0 mmol/L且OGTT 2 h血糖7.8~11.1 mmol/L。
1.6 统计学方法
2 结果
2.1 两组一般资料的比较
GDM组年龄(29.89±6.58)岁,孕前体质量指数(body mass index,BMI)(23.44±7.15)kg/m2,孕周(37.84±7.15)周,新生儿体重(3.08±0.62)kg;对照组年龄(27.83±10.93)岁,孕前BMI (22.31±6.88)kg/m2,孕周(38.75±10.12)周,新生儿体重(3.36±0.98)kg。两组间年龄、孕前BMI、孕周、新生儿体重的比较,差异无统计学意义(P>0.05)。
2.2 两组血清中HMGB1含量、胎盘及脂肪组织中HMGB1表达水平的比较
与对照组比较,GDM组患者剖宫产当天血清HMGB1的含量、胎盘及脂肪组织中HMGB1的表达水平均明显增加,差异有统计学意义(P<0.05),详见图1、图2及表1。
2.3 GDM组血清中HMGB1含量、胎盘及脂肪组织中HMGB1表达水平的相关性
GDM组血清中HMGB1含量与胎盘及脂肪组织中HMGB1表达水平均具有正相关关系,胎盘组织中HMGB1表达水平与脂肪组织中HMGB1表达水平也具有正相关关系,见图3。
2.4 两组胰岛素抵抗程度的比较
与对照组比较,GDM组患者剖宫产当天FINS含量、HOMA-IR水平均明显升高,差异有统计学意义(P<0.05),详见表2。
2.5 GDM组胎盘及脂肪组织中HMGB1表达与胰岛素抵抗程度的相关性
GDM组患者胎盘及脂肪组织中HMGB1的表达水平与剖宫产当天FINS含量、HOMA-IR水平具有正相关关系,见下页图4。
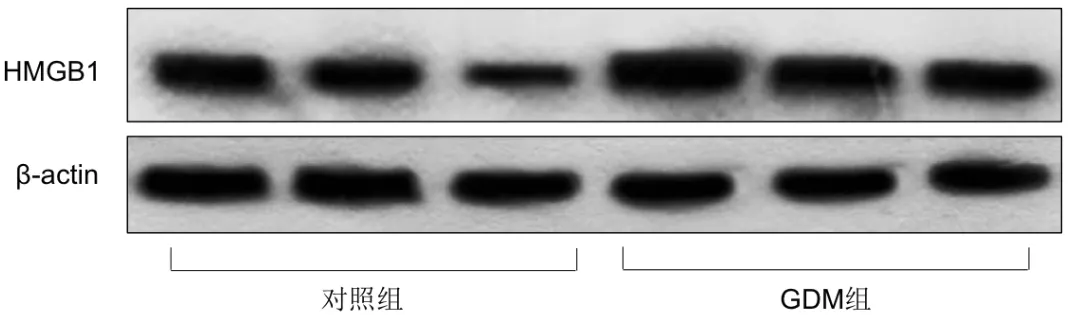
图1 两组胎盘组织中HMGB1的条带图
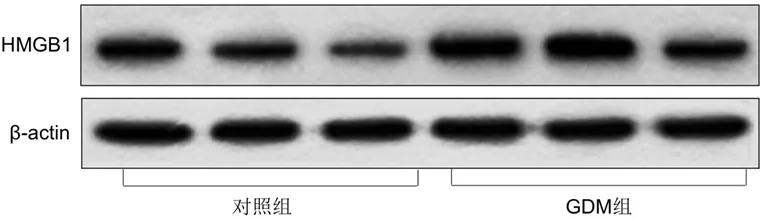
图2 两组脂肪组织中HMGB1的条带图
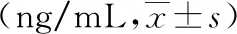
表1 两组血清中HMGB1含量、胎盘及脂肪组织中HMGB1表达水平的比较
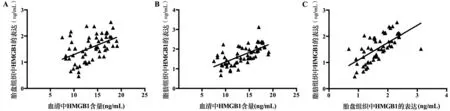
注:A:血清HMGB1含量与胎盘组织HMGB1表达的相关性;B:血清HMGB1含量与脂肪组织HMGB1表达的相关性;C:胎盘组织HMGB1表达与脂肪组织HMGB1表达的相关性。
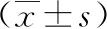
表2 两组胰岛素抵抗程度的比较
2.6 GDM组中产后糖代谢异常患者与产后糖代谢正常患者胎盘及脂肪组织中HMGB1表达水平的比较
与GDM组中产后糖代谢正常患者比较,产后糖代谢异常患者胎盘及脂肪组织中HMGB1的表达水平均明显增加,差异有统计学意义(P<0.05),详见下页图5、图6及表3。
注:A:胎盘中HMGB1与FINS的相关性;B:胎盘中HMGB1与HOMA-IR的相关性;C:脂肪中HMGB1与FINS的相关性;D:脂肪中HMGB1与HOMA-IR的相关性。
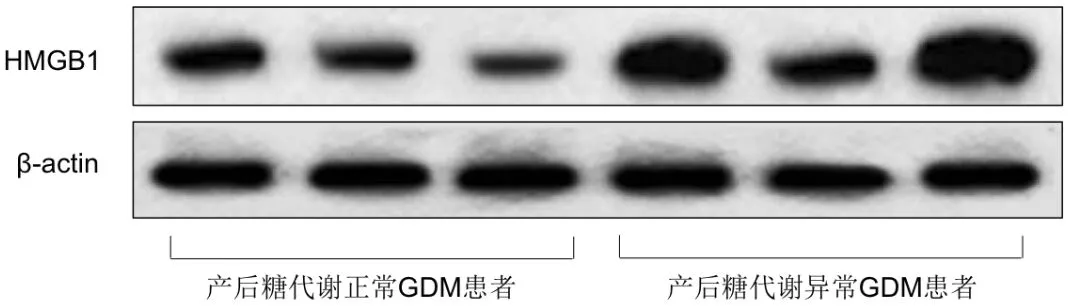
图5 GDM组中产后糖代谢异常患者与产后糖代谢正常患者胎盘组织中HMGB1的条带图
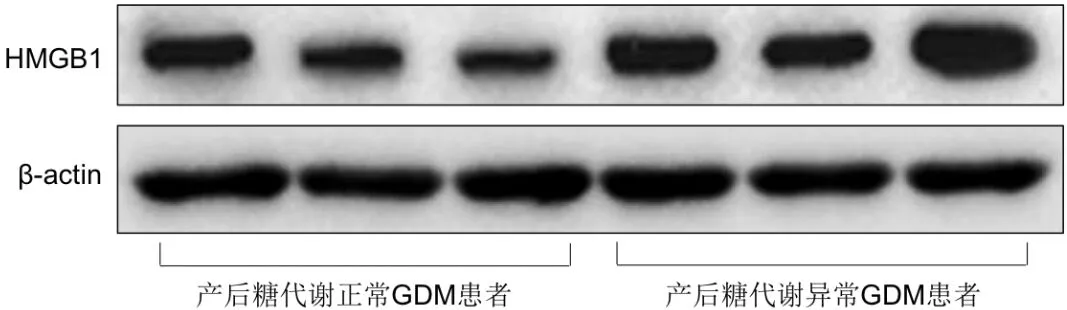
图6 GDM组中产后糖代谢异常患者与产后糖代谢正常患者脂肪组织中HMGB1的条带图
表3 GDM组中产后糖代谢异常患者与产后糖代谢正常患者血清中HMGB1含量、胎盘及脂肪组织中HMGB1表达水平的比较
3 讨论
胰岛素抵抗不仅是GDM主要的病理生理特征,也存在于正常妊娠过程。有研究报道,正常孕妇在孕期的胰岛素敏感性下降约50%,胰岛素分泌量增加250%;而在GDM的发病过程中,胰岛素抵抗程度较正常孕妇显著加重[6]。孕期胰岛素抵抗的产生与母体炎症反应的激活密切相关,肿瘤坏死因子-α(tumor necrosis factor,TNF-α)、白细胞介素(interleukin,IL)-1β、IL-18、HMGB1等是目前已知在孕期分泌增多且与胰岛素抵抗相关的炎症细胞因子,多项研究发现,GDM患者血清中HMGB1、TNF-α、IL-1β、IL-18等的含量明显增加且与胰岛素抵抗程度具有相关性[7-9],本研究也发现GDM患者血清中HMGB1的含量明显高于正常孕妇。但GDM发病过程中母体血液循环中影响胰岛素敏感性的炎症细胞因子的来源尚不清楚,目前GDM的发病机制也未完全阐明。
胎盘和脂肪组织具有较强的内分泌功能,能够合成多种细胞因子、激素等并释放进入血液循环,在妊娠维持、分娩启动、病理妊娠中均起重要作用。胎盘和脂肪组织在GDM的发病过程中也发挥重要作用,国外多项研究发现GDM的脂肪和胎盘组织中存在炎症反应的过度激活[10-12]。HMGB1是重要的炎症细胞因子,本研究发现GDM孕妇胎盘组织和脂肪组织中HMGB1的表达水平明显高于正常孕妇,表明胎盘和脂肪中HMGB1的异常高表达与GDM的发病有关。进一步通过相关性分析发现:GDM患者胎盘和脂肪中HMGB1的表达与血清中HMGB1的含量呈正相关,表明GDM发病过程中母体血液循环内异常增高的HMGB1可能来源于胎盘和脂肪组织中异常高表达的HMGB1;同时本研究还发现胎盘和脂肪中HMGB1的表达具有正相关关系,表明胎盘和脂肪异常高表达的HMGB1可能存在互相促进的作用。
HMBG1对胰岛素抵抗有促进作用,对胰岛素信号转导通路中胰岛素受体底物-1、葡萄糖转运蛋白-4、蛋白激酶B等的表达有抑制作用[13-14]。国内多项研究发现,GDM患者脂肪和胎盘组织中存在胰岛素信号转导障碍,胰岛素信号转导通路中的胰岛素受体底物-1、葡萄糖转运蛋白-4、蛋白激酶B等的表达均明显减少[15-16],表明胎盘和脂肪组织可能在GDM的胰岛素抵抗中发挥重要作用。本研究通过相关性分析发现:GDM患者胎盘和脂肪组织中HMBG1的表达与胰岛素抵抗程度呈正相关,即与FINS含量及HOMA-IR水平呈正相关,表明胎盘及脂肪组织中异常高表达的HMGB1在GDM发病过程中与母体胰岛素抵抗及高胰岛素血症的加重有关。
GDM不仅在孕期威胁孕妇和胎儿的健康,还会增加孕妇远期发生糖代谢异常的风险。产后糖代谢异常同样与胰岛素抵抗有关,Fan Y[17]和Lappas M[18]的研究分别证实GDM患者胰岛素抵抗加重、细胞游离胰岛素DNA水平增加与产后发展为2型糖尿病密切相关。本研究已经证实胎盘及脂肪组织中HMGB1的高表达与GDM胰岛素抵抗的加重有关,在此基础上分析HMGB1与产后糖代谢异常的关系可知:产后6~8周糖代谢异常孕妇胎盘及脂肪组织中HMGB1的表达水平高于糖代谢正常孕妇。笔者分析认为,脂肪组织中HMGB1的高表达可能在产后继续分泌大量HMGB1进入血液循环并引起胰岛素抵抗、导致糖代谢异常;胎盘组织在分娩后离开母体,但本研究的结果发现胎盘组织中HMGB1的高表达也与产后糖代谢异常有关,可能是孕期胎盘组织表达和释放的HMGB1与脂肪组织存在关联、作用于脂肪组织并放大了炎症反应,进而使脂肪组织的炎症反应持续处于放大激活状态,并在产后继续影响胰岛素敏感性、引起胰岛素抵抗。
综上所述,本研究通过以上临床样本的检测和分析发现GDM患者胎盘及脂肪组织中HMGB1高表达与母体血液循环中HMGB1增多、胰岛素抵抗加重及产后糖代谢异常有关,但HMGB1造成胰岛素抵抗的机制、对胎盘和脂肪组织中胰岛素信号转导通路的影响、引起产后糖代谢异常的机制仍有待更多的研究。
