中性粒细胞与淋巴细胞比值、白细胞介素-17 A及转化生长因子- β对局部晚期非小细胞肺癌患者发生放射性肺炎的诊断价值
2022-04-18刘维鹏朱青山冯连杰张庆富付小娜
刘维鹏,朱青山,冯连杰,张庆富,付小娜
安阳市肿瘤医院放疗科,河南 安阳 455000
放疗是局部晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)的主要治疗方法,可以显著改善患者的生活质量并延长生存时间,但是接受放疗的NSCLC患者可能会发生放射性肺炎[1]。放射性肺炎可引起患者呼吸功能障碍并限制放疗剂量,影响疾病控制[2]。在严重的情况下,放射性肺炎可能会导致放射性肺纤维化甚至呼吸衰竭。因此,寻找生物标志物用于放射性肺炎的早期诊断具有重要意义。中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)是炎性反应的重要决定因素,其与许多肺炎性疾病的严重程度和预后密切相关,包括肺部感染、慢性阻塞性肺疾病、结节病等[3]。然而关于NLR是否可以作为放射性肺炎预测指标的研究较少。白细胞介素-17A(interleukin-17A,IL-17A)和转化生长因子-β(transforming growth factor-β,TGF-β)是炎性细胞因子,可反映患者的炎性程度[4]。本研究探讨了接受放疗的局部晚期NSCLC患者的NLR、IL-17A、TGF-β水平及其对放射性肺炎的诊断价值,现报道如下。
1 资料与方法
1.1 一般资料
收集2016年1月至2019年11月于安阳市肿瘤医院接受放疗的局部晚期NSCLC患者。纳入标准:①年龄为19~79岁;②经病理学检查确诊为NSCLC,符合《中国原发性肺癌诊疗规范(2015年版)》[5]中NSCLC的诊断标准;③放射性肺炎的诊断参考美国肿瘤放射治疗协作组(Radiation Therapy Oncology Group,RTOG)/欧洲肿瘤治疗研究协作组(European Organization for Research and Treatment of Cancer,EORTC)制定的诊断标准,患者的放射损伤分级≥2级;④病理分期为Ⅲ期。排除标准:①已经发生广泛性转移;②因食管癌等疾病具有胸部放疗史;③合并慢性阻塞性肺疾病、哮喘等;④合并双肺广泛性肺大疱;⑤合并肺结核、人类免疫缺陷病毒(human immunodeficiency virus,HIV)感染;⑥合并其他系统恶性肿瘤。依据纳入和排除标准,本研究共纳入147例患者。根据是否发生放射性肺炎将患者分为观察组(n=67,发生放射性肺炎)和对照组(n=80,未发生放射性肺炎)。观察组中,男37例,女30例;年龄48~79岁,平均(63.9±6.2)岁;TNM分期:ⅢA期30例,ⅢB期37例;病理类型:腺癌60例,鳞状细胞癌7例;吸烟28例。对照组中,男40例,女40例;年龄50~79岁,平均(64.3±6.6)岁;TNM分期:ⅢA期38例,ⅢB期42例;病理类型:腺癌67例,鳞状细胞癌13例;吸烟31例。两组患者的性别、年龄、TNM分期等临床特征比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审批通过,所有患者均知情同意并签署知情同意书。
1.2 治疗方案
首先确定肿瘤靶区,包括临床靶区和计划靶区。根据患者的肺功能和高危器官数量,使用剂量-体积直方图和等剂量曲线进行综合评估,以确定治疗方案。适形放疗和调强放疗均使用3~5个放射野,放射剂量为45~70 Gy,NSCLC临床靶区剂量为60~70 Gy,每次2.0 Gy,每天5次。双肺接受20 Gy剂量照射的肺体积占全肺总体积的百分比<30%,双肺接受5 Gy剂量照射的肺体积占全肺总体积的百分比<48%,心脏接受40 Gy剂量照射的心脏体积占全心总体积的百分比<50%,脊髓受量不超过45 Gy。在放疗期间,给予患者4个周期的化疗。
1.3 观察指标及检测方法
比较放疗前、放疗结束后两组患者的外周血NLR及血清IL-17A、TGF-β水平。放疗前、放疗结束后分别抽取患者的清晨空腹静脉血3 ml,采用自动血液分析仪检测中性粒细胞计数和淋巴细胞计数,计算NLR。放疗前、放疗结束后分别抽取患者的清晨空腹静脉血5 ml,使用肝素抗凝处理,3000 r/min离心5 min,使用亲和素-生物素复合酶联免疫吸附法检测血清IL-17A、TGF-β水平,试剂盒购自武汉伊莱瑞特生物科技股份有限公司。
1.4 统计学方法
采用SPSS 21.0软件对数据进行统计分析,计量资料以均数±标准差(±s)表示,组间比较采用t检验;计数资料以例数和率(%)表示,组间比较采用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线,计算灵敏度、特异度及曲线下面积(area under the curve,AUC)。以P<0.05为差异有统计学意义。
2 结果
2.1 外周血NLR及血清IL-17 A、TGF- β水平的比较
放疗前,两组患者的外周血NLR及血清IL-17A、TGF-β水平比较,差异均无统计学意义(P>0.05)。放疗结束后,观察组患者的外周血NLR和血清IL-17A水平均明显高于对照组,差异均有统计学意义(P<0.01);两组患者的血清TGF-β水平比较,差异无统计学意义(P>0.05)。放疗结束后,两组患者的外周血NLR和血清IL-17A水平均高于本组放疗前,血清TGF-β水平均低于本组放疗前,差异均有统计学意义(P<0.05)。(表1)

表1 放疗前和放疗结束后两组患者外周血NLR及血清IL-17 A、TGF- β水平的比较
2.2 外周血NLR和血清IL-17 A单独及联合检测对NSCLC患者发生放射性肺炎的诊断效能
以放疗结束后的外周血NLR和血清IL-17A水平绘制ROC曲线,结果显示,外周血NLR诊断放射性肺炎的截断值为2.81,灵敏度为60.00%,特异度为72.50%,漏诊率为40.00%,误诊率为27.50%,AUC 为 0.715(95%CI:0.637~0.793);血清 IL-17A诊断放射性肺炎的截断值为9.06 ng/ml,灵敏度为75.00%,特异度为85.00%,漏诊率为25.00%,误诊率为 15.00%,AUC为0.859(95%CI:0.804~0.914);NLR联合IL-17A诊断放射性肺炎的灵敏度为83.75%,特异度为88.81%,漏诊率为16.25%,误诊率为11.19%,AUC为0.919(95%CI:0.874~0.964)。(图1)
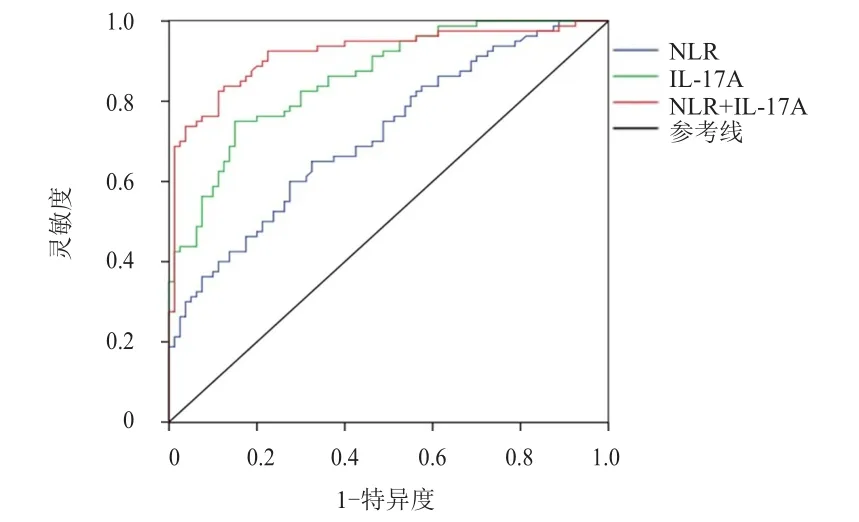
图1 外周血NLR和血清IL-17 A单独及联合检测诊断NSCLC患者发生放射性肺炎的ROC曲线
3 讨论
放疗是局部晚期NSCLC的重要治疗方案。放射性肺炎是肺癌患者放疗期间最常见的剂量限制性不良反应,其发生率可达37%[6]。放射性肺炎早期表现为肺泡上皮细胞和内皮细胞损伤,炎性细胞积累,炎性因子和炎性介质大量表达和释放,成纤维细胞增殖和迁移以及胶原大规模合成,严重者可导致不可逆肺纤维化,进而引起心肺功能衰竭[7]。因此,早期预防、诊断和治疗放射性肺炎尤为重要。放射性肺炎的发生与辐射因素、宿主因素和放射生物学因素有关,血清生物标志物也是放射性肺炎的危险因素[8]。寻找可靠且方便的生物标志物预测放射性肺炎的发生风险对指导临床治疗具有重要意义。
目前炎症被认为是放射性肺损伤的主要致病因素,并且与肺损伤的严重程度和预后密切相关。NLR是炎症的重要决定因素,该指标是中性粒细胞与淋巴细胞的比值,涵盖了两种不同但互补的免疫途径。中性粒细胞可反映机体的非特异性炎性反应,能够增加细胞耗氧量,从而产生大量的氧自由基,最终导致细胞损伤;淋巴细胞是人体参与免疫反应的重要成员,反映免疫系统的调节能力[9]。NLR被认为是许多疾病(包括慢性阻塞性肺疾病和硅肺病)的预后指标。同时,NLR也可作为恶性肿瘤预后的预测指标,但是,尚不清楚NLR是否可以作为放射性肺炎的预测因子[10]。IL-17A作为促炎细胞因子,参与慢性炎症和自身免疫性疾病,能够促进细胞间黏附分子-1(intercellular cell adhesion molecule-1,ICAM-1)的表达,刺激上皮细胞、内皮细胞或成纤维细胞产生IL-6、IL-8、粒细胞集落刺激因子(granulocyte colony stimulating factor,G-CSF),并且还可能成为预测放射性肺炎的重要因素[11-13]。因此,IL-17A作为重要的促炎细胞因子之一,对于放射性肺炎的发生可能具有良好的预测价值。放射性肺损伤是由肺组织中细胞因子的病理变化引起的,其中TGF-β1在人体各种组织和器官中广泛表达,并参与许多器官纤维化的发生和发展[14]。TGF-β1可以抑制上皮细胞和内皮细胞增殖,促进成纤维细胞增殖,刺激成纤维细胞合成和分泌胶原和基质成分,并抑制其降解。研究指出,接受放疗的小鼠肺中的肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)水平显著升高,并且可通过敲除小鼠TNF-α受体减轻放射性肺损伤[15]。因此,TNF-α可能是介导辐射诱导的肺损伤的关键因素。
本研究结果显示,放疗结束后,观察组患者的外周血NLR和血清IL-17A水平均明显高于对照组(P<0.01),说明NLR和IL-17A可能参与放疗后的肺损伤过程,与有关研究结果相同[16-17]。分析原因是治疗过程中细胞因子水平受放射线影响,NLR和IL-17A可能是放射性肺炎的独立危险因素。放疗结束后,两组患者的血清TGF-β水平比较,差异无统计学意义(P>0.05),与Saraya等[18]的研究结果一致,说明血清TGF-β水平与放射性肺炎的相关性较弱,后期仍需进一步验证。放疗结束后,两组患者的血清TGF-β水平均低于本组放疗前(P<0.05),说明放疗有利于减少机体的炎性反应。以放疗结束后的外周血NLR和血清IL-17A水平绘制ROC曲线,结果显示,NLR联合IL-17A诊断放射性肺炎的灵敏度和特异度均高于NLR或IL-17A单独诊断的结果。放射肺损伤的发生是涉及多种细胞因子的复杂过程,单个细胞因子的变化可能无法准确反映这一过程,多个细胞因子联合诊断放射性肺炎可以有效避免单一指标的局限性。
NLR的升高已被证明与恶性肿瘤的预后有关,并且在结直肠癌、肺癌、肝癌和胃癌中的研究已被广泛报道[19-20]。目前较多肺癌相关研究仅对NLR进行检测,而本研究对NSCLC患者放疗前后的外周血NLR和血清IL-17A进行联合检测,充分说明其在发生放射性肺炎的患者中参与免疫炎性反应。但本研究是回顾性分析,且样本量较小,存在一定的局限性,仍需要大样本多中心前瞻性研究进一步证实。
综上所述,发生放射性肺炎的局部晚期NSCLC患者的外周血NLR和血清IL-17A水平均较未发生放射性肺炎的患者显著升高,二者联合检测对于放射性肺炎具有较高的诊断价值。
