丹参酮ⅡA对人膀胱癌J82细胞增殖与凋亡效应及作用机制
2022-04-18戴顺沈瑞林唐晨野汪家盛郭晓
戴顺 沈瑞林 唐晨野 汪家盛 郭晓
丹参酮类化合物又称总丹参酮,是从唇形科植物丹参干燥后的根和根茎中提取的一大类脂溶性菲醌类化合物。丹参酮是其中一种所含丹参含量最高的一种成分,不仅对能够保护人体心血管与神经细胞、改善血液微循环、抵抗慢性肝血管纤维化以及能够诱导体内干扰素细胞功能发生良性分化等均具有重要的保护作用[1],还具有良好的抗肿瘤活性[2]。前期临床研究显示,丹参酮ⅡA 在体外免疫作用中可以有效抑制人体恶性膀胱癌J82细胞的体外增殖,促进其细胞凋亡,且同时降低体外侵袭及细胞迁移时的性能,具有多方面的抗膀胱癌作用[3]。本研究初步探讨丹参酮ⅡA抗膀胱癌作用的机制。
1 材料与方法
1.1 细胞株和主要材料 (1)膀胱癌细胞株来源:人膀胱癌J82细胞(中国科学院上海细胞库)。(2)主要材料:培养基(DMEM)(货号SH30022.01B,美国Hyclone公司),FBS(货号S601S-500,德国Sera & Pro公司),丹参酮ⅡA(货号T4952-5MG,美国Sigma公司),0.25%Trypsin-EDTA细胞消化液(货号0457,美国Amresco公司),青霉素-链霉素双抗混悬液(货号15140-122,美国Gibco公司),PBS缓冲液(美国Sigma公司),牛血清蛋白(BSA)粉剂(美国Abcam公司),丙烯酰胺40%溶液、SDS、TEMED(美国Thermo Fisher公司),甘氨酸、Tris base(美国Amresco公司),SDS(美国VWR公司),PNPP(美国Biolab 公司),APS(美国VWR公司),细胞计数试剂盒(CCK-8)、Annexin V-FITC/碘化丙锭(PI)(日本同仁化学研究所),聚偏二氟乙烯(PVDF)膜(美国Millipore公司)。(3)主要抗体:β-actin抗体(武汉赛维尔生物科技有限公司),caspase 3抗体、caspase 9抗体(美国CST)。
1.2 实验方法 (1)细胞培养:将人膀胱癌J82细胞体外培养,均使用含10%FBS、1%青霉素-链霉素双抗的DMEM(高糖)培养基,将其置于37℃、5%CO2恒温培养箱中培养。(2)丹参酮ⅡA对J82细胞半数抑制率(IC50)的测定:①将对数生长期J82细胞用0.25%胰蛋白酶消化,配制成细胞悬液,通过细胞计数方式,按2,000~4,000个细胞每孔接种于96孔板,每孔加150μL,设置药物浓度分别为1、2、3、5、8 μmol/L的实验组、阴性对照组及空白对照组,每组设4个复孔。将96孔板置于37℃、5%CO2培养箱中培养(过夜贴壁),边缘孔用无菌PBS填充。②细胞培养1 d后,细胞贴壁完全且稳定生长后对其进行加药处理。在实验组中每孔加入相应浓度药物10μL,阴性对照组及空白对照组每孔加入10μL DMEM培基。③置于培养箱中培养48 h后,每孔加入10μL CCK-8试剂,混匀后再孵育2 h。使用酶标仪测定450 nm光吸收值(OD值)。增殖抑制率=1-(实验组OD值-空白对照组OD值)/(阴性对照组OD值-空白对照组OD值)×100%。采用Graphpad Prism软件计算半数抑制浓度(IC50)并绘图。(2)CCK-8法检测丹参酮ⅡA对细胞增殖的影响:①将对数生长期J82细胞用0.25%胰蛋白酶消化,配制成细胞悬液,通过细胞计数方式,按2,000~4,000个细胞每孔接种于96孔板,每孔加150μL。设置不加药物的空白组和加IC50范围浓度的丹参酮ⅡA药物处理组,每组设置4个复孔,同时铺孔5天,边缘孔以及天数间用无菌PBS填充。②将96孔板摇晃混匀,置于37℃、5%CO2恒温培养箱中培养,每天同一时间加入10μL CCK-8试剂,混匀后再孵育2 h。使用酶标仪测定450 nm光吸收值(OD值)。(3)流式细胞术检测细胞周期情况:取对数生长期J82细胞,分别用不同浓度(1、3μmol/L)的丹参酮ⅡA药作用于细胞,另设一组对照组,更换不含药物的培养基,每组设3个复孔,继续培养48 h,观察细胞生长状态是否良好,将各组细胞通过无菌PBS清洗、0.25%胰蛋白酶消化、收集细胞离心制成细胞悬液,经甲醇固定过夜,PBS清洗3次加入适量的Annexin V-FITC溶液与PI染色液共孵育30 min,混匀后转移至上样管,用流式细胞仪检测细胞凋亡与周期情况。(4)免疫印迹法(Western blotting)检测细胞周期、凋亡相关蛋白及p65蛋白的表达情况:将对数生长期J82细胞分别用含1、3μmol/L药物及不含药物的培养基(对照组)处理培养48 h,吸尽旧液,用细胞刮子将细胞刮下来,加入细胞裂解液(100 μL RIPA、1μL PMSF)提取总蛋白(冰上操作,以防蛋白降解),用BCA蛋白定量法测定总蛋白浓度并计算上样量,保持内参一致。经SDS-PAGE电泳,浓缩胶80 V,至分离胶时改电压为120 V,电泳结束后将蛋白转移至PVDF膜上,转膜条件为300 mA,70 min。转膜结束后5%脱脂奶粉封闭1 h。加入一抗稀释液,4℃孵育过夜,次日TBST洗涤5min×3次,再加二抗稀释液,室温避光孵育1 h,TBST避光洗涤5min×3次。进行ECL化学发光曝光、显影。对感光胶片条带进行灰度值分析,以β-actin作为内参,计算目的蛋白的相对表达量。重复3次。
1.3 统计学方法 采用SAS 8.1统计软件。符合正态分布计量资料以(±s)表示。组间整体比较采用单因素方差分析,两两比较采用LSD-t检验。计数资料比较采用χ2检验,两两比较采用Bonfferoni校正法。P<0.05为差异有统计学意义。
2 结果
2.1 丹参酮ⅡA抑制J82细胞增殖 OD值可反映细胞增殖活力 丹参酮ⅡA处理J82细胞48 h后,各组450 nm OD值差异有统计学意义(F=346.35,P<0.001),1μmol/L组与阴性对照组比较的差异无统计学意义(P>0.05),其余不同浓度两组间差异均有统计学意义(P<0.05)。丹参酮ⅡA作用J82细胞48 h的IC50为4.16μmol/L。各药物处理组增殖抑制率差异有统计学意义(F=293.68,P<0.001),且任意两组间差异均有统计学意义(P<0.05)。见表1、图1。确定IC50值后,设置空白对照组和药物处理组,分别作用于J82细胞,CCK-8法测定其1、2、3、4、5 d的增值情况,根据受测细胞的吸光度值,绘制成细胞增殖曲线。见图2。药物处理组细胞增殖速率明显低于空白对照组,差异有统计学意义(P<0.01)。

图2 丹参酮ⅡA的浓度对J82细胞增殖的影响
表1 不同浓度组间450 nm OD值及细胞增殖抑制率的比较(±s)

表1 不同浓度组间450 nm OD值及细胞增殖抑制率的比较(±s)
?

图1 丹参酮ⅡA的J82细胞增殖半数抑制率的测定
2.2 丹参酮ⅡA阻滞J82细胞周期 对照组、1μmol/L组、3μmol/L组 的G1期 细 胞 百 分 比 值分 别 为(42.22%±0.48%)、(47.98%±1.49%)、(54.94%±3.39%),差异有统计学意义(F=41.15,P<0.05),且任意两组间差异均有统计学意义(P<0.05);S期细胞百分比分别为(46.32%±2.14%)、(39.72%±2.88%)、(33.19%±4.17%),差异有统计学意义(F=9.21,P<0.05),但差异主要存在于3μmol/L组与对照组(P<0.05);G2期细胞百分比分别为(14.46%±2.17%)、(13.21%±2.83%)、(9.87%±0.95%),差异无统计学意义(F=3.71,P>0.05)。见图3~4。
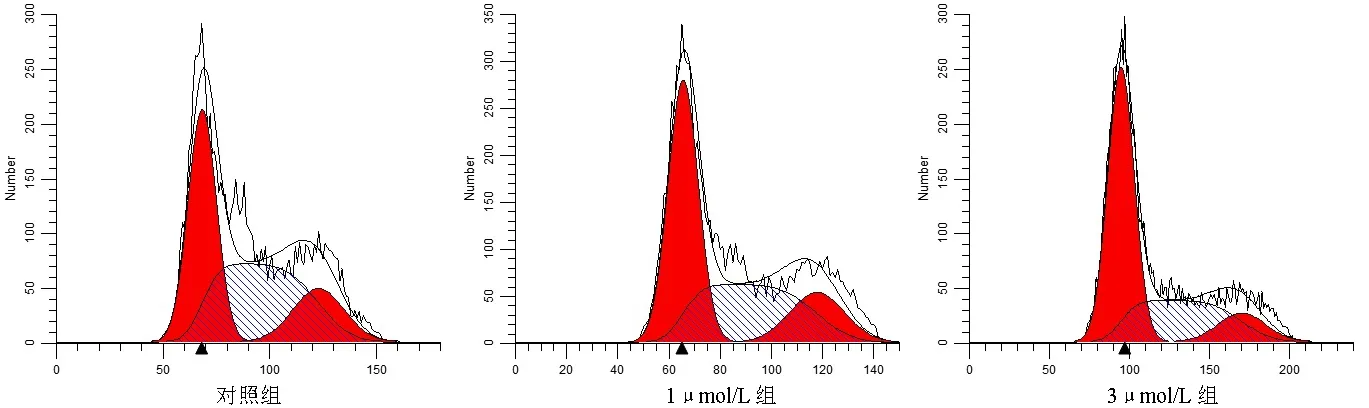
图3 三组J82细胞周期流式检测结果

图4 丹参酮ⅡA对J82细胞周期的影响
2.3 丹参酮ⅡA诱导J82细胞凋亡 对照组、1μmol/L组、3μmol/L组、5μmol/L组的细胞数分别为7,787、10,106、9,502、14,941个;总凋亡率分别为3.36%、12.23%、14.74%、18.40%,差异有统计学意义(χ2=1,028.98,P<0.001)。进一步两两比较显示,3个药物处理组的总凋亡率均高于对照组(χ2=452.65、638.49、1,006.78,P<0.05),3μmol/L组、5μmol/L组的总凋亡率均高于1μmol/L组(χ2=25.59、161.46,P<0.05),5μmol/L组的总凋亡率高于3μmol/L组(χ2=55.14,P<0.05)。见图5。

图5 不同浓度丹参酮ⅡA诱导J82细胞凋亡的流式检测结果(Q1:机械损伤;Q2:晚期凋亡;Q3:正常细胞;Q4:早期凋亡;总凋亡=Q4+Q2)
2.4 丹参酮ⅡA促进J82细胞中caspase 3、caspase 9蛋白的表达 对照组、1μmol/L组、3μmol/L组caspase 3蛋白相对表达量分别为0.26±0.02、0.39±0.02、0.52±0.03,差异有统计学意义(F=113.10,P<0.001),且任意两组间差异均有统计学意义(P<0.05);caspase 9蛋白相对表达量分别为0.02±0.02、0.17±0.03、0.34±0.12,差异有统计学意义(F=15.83,P<0.05),且任意两组间差异均有统计学意义(P<0.05)。对照组、1μmol/L组、3μmol/L组的 cyclin D1蛋白相对表达量分别为0.21±0.02、0.12±0.03、0.05±0.01,差异有统计学意义(F=113.10,P<0.001),且任意两组间差异均有统计学意义(P<0.05)。对照组、1μmol/L组、3μmol/L组Bcl-x蛋白相对表达量分别为0.56±0.04、0.23±0.02、0.08±0.01,差异有统计学意义(F=211.10,P<0.001),且任意两组间差异均有统计学意义(P<0.05)。对照组、1μmol/L组、3μmol/L组P56蛋白相对表达量分别为0.23±0.02、0.10±0.02、0.04±0.01,差异有统计学意义(F=143.20,P<0.001),且任意两组间差异均有统计学意义(P<0.05)。见图6~7。

图6 cyclin D1、Bcl-xL、caspase3、caspase9、P65蛋白在三组J82细胞中表达的Western blotting检测结果

图7 丹参酮ⅡA对J82细胞cyclin D1、Bcl-xL、caspase3、caspase9、P65蛋白表达的影响
3 讨论
膀胱癌是泌尿系统发病率最高的恶性肿瘤,根据病理学分期可分为非肌层浸润性膀胱癌(non-muscleinvasive bladder cancer,NMIBC)和肌层浸润性膀胱癌(muscle-invasive bladder cancer,MIBC),新发病例绝大多数为NMIBC,占70%以上。目前在膀胱癌的治疗以手术为主的综合疗法已得到公认和普及,但并未给患者的预后带来突破性改善。NMIBC经手术治疗后联合膀胱灌注治疗,复发率仍达50%~70%,约10%~15%的患者会进展为MIBC[4]。MIBC的治疗,尽管积极采取根治性膀胱切除术及全身化疗,仍有至少50%的患者在5年内死于肿瘤转移,其中位生存期仅为12~15个月[5]。因此,开发新药物或寻找某些具有良好的抗肿瘤活性的天然药物,应用于膀胱癌以减少复发,具有十分重要的意义。
研究表明,丹参酮类化合物丹参酮ⅡA对骨肉瘤、卵巢癌、肝细胞癌、前列腺癌、结肠癌、食管癌、胃癌、肺癌等多种肿瘤细胞均具有良好的抗肿瘤活性[6-13],其抗肿瘤作用表现在抑制肿瘤细胞增殖、调控细胞周期、诱导细胞分化、诱导肿瘤细胞凋亡及抑制肿瘤细胞侵袭和迁移等诸多方面[14]。丹参酮类化合物也可提高化疗后机体的免疫功能,对机体的免疫脏器也有一定的保护作[15]。该化合物来源于中国传统中药丹参,毒副作用较低,是一种具有潜在临床应用前景的抗肿瘤天然药物,近年来越来越受到关注。
本研究结果显示,丹参酮ⅡA可明显抑制J82细胞的增殖,且抑制率随着药物剂量的增加而增加。这与CHIU等[16]的研究有类似的结果,其发现经丹参酮ⅡA处理后5637、BFTC、T24及TCCSUP四种膀胱癌细胞的存活率均以药物剂量和作用时间依赖的方式显著降低。故丹参酮ⅡA对膀胱癌细胞的增殖抑制作用确切。本研究显示,丹参酮ⅡA可使J82细胞发生G1/S期阻滞,这可能是丹参酮ⅡA抑制J82细胞增殖的机制之一,其中相关的分子机制有待进一步深入研究。本研究还显示,丹参酮ⅡA可诱导J82细胞凋亡,并随着剂量的增加而凋亡率升高。以往有研究显示,丹参酮ⅡA可通过线粒体途径诱导结肠癌、肺癌、前列腺癌等肿瘤细胞凋亡[17-19],也可通过内质网应激途径、死亡受体途径诱导卵巢癌、肝细胞癌凋亡[8,20]。本研究结果显示,凋亡抑制因子cyclin D1、Bcl-xL,P65蛋白表达随药物浓度升高而降低,提升丹参酮ⅡA可抑制凋亡。丹参酮ⅡA可明显增加J82细胞中caspase 3和caspase 9两种蛋白的表达,且药物剂量越高,蛋白表达越多,而caspase 8蛋白的表达则不受药物影响。当线粒体损伤时,线粒体完整性被破坏可导致多种促凋亡因子包括细胞色素C的释放,细胞色素C与胞质中的细胞凋亡蛋白酶活化因子1结合,直接激活caspase9等[21],从而导致细胞凋亡,这表明丹参酮ⅡA很可能通过线粒体介导的凋亡途径来诱导J82细胞凋亡。下一步需要检测该通路上下游的信号分子来进行验证。
综上所述,丹参酮ⅡA在体外可抑制J82细胞增殖,G1/S期阻滞可能是其中的机制之一,同时丹参酮ⅡA可能通过线粒体途径诱导J82细胞凋亡。本研究为丹参酮ⅡA在膀胱癌药物治疗中的应用提供了初步的实验依据,但仅为体外实验,研究结果的科学价值有待进一步开展动物实验及临床试验来验证。
