雷公藤多苷通过线粒体自噬-NLRP3通路干预溃疡性结肠炎的机制分析
2022-04-18吴佩吴佳倩罗依婷钟继红刘英超
吴佩 吴佳倩 罗依婷 钟继红 刘英超
溃疡性结肠炎(ulcerative colitis,UC)是一种慢性非特异性肠道炎症性疾病,主要累及直肠和结肠的黏膜及黏膜下层,表现为反复腹痛、腹泻、黏液脓血便等[1]。黏膜免疫应答紊乱、基因易感性、肠道菌群失衡等多种因素导致UC的发生、发展[2-3]。据报道,UC的发病与NLRP3炎症小体有密切关系[4-5],且线粒体自噬在NLRP3炎症小体的产生激活过程中起关键作用[6-7]。雷公藤多苷是一种从雷公藤植株中提取的五环三帖类化合物,临床上可用于治疗溃疡性结肠炎和克罗恩病[8]。其中雷公藤红素是雷公藤多苷中抑制免疫和抗炎作用的最重要成分[8-10],本研究旨在探讨雷公藤多苷治疗溃疡性结肠炎的作用机制。
1 材料与方法
1.1 动物 雄性BALB/C小鼠24只,体质量22~24 g,由浙江中医药大学动物中心提供,动物生产许可证SCXK(上海)2013-0016。实验严格遵循浙江中医药大学动物保护与使用委员会的伦理规定和“实验动物保护与使用指南”。动物饲养在温度为23±2℃,湿度为55%±10%的无特定病原体的环境中,光照/黑暗周期为12 h,并使用标准的实验室饲料和水。
1.2 细胞 小鼠单核巨噬细胞白血病细胞(RAW264.7)由浙江中医药大学实验室提供,以含10%胎牛血清、10万U/L青链霉素的DMEM培养液培养,置于含5%CO2、37℃培养箱中。根据细胞生长情况换液,1次/12~24 h,细胞生长至70%~80%融合后,用0.25%的胰蛋白酶-EDTA消化液进行传代培养,2~3 d传代1次。
1.3 药物、试剂和抗体 雷公藤多苷购自浙江得恩德制药有限公司,雷公藤红素(LOT:P26A9F600105)购自上海源叶生物科技有限公司。葡聚糖硫酸钠(DSS,MW;36~50 kDa;LOT NO:S0948)购自Sigma-Aldrich公司。PINK1 Antibody、Nur77 Antibody购自上海优宁维生物科技股份有限公司。
1.4 动物分组和干预 适应性饲养2周后,将小鼠随机分为对照组、UC组、雷公藤多苷药物组,给予UC组及药物组小鼠3%DSS溶于水的溶液连续自由饮用7 d构建UC模型,同时给予对照组小鼠等量蒸馏水自由饮用。造模7 d后给予药物组小鼠雷公藤多苷溶液灌胃,同时给予其他小鼠等量蒸馏水灌胃。每天观察记录小鼠体重、毛色、精神状态、粪便性状及颜色等,14 d后处死所有老鼠,取各组病变最严重的结肠组织进行肉眼及组织学检查。
1.5 细胞分组和干预 将RAW264.7细胞设定对照组、脂多糖(Lipopolysaccharide,LPS)组、雷公藤红素药物组,向LPS组及药物组细胞中加入含终浓度为100 ng/mL LPS的DMEM培养液100 μL,同时向药物组细胞中加入含终浓度为0.062,5 μmol/L雷公藤红素的DMEM培养液100 μL。分别培养24 h后,取细胞培养液,提取细胞蛋白并定量、变性进行分析。
1.6 造模及组织学观察 从造模第1天开始,观察小鼠体重变化、粪便性状以及是否便血,计算疾病活动指数(DAI)。造模是否成功取决于大便稀烂程度、是否便血、有无体质量减轻和形态学改变。选取肉眼观病变明显的结肠用10%福尔马林固定,石蜡包埋,切成4 μm厚,切片苏木精-伊红(HE)染色。评估组织学评分。
1.7 NLRP3的mRNA测定 实时定量PCR检测NLRP3mRNA表达。取细胞培养上清液,用紫外分光光度法测定RNA的含量和纯度,分离后分析溶解度曲线,然后用SuperScript III First-Strand合成SuperMix进行qRT-PCR,用SYBR Green PCR Master Mix进行RTPCR Power。采用2-ΔΔCT法测定表达水平。
1.8 Western blotting分析 提取细胞总蛋白后用聚丙烯酰胺凝胶电泳分离,然后转移到PVDF膜上。5%脱脂奶粉(中国上海华比生命科学公司)室温封闭2 h后,与一抗(PINK1 Antibody、Nur77 Antibody)在4℃孵育过夜。随后,膜与辣根过氧化物酶(HRP)偶联的抗鼠或抗兔免疫球蛋白G(IgG)在室温下孵育1 h。通过化学发光增强的HRP底物(微孔)显示该蛋白,并使用Image J软件(NIH)进行定量。
1.9 统计学方法 采用SPSS 22.0统计软件。计量资料用(±s)表示,计数资料用%表示;多组间比较方差齐性时采用方差分析,组间两两比较采用LSD-t法;多组间比较方差不齐时采用Kruskal-wallis H检验。P<0.05为差异有统计学意义。
2 结果
2.1 雷公藤多苷治疗UC小鼠体质量、病理变化 采用3%DSS溶液连续7 d喂养小鼠建立模型,UC组和雷公藤多苷药物组小鼠从第6天开始出现体重减轻、腹泻、便血等症状,UC组小鼠同时出现弓背、活动减少等表现。与UC组比较,雷公藤多苷药物组小鼠上述症状均减轻。结肠组织观察发现,UC组肉眼可见明显结肠萎缩,镜下上皮隐窝丢失,组织间中性粒细胞大量浸润,表皮溃疡等表现。雷公藤多苷药物组结肠未见萎缩,黏膜平整光滑无出血,未见糜烂和溃疡,镜下仅少量炎性细胞浸润。药物组小鼠DAI评分和组织学评分低于UC组(P<0.05)。见图1及表1。
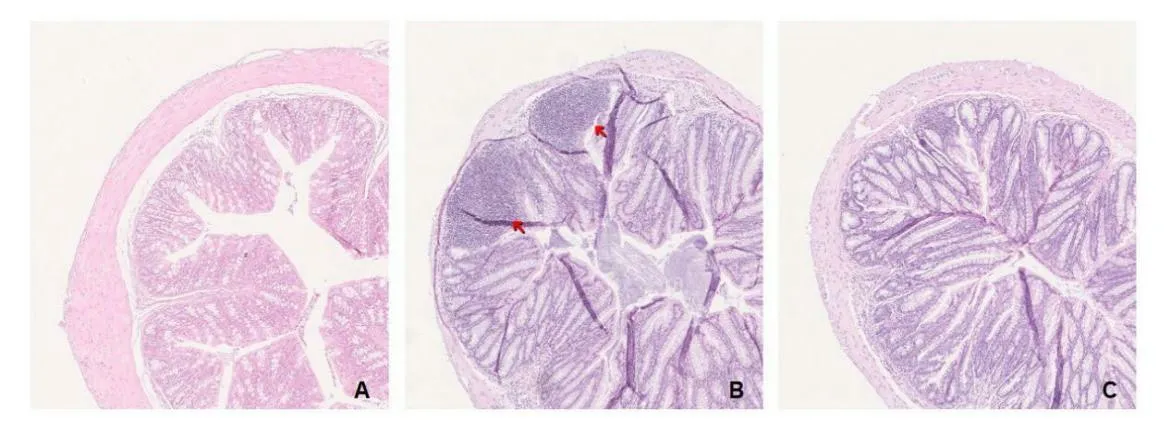
图1 各组光镜下病理改变
表1 不同组体重下降率、DAI和组织学评分比较(±s)
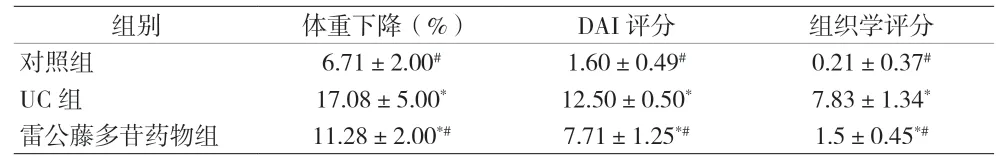
表1 不同组体重下降率、DAI和组织学评分比较(±s)
注:与对照组比较,*P<0.05;与UC组比较,#P<0.05
?
2.2 雷公藤红素对细胞NLRP3 mRNA表达的影响 在RAW264.7细胞中加入100 ng/L的LPS构建炎症模型,并使用0.062,5 μmol/L的雷公藤红素干预。采取PCR法检测各组细胞炎症因子NLRP3的mRNA表达量,结果表明:LPS造模后NLRP3 mRNA相对表达量高于对照组(P<0.05),而雷公藤多苷药物组干预后表达量有明显恢复,但仍高于对照组(P<0.05)。见表2。

表2 不同组细胞NLRP3 mRNA相对表达量比较
2.3 雷公藤红素对细胞线粒体自噬蛋白表达的影响 细胞实验最后阶段收集各组细胞,提取细胞总蛋白,采取Western blotting法检测各组细胞线粒体自噬相关蛋白PINK1、Nur77表达量,结果表明:LPS造模后PINK1、Nur77蛋白表达量显著高于对照组(P<0.05),而药物干预组蛋白表达量较LPS组下降(P<0.05)。见图2。

图2 不同组之间WB法检测细胞线粒体自噬蛋白表达量比较
3 讨论
近年来,亚洲地区UC的发病率呈明显上升趋势[11],目前UC的治疗仍以美沙拉嗪及免疫抑制剂为主[12],但存在一定的不良反应以及停药后的复发问题。雷公藤多苷作为中草药提取药物,临床疗效明确。雷公藤多苷能抑制炎症反应,促进受损黏膜愈合,并对黏膜纤维化具有一定的抑制作用,但其作用机制仍不十分明确。
雷公藤多苷化学成分包含各种二萜、三萜、生物碱以及其它成分如有机酸、木质素、多糖等。其中三萜类化合物具有广泛的生物活性,其代表性化合物有雷公藤红素、雷公藤内酯甲、雷公藤内酯乙等[13]。有研究表明,雷公藤红素参与多种炎症信号通路的调控,如阻断NF-κB激活酶的活性,抑制NF-κB的活化及其核转位,调节丝裂原活化蛋白激酶(MAPK)通路等,是雷公藤多苷中主要抗炎成分[14]。本次实验发现,雷公藤多苷能明显改善UC小鼠症状以及结肠的病理,进一步验证雷公藤多苷对UC小鼠的疗效。大量研究[15-16]表明,UC患者肠黏膜中存在多种促炎因子,而这些炎症因子与NLRP3炎症小体的活化密切相关,NLRP3炎症小体过度激活及IL-1β、IL-18过度释放在UC慢性病程的迁延中起重要作用,而由线粒体产生的ROS与UC发病过程中NLRP3炎症小体的激活有密切关系[17]。作者在前期实验也发现,雷公藤多苷可以通过抑制ROSNLRP3信号通路进而发挥抑制UC小鼠炎症的发生。
雷公藤红素作为雷公藤多苷重要的化合物,具有较强的免疫抑制和抗炎作用,其可以通过调节内源性ROS的信号通路,调节几种关键分子分泌而抑制细胞分化,同时还通过抑制促炎性细胞因子和趋化因子分泌而产生细胞保护作用[18]。在细胞实验中发现,LPS造成的炎症模型中NLRP3蛋白相对表达量增加,而雷公藤红素干预后其明显下调,表明雷公藤红素对炎症反应有明显的抑制作用。同时LPS造模后细胞PINK1、Nur77蛋白表达增加,而雷公藤红素干预后蛋白表达减少。PINK1、Nur77蛋白是线粒体自噬过程中的两种关键蛋白,在外界刺激下,在增殖、凋亡、炎症和自噬等一系列细胞进程中发挥着重要的作用[19],Nur77可以从细胞核里转换至细胞核外细胞浆并定位于线粒体从而诱导细胞凋亡的现象。Nur77从核内转运至线粒体上与肿瘤坏死因子受体相关因子2(TRAF2)相互作用,在炎症状态下,泛素化的Nur77可以增强线粒体自噬的敏感性,形成自噬小体在溶酶体中完成线粒体自噬过程。有研究发现,雷公藤红素抑制炎症的过程与Nur77依赖的线粒体自噬密切相关,线粒体过度清除导致细胞缺氧可能产生细胞毒性作用[19]。通过本实验结果推断,雷公藤红素在一定程度上抑制炎症导致的线粒体自噬,减少线粒体的清除以提供足够的能量来产生细胞保护作用,进而抑制炎症。
