RNA结合蛋白NONO通过影响SKP2、E2F8表达调控乳腺癌细胞增殖的研究
2022-04-15陈景森熊志毅张文夏王恩礼
陈景森,熊志毅,李 欢,张文夏,王恩礼
南方医科大学附属深圳妇幼保健院乳腺科,广东深圳 518017
乳腺癌是威胁女性健康的主要恶性肿瘤,且大多为激素敏感型。RNA结合蛋白(RBP)为重要基因调控蛋白。研究发现,RBP在乳腺癌细胞增殖等生物学活动中发挥重要作用[1]。不含POU结构域的八聚体核苷酸结合蛋白(NONO)为近年新发现的多功能RBP[2]。但NONO在乳腺癌中的确切作用尚未完全明确。S期激酶相关蛋白2(SKP2)和E2F转录因子8(E2F8)为与细胞增殖相关的基因[3-4]。其中SKP2还可通过泛素-蛋白酶体途径,参与调控细胞周期[5]。本研究旨在探讨三者在乳腺癌中的表达,以及沉默NONO是否可通过影响SKP2和E2F8的表达调控乳腺癌细胞增殖和细胞周期。
1 资料与方法
1.1一般资料 选取2019年6月至2020年6月于本院接受根治术治疗乳腺癌患者的乳腺癌组织及癌旁组织石蜡块各43例。纳入标准:(1)手术病理证实为浸润性非特殊乳腺癌[6];(2)性别为女性;(3)年龄18~80岁;(4)组织学分级为Ⅰ~Ⅲ级。排除标准:(1)术前接受过放、化疗等其他抗肿瘤治疗;(2)合并严重肝肾功能不全,或存在其他系统恶性肿瘤等。
1.2试剂与仪器 DMEM培养基、F12培养基均购自武汉普诺赛生命科技有限公司;PBS缓冲液、胰蛋白酶、RIPA液、BCA蛋白浓度测定试剂盒、TBST溶液、EDTA溶液、DAB显色试剂盒、苏木素、总RNA提取试剂盒、通用反转录试剂盒、CCK-8试剂盒均购自北京索莱宝生物技术有限公司;兔抗人NONO/p54nrb抗体、兔抗人SKP2抗体、兔抗人E2F8抗体、兔抗人β-actin抗体、HRP标记二抗均购自美国Sigma公司;荧光定量试剂盒购自美国赛默飞世尔公司;碘化丙啶染色试剂盒(货号KGA214)购自上海元象医疗器械有限公司。实时定量聚合酶链反应(PCR)仪(美国赛默飞世尔公司,QuantStudio3型)、酶标仪(美国赛默飞世尔公司,Multiskan FC型)、流式细胞分析仪(美国赛默飞世尔公司,Invitrogen Attune NxT型)。
1.3方法
1.3.1免疫组化SP染色 取石蜡切片,依次进行脱蜡、水化处理,滴加EDTA溶液进行抗原修复,血清封闭,加入一抗4 ℃过夜,加入二抗室温孵育2 h,DAB显色,滴加苏木素复染,依次进行脱水、透明处理,中性树胶封片,全自动免疫组化染色仪分析染色结果。NONO、SKP2和E2F8蛋白阳性信号为棕黄色或棕褐色颗粒,主要定位于细胞核;根据阳性细胞百分比和染色强度乘积进行半定量分析,在显微镜下每张切片选择5个视野(400倍),每个视野纳入100个细胞,计算平均阳性率和染色强度。阳性率:0~5%计0分;>5%~25%计1分;>25%~50%计2分;>50%~100%计3分。染色强度:未着色0分,浅黄色1分,棕黄色2分,棕褐色3分。然后将阳性率积分与染色强度积分乘积的分值作为蛋白表达积分,蛋白表达积分≥3分为阳性。
1.3.2细胞培养 选用MCF-7细胞(购自北京中科质检生物技术有限公司)置于含10%胎牛血清的新鲜DMEM培养基中培养2~3 d,培养条件为37 ℃、5%CO2。随后吸出原培养瓶中培养基,PBS缓冲液润洗细胞2次,滴加0.25%胰蛋白酶消化细胞,显微镜下观察消化情况,待贴壁松动、细胞变圆后加入完全培养基终止反应,将细胞悬液转移至新培养瓶内,于37 ℃、5%CO2条件下培养。
1.3.3细胞转染 sh-NONO序列正义链5′-GGCGAAGUCUUCAUCCAUAGG-3′,sh-NC序列正义链5′-UUCUCCGAACGUGUCACGUUUC-3′,由上海吉凯基因技术公司合成。取对数生长期细胞,分为MCF-7组(无特殊处理)、sh-NC-MCF-7组(加入携带sh-NC序列正义链的慢病毒LV3液)和sh-NONO-MCF-7组(加入携带sh-NONO序列正义链的慢病毒LV3液),培养24 h后弃去旧培养液,加入含嘌呤霉素和10%胎牛血清的DMEM培养基与F12培养基混合液(1∶1)后继续培养。
1.3.4Western blot检测 取对数生长期细胞,接种于6孔板内,待融合度达80%时,RIPA液裂解细胞,提取细胞总蛋白,采用BCA法定量分析;配置聚丙烯酰胺凝胶电泳液,电泳结束后将样品转移至PVDF膜,滴加含5%脱脂奶粉的TBST溶液封闭1 h,PBS缓冲液冲洗(3×5 min),分别滴加1∶1 000稀释的兔抗人NONO/p54nrb抗体、兔抗人SKP2抗体、兔抗人E2F8抗体,以兔抗人β-actin抗体为内参,4 ℃孵育过夜;PBS缓冲液冲洗(3×5 min),滴加HRP标记二抗,室温孵育1 h,Image ProPlus软件对条带进行定量分析,每组重复3次实验。
1.3.5实时荧光定量PCR(qPCR)检测 取对数生长期细胞,提取细胞总RNA,后反转录为cDNA。设计引物序列:SKP2上游引物5′-ATTGTCCGCAGCGTAAGCTA-3′,下游引物5′-TGCCATAGAGACTCATCAGAGCG-3′;E2F8上游引物5′-CCAACCCTGCTCGGAATA-3′,下游引物5′-TTTCTGGCTCATTACCT-3′;β-actin为内参,上游引物5′-AATCGTGCGTGACTAATTGGAG-3′,下游引物5′-ACTGTGTTGGCGTACAGGTCTT-3′。按照荧光定量试剂盒说明书操作,采用qPCR仪检测目的基因Ct值,以2-ΔΔCt法计算各基因相对表达量,每组重复3次检测。
1.3.6细胞增殖检测 采用CCK-8法检测细胞增殖水平。取对数生长期细胞,接种于96孔板内,调整细胞浓度为1.0×103个/孔,按照试剂盒说明书操作,酶标仪测定波长450 nm处光吸光度(A),A值越大表明细胞数量越多,增殖能力越强,每组重复3次。
1.3.7细胞周期检测 采用碘化丙啶染色法检测细胞周期。取对数生长期细胞,胰蛋白酶消化细胞后,3 000 r/min离心收集细胞,PBS缓冲液冲洗(3×5 min),弃上清,70%乙醇重悬细胞,4 ℃过夜;PBS缓冲液冲洗(3×5 min);按照碘化丙啶染色试剂盒说明书操作,采用流式细胞仪检测细胞周期。

2 结 果
2.1乳腺癌组织及癌旁组织中NONO、SKP2和E2F8表达 乳腺癌组织中NONO、SKP2和E2F8阳性表达率显著高于癌旁组织(P<0.05),见表1。
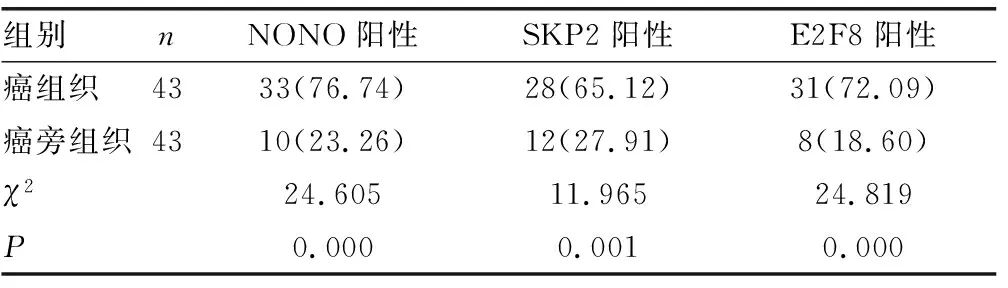
表1 乳腺癌组织及癌旁组织中NONO、SKP2和E2F8的表达情况[n(%)]
2.2NONO沉默效率检测 MCF-7组、sh-NC-MCF-7组和sh-NONO-MCF-7组细胞NONO蛋白相对表达量分别为0.71±0.22、0.72±0.21、0.12±0.04。与MCF-7和sh-NC-MCF-7组比较,sh-NONO-MC-7组细胞NONO蛋白相对表达量降低(P<0.05),提示成功构建NONO沉默MCF-7细胞株。见图1。

图1 NONO沉默效果检测
2.3沉默NONO对乳腺癌细胞增殖能力的影响 与MCF-7和sh-NC-MCF-7组细胞比较,sh-NONO-MCF-7组细胞增殖能力降低(P<0.05),见图2。
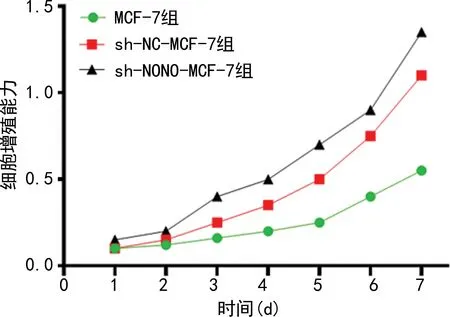
图2 沉默NONO对乳腺癌细胞增殖能力的影响(CCK-8法)
2.4沉默NONO对乳腺癌细胞周期的影响 与MCF-7和sh-NC-MCF-7组细胞比较,sh-NONO-MCF-7组G0/G1期细胞比例显著增加,S期和G2/M期细胞比例显著降低(P<0.05),见图3。
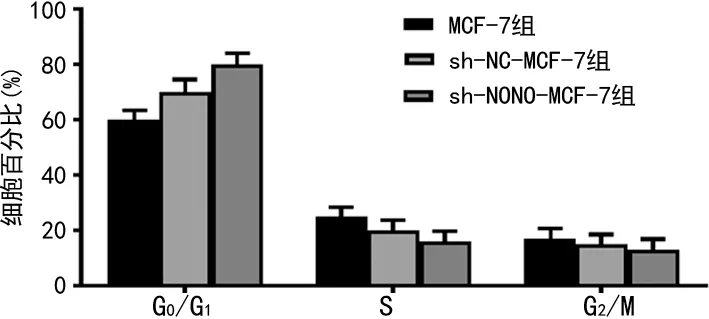
图3 沉默NONO对乳腺癌细胞周期的影响
2.5沉默NONO对乳腺癌细胞SKP2和E2F8表达的影响 Western blot检测显示,与MCF-7和sh-NC-MCF-7组比较,sh-NONO-MCF-7组SKP2和E2F8蛋白表达水平降低(P<0.05);qPCR检测显示,与MCF-7和sh-NC-MCF-7组比较,sh-NONO-MCF-7组SKP2和E2F8 mRNA相对表达水平降低(P<0.05)。见图4。

注:A图中的1为MCF-7组,2为sh-NC-MCF-7组,3为sh-NONO-MCF-7组;A为Western blot检测图;B为qPCR检测结果。
3 讨 论
近年乳腺癌总生存率和无病生存率均呈现出显著上升趋势,但仍有一部分患者预后较差[7]。恶性肿瘤发生、发展过程中存在RNA动态失衡[8]。RBP是一类RNA代谢过程中的重要调控蛋白质分子。既往研究表明,癌组织中RBP相对于癌旁组织异常表达,且与预后密切相关[9]。NONO是RBP重要成员之一。HU等[10]研究发现,NONO水平在肝细胞癌患者中异常上调,并与不良预后有关,基因敲除NONO后,肝癌细胞增殖、迁移受到显著抑制。另有研究发现,NONO可参与非小细胞肺癌细胞泛素化,进而影响细胞增殖、迁移和侵袭[11]。因此,猜测NONO有可能通过泛素化等途径影响乳腺癌细胞生物学活动。SKP2为近年发现的可促进肿瘤细胞周期进展和细胞增殖的癌蛋白。研究发现,下调SKP2可诱导细胞周期阻滞,同时有效抑制乳腺癌细胞增殖[12]。E2F8为E2F家族重要成员。研究发现,E2F8在乳腺癌组织中的表达显著上调,其水平升高与患者总体生存率和无复发生存率显著相关[13]。邢振义等[14]研究发现,E2F8在胶质瘤中存在显著高表达现象,可促进胶质瘤细胞增殖。
本研究中,乳腺癌组织中NONO、SKP2和E2F8阳性表达率显著高于癌旁组织,符合以往研究结果[12,15],表明NONO、SKP2和E2F8表达上调可能参与了乳腺癌发生或发展。转染sh-NONO至MCF-7细胞后,细胞NONO蛋白表达量显著降低,提示成功构建NONO沉默MCF-7细胞株。进一步研究发现,转染sh-NONO后细胞增殖能力显著降低,G0/G1期细胞比例显著增加,S期和G2/M期细胞比例显著降低,提示NONO基因敲除可显著抑制乳腺癌细胞增殖,并诱导细胞周期阻滞,NONO有可能成为乳腺癌治疗的新靶点。为阐明其作用机制,本研究发现,无论是蛋白还是mRNA,转染sh-NONO后细胞SKP2和E2F8表达均显著降低,表明沉默NONO可能是通过下调SKP2和E2F8达到以上抗肿瘤作用的。
综上所述,沉默NONO表达可通过下调SKP2和E2F8表达,诱导细胞周期阻滞,从而抑制乳腺癌细胞增殖。
