MFAP5在非小细胞肺癌组织中的表达情况及其对癌细胞增殖和转移的影响*
2022-04-15王玉环
王玉环,马 进,巴 图
新疆维吾尔自治区人民医院病理科,新疆乌鲁木齐 830001
2018年流行病学数据显示,肺癌在中国所有恶性肿瘤中发病率最高,每年新发病例约78.1万例[1]。肺癌中非小细胞肺癌(NSCLC)最为常见。NSCLC的组织学类型包括腺癌、鳞癌和大细胞癌[2]。近年来,包括靶向治疗在内的新兴治疗方法为NSCLC的治疗带来较理想的效果[3]。因此,开发新的治疗靶点对于改善NSCLC疾病现状具有重要意义。微纤维相关蛋白5(MFAP5)是一种多功能分泌蛋白,在弹性微纤维整合、细胞行为调控和细胞存活中发挥重要作用[4]。研究表明,MFAP5可作为肝内胆管细胞癌诊断和预后的生物标志物,MFAP5表达上调是侵袭性肝内胆管细胞癌患者组织的共同特征[5]。此外,已有相关研究表明,MFAP5的过度表达与头颈鳞癌淋巴结转移和预后差有关,MFAP5促进缺氧诱导的头颈鳞癌迁移、侵袭和上皮-间充质转化(EMT),MFAP5是一个较为理想的头颈鳞癌治疗靶点[6]。目前,关于MFAP5在NSCLC中的作用还尚不明确。因此,本研究旨在探讨MFAP5与NSCLC疾病进展的关系及其对癌细胞的影响,以期为研究新的NSCLC临床治疗靶点提供依据。
1 资料与方法
1.1一般资料 收集2017年4月至2019年8月于本院经外科手术切除的NSCLC患者的癌组织及其对应的癌旁组织各87例。患者年龄41~84岁,平均(62.71±13.00)岁,中位年龄62岁;病理类型:腺癌44例,鳞癌38例,其他5例;TNM分期:Ⅰ期8例,Ⅱ期21例,Ⅲ期26例,Ⅳ期32例。纳入标准:术前未接受过放化疗等辅助治疗;具有完整的临床病理资料;未合并其他肿瘤;无自身免疫系统疾病;无重要器官严重衰竭或功能不全。本研究经本院伦理委员会审核、批准(伦理批号:20170124015),所有患者或其家属均签署知情同意书。
1.2细胞和试剂 人NSCLC细胞A549和人正常肺上皮细胞BEAS-2B(中国科学院细胞库);MFAP5、神经型钙黏蛋白(N-cadherin)、上皮型钙黏蛋白(E-cadherin)、波形蛋白(Vimentin)和GAPDH抗体(武汉三鹰生物技术有限公司);sh-NC和sh-MFAP5慢病毒液(上海吉满生物科技有限公司);AceQ qPCR SYBR Green Master Mix(Q111-02/03)和CCK-8(A311-01)购自南京诺唯赞生物科技有限公司。
1.3方法
1.3.1免疫组化 NSCLC组织及其对应的癌旁组织用4%多聚甲醛固定72 h后,梯度乙醇脱水,二甲苯透明。石蜡包埋、切片。切片脱蜡至水,经抗原修复、封闭后,添加MFAP5抗体(1∶100)4 ℃过夜孵育。二抗(1∶500)37 ℃孵育1 h。DAB显色,苏木精复染,1%盐酸乙醇溶液分化。切片常规脱水、透明,中性树胶封片,光学显微镜观察分析。参考文献[7],根据染色细胞数目和染色程度对免疫组化结果进行评分。其中,0~4分为低表达,5~12分为高表达。
1.3.2细胞分组及慢病毒感染 A549和BEAS-2B细胞用含10% FBS的RPMI-1640培养基,置于37 ℃、5% CO2培养箱中静置培养。待细胞密度达到80%~90%时,胰酶液消化细胞,将部分A549细胞接种于6孔板(1×106个/孔)培养24 h后,用sh-NC和sh-MFAP5慢病毒液(MOI=20)分别感染A549细胞,并在感染48 h后,更换含有嘌呤霉素(2 μg/mL)的培养基筛选培养72 h,分别作为sh-NC组及sh-MFAP5组;不进行病毒感染操作的A549细胞作为空白对照组,BEAS-2B细胞不进行感染操作。
1.3.3实时荧光定量反转录PCR(qRT-PCR)检测 收集A549空白对照组、BEAS-2B组、sh-NC组及sh-MFAP5组细胞,Trizol试剂提取细胞总RNA。将RNA反转录为cDNA,并按照AceQ qPCR SYBR Green Master Mix说明书所示,进行qRT-PCR。反应程序:95 ℃、5 min;95 ℃、10 s,60 ℃、30 s,40个循环;95 ℃、15 s,60 ℃、60 s,95 ℃、15 s。以GAPDH为内参,采用2-ΔΔCt法计算MFAP5 mRNA表达。MFAP5正向引物:5′-GCC AGC CAA AGT AGG AAC AG -3′;MFAP5反向引物:5′-AGC AAG AAA CAG CAG CAC CT-3′;GAPDH正向引物:5′-GGT CAC CAG GGC TGC TTT TA-3′;GAPDH反向引物:5′-GGA TCT CGC TCC TGG AAG ATG-3′。
1.3.4Western blot检测 收集空白对照组、sh-NC组及sh-MFAP5组A549细胞和BEAS-2B细胞,裂解液裂解细胞,收集上清液并测定其蛋白浓度。各取30 μg蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶电泳,分离后的蛋白转至聚偏二氟乙烯(PVDF)膜。5%脱脂奶粉室温条件下封闭3 h,加入MFAP5(1∶2 000)、N-cadherin(1∶1 000)、E-cadherin(1∶1 000)、Vimentin(1∶1 000)和GAPDH(1∶2 000)抗体稀释液,4 ℃条件下孵育过夜。加入二抗(1∶5 000),室温条件下孵育1 h。滴加ECL发光液,凝胶成像系统检测蛋白条带,Image J软件分析各蛋白条带的灰度值。
1.3.5CCK-8检测 将处于对数生长期的空白对照组、sh-NC组及sh-MFAP5组细胞接种于96孔板中(5×103个/孔)。细胞继续培养24、48和72 h后,参照CCK-8说明书,检测各孔在450 nm处的吸光度(A450)值。
1.3.6克隆形成试验 将对处于对数生长期的空白对照组、sh-NC组及sh-MFAP5组细胞均匀接种于培养皿中,每皿接种300个细胞。细胞置于37 ℃、5% CO2培养箱中连续培养2周。4%多聚甲醛室温固定细胞15 min。吉姆萨染色液染色10 min后,流水冲洗,空气干燥。肉眼直接计数克隆数。
1.3.7细胞划痕试验 将处于对数生长期的空白对照组、sh-NC组及sh-MFAP5组细胞接种于6孔板中(5×105个/孔)。24 h后,将枪头垂直于6孔板,沿着直尺进行划痕。细胞经PBS清洗后,加入无血清培养基。细胞继续培养24 h后拍照,Image J软件分析细胞划痕愈合率。
1.3.8Transwell试验 将空白对照组、sh-NC组及sh-MFAP5组细胞接种于提前铺有Matrigel的Transwell上室(5×104个/孔)。将600 μL含10% FBS的RPMI1640培养基加至下室,细胞继续培养24 h。24 h后,取出小室,4%多聚甲醛固定15 min,加入结晶紫染色液染色15 min。显微镜观察细胞侵袭情况。
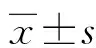
2 结 果
2.1NSCLC组织及其癌旁组织中MFAP5的表达 与癌旁组织相比,NSCLC组织中MFAP5 免疫组化评分明显升高,差异有统计学意义(t=11.238,P<0.001),MFAP5高表达率差异有统计学意义(χ2=37.286,P<0.001)。见图1和表1。
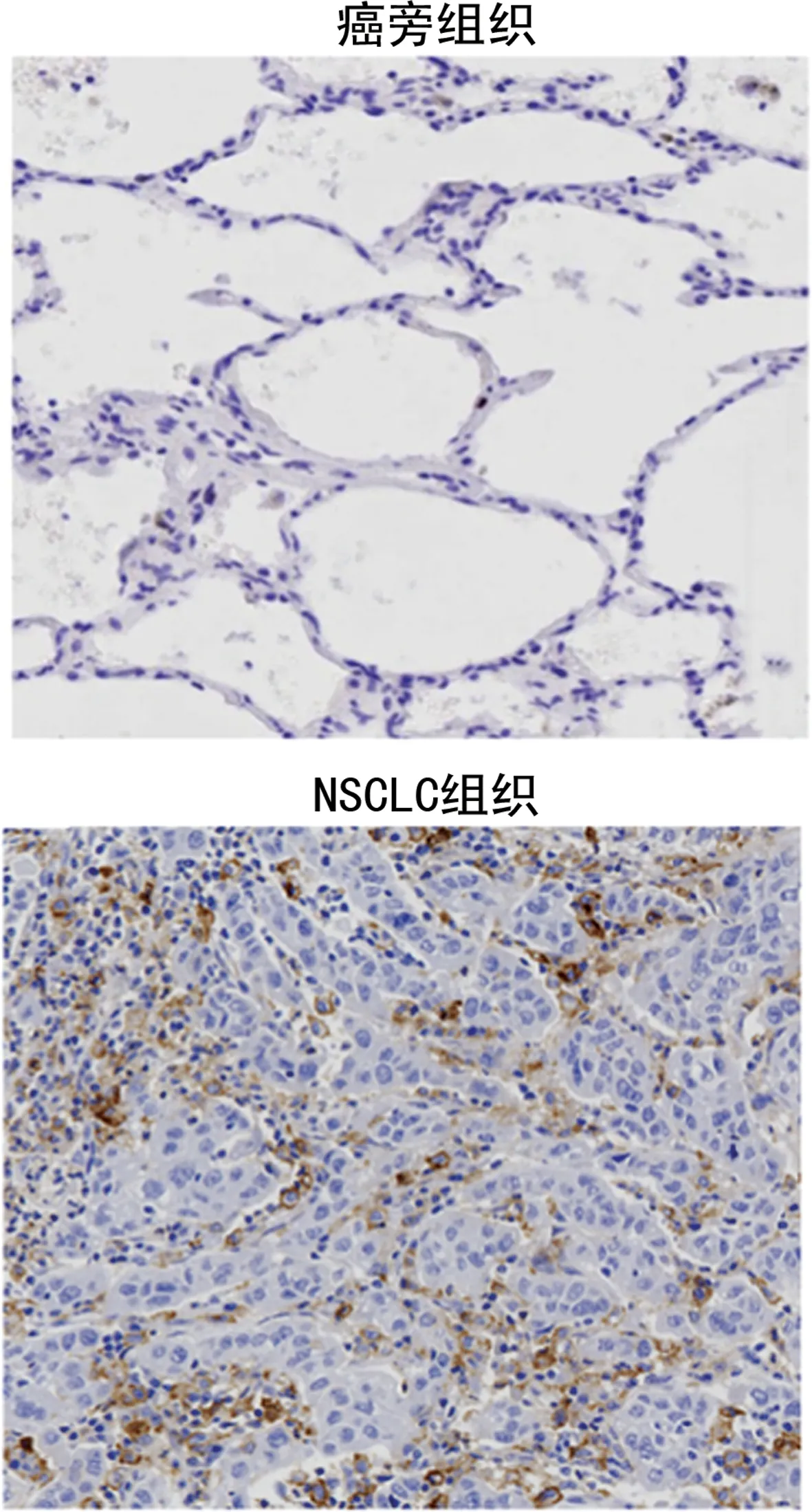
图1 免疫组化检测NSCLC组织及其癌旁组织中MFAP5的表达(×100)

表1 NSCLC组织及其癌旁组织中MFAP5表达的比较
2.2MFAP5与NSCLC临床病理特征的关系 NSCLC组织中MFAP5表达水平与患者淋巴结转移、TNM分期有关(P<0.05),而与患者年龄、性别、吸烟史和组织学类型无关(P>0.05)。见表2。

表2 NSCLC组织中MFAP5表达水平与NSCLC临床病理特征的关系(n)

续表2 NSCLC组织中MFAP5表达水平与NSCLC临床病理特征的关系(n)
2.3A549和BEAS-2B细胞中MFAP5的表达 与人正常肺上皮细胞BEAS-2B细胞相比,NSCLC上皮细胞A549细胞中MFAP5 mRNA和蛋白表达明显升高,差异有统计学意义(P<0.05)。见图2、表3。
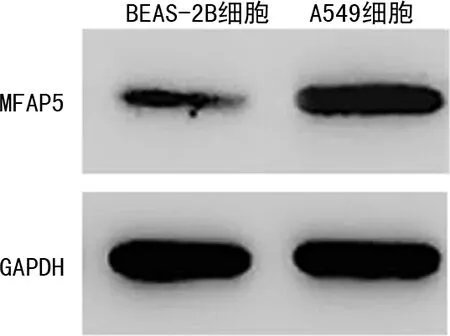
图2 Western blot检测细胞中MFAP5蛋白表达

表3 两组细胞中MFAP5 mRNA和蛋白表达的比较
2.4敲低MFAP5对NSCLC细胞增殖的影响 与空白对照组相比,sh-NC组细胞中MFAP5 mRNA和蛋白表达、细胞活力和克隆形成数,差异均无统计学意义(P>0.05);与sh-NC组相比,sh-MFAP5组细胞中MFAP5 mRNA和蛋白表达、细胞活力和增殖能力明显降低,差异均有统计学意义(P<0.05)。见图3、4,表4、5。

图3 Western blot检测细胞中MFAP5蛋白表达

图4 克隆形成试验检测细胞增殖能力

表4 各组细胞中MFAP5 mRNA和蛋白表达的比较

表5 各组细胞活力和增殖能力的比较
2.5敲低MFAP5对NSCLC细胞迁移和侵袭的影响 与A549空白对照组相比,sh-NC组细胞划痕愈合率和侵袭细胞数差异无统计学意义(P>0.05);与sh-NC组相比,敲低MFAP5后的sh-MFAP5组细胞划痕愈合率和侵袭细胞数明显降低,差异有统计学意义(P<0.05)。见图5、6和表6。
图5 细胞划痕试验检测细胞迁移能力(×100)
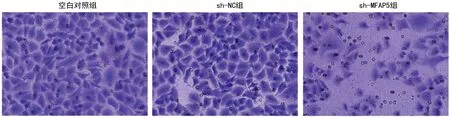
图6 Transwell实验检测细胞侵袭能力(×200)

表6 各组细胞迁移和侵袭能力的比较
2.6敲低MFAP5对NSCLC细胞EMT的影响 与空白对照组相比,sh-NC组细胞N-cadherin、E-cadherin和Vimentin表达差异无统计学意义(P>0.05);与sh-NC组相比,sh-MFAP5组细胞N-cadherin和Vimentin蛋白表达明显降低,E-cadherin蛋白表达明显升高,差异均有统计学意义(P<0.05)。见图7、表7。

表7 各组细胞中N-cadherin、E-cadherin和Vimentin蛋白表达的比较
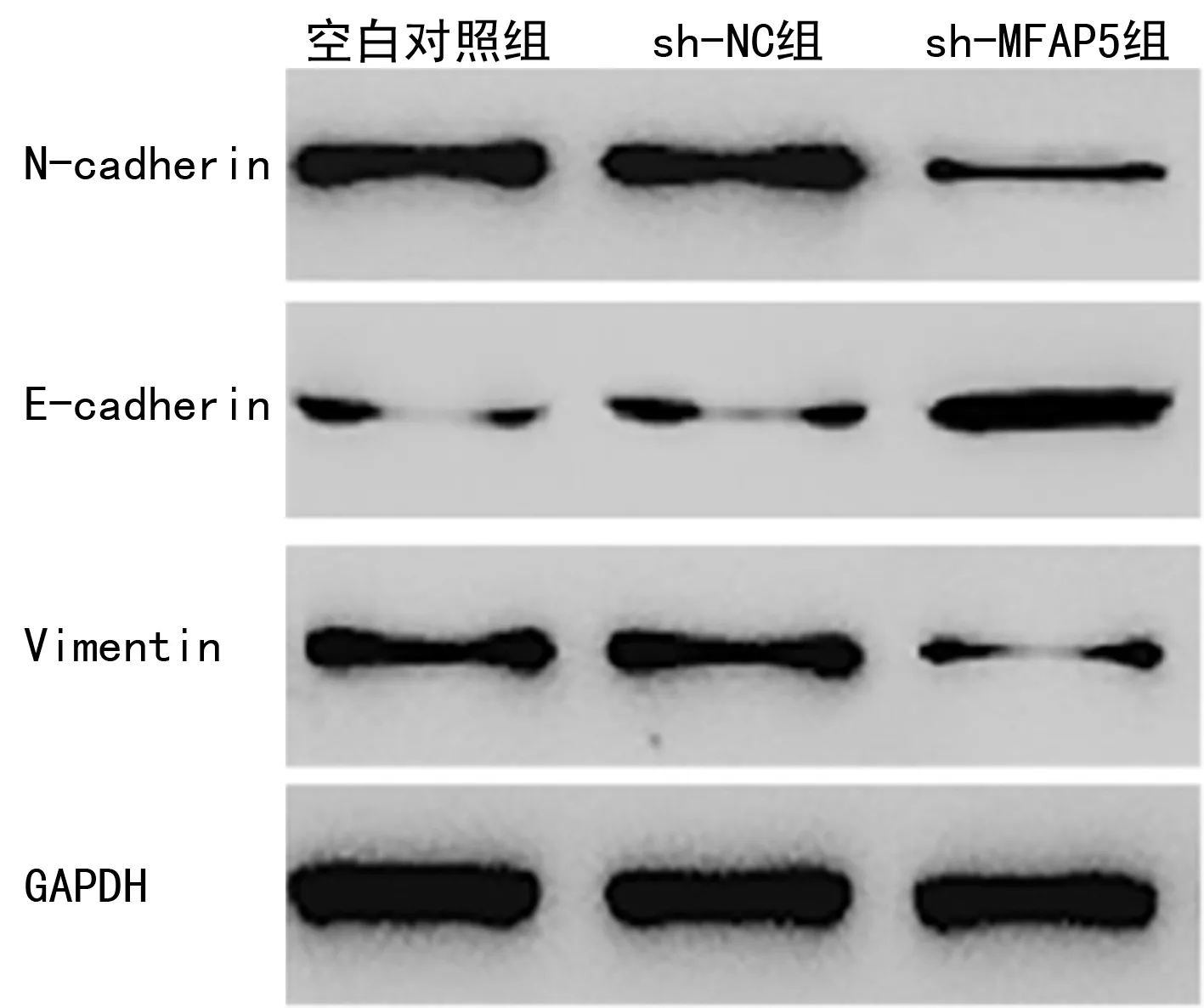
图7 Western blot检测细胞中N-cadherin、E-cadherin和Vimentin蛋白表达
3 讨 论
虽然近年来诊断技术和治疗方法有了实质性的进步,但是NSCLC患者的5年相对存活率仍约为15%[8]。此外,早期诊断NSCLC仍然是一个较大的挑战。大多数NSCLC患者被诊断为中晚期[9]。靶向治疗已成为NSCLC患者疾病管理的重要手段。新的分子靶点的发现,如microRNAs,表皮生长因子受体和erb-b2受体酪氨酸激酶3等,促使新的治疗方法的发展。靶向治疗可能最终改变肺癌的治疗模式,为治疗选择有限的患者带来希望[10]。因此,有必要进一步研究NSCLC的病因,确定与其相关的确切发病机制,这可能有助于开发独特的诊断生物标志物和治疗靶点。
MFAP5基因是在人类癌症中广泛表达的基因之一,参与多种癌症进展。在舌鳞状细胞癌中,MFAP5的过度表达与颈中央区淋巴结转移、无转移复发生存率和总生存率相关,提示MFAP5可能是预测口腔舌癌颈淋巴结转移和预后的潜在指标[11]。在乳腺癌中,MFAP5的高表达与肿瘤晚期、高级别肿瘤、淋巴结转移、较低的3年无复发生存率和较低的3年总生存率相关,MFAP5是一种新的乳腺癌预后生物标志物,是乳腺癌的潜在治疗靶点[12]。WEI等[13]发现MFAP5在结直肠癌样本和细胞中表达上调。MFAP5的上调与结直肠癌患者的Dukes分期、分化状态和局部淋巴转移等临床病理特征有关。目前,关于MFAP5与NSCLC疾病进展的关系尚不明确。本研究结果显示,与癌旁组织相比,NSCLC组织中MFAP5 免疫组化评分明显升高;与人正常肺上皮细胞BEAS-2B相比,上皮细胞A549的MFAP5表达量明显上升。通过进一步分析发现,MFAP5的高表达与患者淋巴结转移和TNM分期有关,而与患者年龄、性别、吸烟史和组织学类型无关。该结果表明,MFAP5与NSCLC疾病进展密切相关,可能是NSCLC的潜在治疗靶点。
EMT是一个动态的、高度调控的过程,发生在胚胎发生和肿瘤进展过程中,赋予上皮细胞运动性、干性和治疗抵抗力。EMT仍然是癌症治疗的一个有吸引力的靶点[14]。潜在的抗EMT策略可能包括逆转EMT、直接靶向表达EMT的细胞,或者诱导EMT细胞转分化为无害的细胞类型[15]。目前,已有研究表明,MFAP5在人类宫颈癌组织和细胞系中过度表达。抑制宫颈癌细胞中的MFAP5通过调节EMT相关信号通路,显著降低细胞的增殖、迁移和侵袭,从而发挥抗肿瘤作用[16]。N-cadherin、E-cadherin和Vimentin是重要的EMT标志物。MFAP5是膀胱癌发生发展的重要致癌基因,与患者生存率低有关。MFAP5的下调可抑制膀胱癌细胞增殖和侵袭[17]。同样的,CHEN等[18]的研究结果显示,MFAP5通过激活Notch1信号通路,从而促进乳腺癌细胞的迁移和侵袭。鉴于MFAP5可能为NSCLC的潜在治疗靶点,本研究敲低MFAP5在NSCLC上皮细胞A549中的表达,结果显示,与sh-NC组相比,sh-MFAP5组细胞N-cadherin和Vimentin蛋白表达明显降低,E-cadherin蛋白表达明显升高。CCK-8检测、克隆形成试验、细胞划痕试验及Transwell试验进一步验证,敲低 MFAP5可抑制NSCLC细胞增殖、迁移、侵袭和EMT。该研究结果表明,MFAP5是NSCLC进展中的重要致癌基因。
综上所述,本研究结果表明,NSCLC组织中MFAP5的高表达与疾病进展密切相关,敲低MFAP5可发挥明显的抗肿瘤作用。该研究结果为明确NSCLC发病机制及开发新的治疗靶点提供了新的科学资料。MFAP5在NSCLC中的具体作用机制值得进一步研究。
