培养组学联合MALDI-TOF MS技术对医院环境中昆虫标本的菌群分析*
2022-04-15崔生辉张清雯段发强辜依海
张 微,崔生辉,翁 蕊,王 辉,侯 轩,张清雯,赵 磊,牟 建,段发强,辜依海△
1.三二〇一医院微生物免疫科,陕西汉中 723000;2.中国食品药品检定研究院,北京 100050;3.陕西中医药大学医学技术学院,陕西咸阳 712046
昆虫作为地球上数量最多且分布最广的动物群体[1-2],除存在大量肠道菌群外[3-4],其身体外露部分也携带着多种病原体[5],可成为细菌和其他病原体的有效载体[2,6]。昆虫具有很强的流动性,它们可以接触到人类粪便、垃圾、开放性伤口或受污染的医疗器械,是连接医院内外感染区和未感染区的重要媒介[7]。尽管医院环境和其他医疗保健机构对昆虫实施了控制措施,但据报道,昆虫在医院病房中持续存在[8-10]。BOIOCCHI等[2]在英国7家医院共收集19 937只昆虫,以双翅目为主,从双翅目昆虫中共鉴定出82株细菌,对其中68株细菌进行了药敏试验,52.9%的细菌表现出对至少一类抗菌药物耐药[2]。HEIDEN等[11]研究了某三级医院的蝇类发现,有一半蝇类携带强毒性的多重耐药病原体。因此,对医院环境中昆虫携带的微生物进行分析和研究,会为疾病的防控提供新思路。
目前对昆虫肠道菌群进行研究的常用组学技术包括培养组学、宏基因组学、蛋白质组学以及代谢组学[12],培养组学基于培养条件的多样性,尽可能地模仿细菌所处的自然环境,以获取培养物[13]。不同于传统细菌培养的方法,培养组学可以联合基质辅助激光解吸电离飞行时间质谱仪(MALDI-TOF MS)技术进行细菌鉴定[14]。MALDI-TOF MS是通过细菌、真菌的特征性蛋白图谱对目标微生物进行鉴定,因其耗材低廉、处理流程简单、耗时短且准确性高的特点而被广泛使用,LUO等[15]研究表明MALDI-TOF-MS的鉴定准确率达到95%以上。在国际上有关于医院环境中昆虫标本菌群分析的报道,但是国内相关报道较少,本研究采用培养组学联合MALDI-TOF MS技术对医院环境中昆虫标本的菌群进行分析,旨在阐明其分布特征、耐药性及培养组学联合MALDI-TOF MS技术对昆虫标本菌群分析的实用性。
1 材料与方法
1.1仪器与试剂 主要仪器包括T214电子分析天平、GHP-9080培养箱、Hfsafe-1800TE生物安全柜、Microflex LT/SH型质谱仪(德国布鲁克公司)。主要的耗材和试剂包括TSA琼脂培养基(北京陆桥技术有限责任公司)、中国蓝平板(温州市康泰生物科技有限公司)、HCCA基质(德国Bruker公司)、生理盐水(国药集团容生制药有限公司),细菌基因组DNA提取试剂盒(离心柱型,天根生物科技有限公司),革兰阴性需氧菌药敏检测板(上海星佰生物技术有限公司)。
1.2方法
1.2.1标本采集 采样地点为某医院院内和医院周边环境,取样后装入无菌痰杯中,立即送往实验室检测。
1.2.2标本处理 (1)取昆虫标本一个,加入无菌管中,用千分之一天平称重,记录昆虫名称和重量。(2)加入标本10倍重量或不少于1 mL的生理盐水,磨碎样品;用生理盐水稀释至10-6稀释度;将原液至10-6稀释度的梯度稀释液分别用消毒后的L型玻璃棒涂布于胰蛋白胨大豆琼脂平板和中国蓝平板,每个梯度的稀释液涂布2块平板,37 ℃需氧培养24~48 h;(3)取原液0.5 mL,3 000×g离心10 min,弃去上清后,加入1 mL 75%乙醇,重悬,室温放置5 min,3 000×g离心10 min,弃去上清。加入生理盐水0.5 mL,重悬;用生理盐水将原液稀释至10-6稀释度;将原液至10-6稀释度的梯度稀释液分别用消毒后的L型玻璃棒涂布于TSA平板,每个梯度的稀释液涂布2块平板,37 ℃需氧培养24~48 h。随后对平板上所有生长的菌落进行MALDI-TOF MS鉴定。
1.2.3MALDI-TOF MS鉴定 先采用甲酸直接涂抹法对菌株进行鉴定,无法鉴定的菌株采用甲酸/乙腈萃取法重新进行MALDI-TOF MS鉴定。(1)甲酸直接涂抹法:挑取TSA琼脂培养基和中国蓝平板上的菌落涂布于MALDI-TOF MS 靶板上,加入甲酸(1 μL/孔),自然晾干后,在靶孔加1 μL/孔的α-氰基-4-羟基肉桂酸(HCCA)基质溶液,晾干后,将靶板放回机器对菌株种属进行鉴定,质荷比(m/z)为2 000~20 000。(2)甲酸/乙腈萃取法:取待测微生物标本转移至盛有300 μL超纯水的EP管中,用移液器反复吹打,涡旋至少1 min,在管中形成均匀的菌悬液;加入900 μL无水乙醇,涡旋至少1 min,13 000 r/min离心2 min,弃上清,重复离心一次,去乙醇溶液;加入50 μL70%甲酸溶液,反复吹打,涡旋混匀,加入50 μL乙腈,用移液器反复吹打混匀;13 000 r/min离心2 min,取上清1 μL至MALDI-TOF MS靶板上,晾干后,覆盖1 μL HCCA基质溶液,晾干后,通过质谱仪鉴定,m/z为2 000~20 000。
1.2.4全基因组测序 MALDI-TOF MS无法鉴定的菌株参照试剂盒说明书提取基因组DNA后送至北京诺禾致源公司测序,使用二代测序平台Illumina Hiseq 2000、PE150开展全基因组测序分析。
1.2.5药敏试验 采用微量肉汤稀释法对临床常见肠杆菌目分离株进行抗菌药物的药敏试验;根据革兰阴性需氧菌药敏检测板说明书进行操作,质控菌株为大肠埃希菌ATCC25922,根据2021年美国临床实验室标准化委员会(CLSI)的相应标准判读结果[16]。
2 结 果
2.1昆虫类别 共采集昆虫标本16只,包括瓢虫、天牛、蚂蚁、非洲蜂、黄胡蜂、金牛、蟋蟀、蜘蛛、长脚盲蛛、草蛉、蚊子、长脚蚊、枯叶蛾、飞蛾、粉蝶和棕静螳,以非叮咬类昆虫为主,见表1。
2.2从昆虫标本分离得到菌株的数量及分布 从16只昆虫标本共分离得到104株菌,其中6株(5.77%)无法通过MALDI-TOF MS鉴定,其余鉴定结果均在可信范围内。所有昆虫标本中,非洲蜂和粉蝶分离到的菌株较多,分别为14株和15株;分离株数为6~<10种的昆虫标本包括瓢虫、黄胡蜂、金牛、蟋蟀、草蛉、长脚蚊、飞蛾和枯叶蛾;含菌量较低(<6株)的是蚂蚁和蜘蛛,从长脚盲蛛标本中未分离到菌株。经过乙醇处理后,共分离菌株8株,均为芽孢杆菌。见表1。
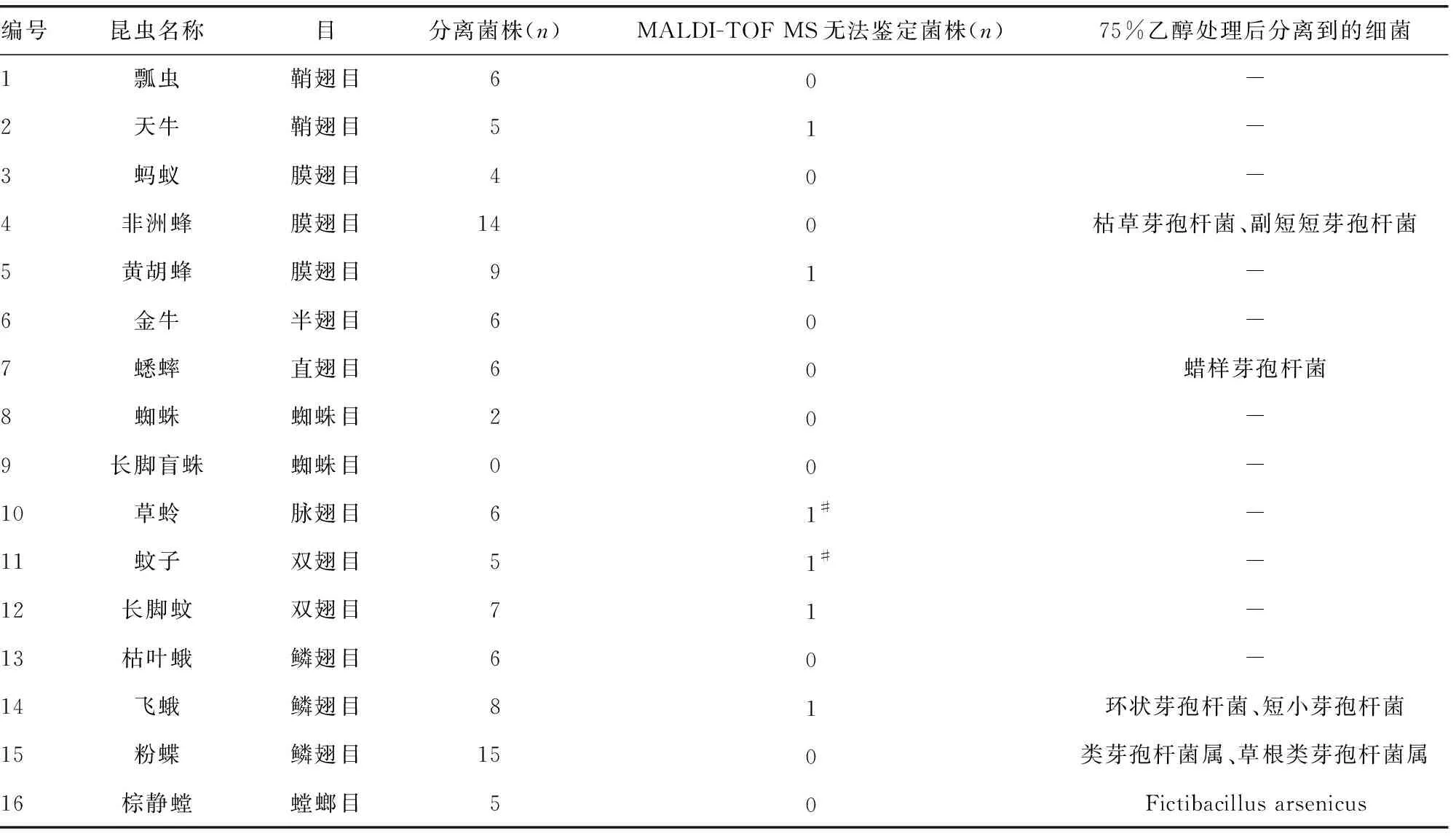
表1 昆虫类别及菌株分离情况
MALDI-TOF MS鉴定的98株菌中,57.14%(56/98)为革兰阳性菌,41.84%(41/98)为革兰阴性菌,1.02%(1/98)为真菌(葡萄牙棒孢酵母菌,检出于金牛标本)。革兰阳性菌中芽孢杆菌属为分离率最高的菌属,占53.57%(30/56),分离自粉蝶、棕静螳和蚂蚁标本;凝固酶阴性葡萄球菌占12.50%(7/56),多分离自膜翅目类昆虫;肠球菌属占8.93%(5/56),分离自天牛、金牛、蟋蟀、蚊子和粉蝶标本。革兰阴性菌中以肠杆菌目细菌为主,占70.73%(29/41),分离自非洲蜂标本的比例最高,部分肠杆菌目细菌分离株见图1;非发酵菌占21.95%(9/41)。
2.3MALDI-TOF MS菌株鉴定分值 98株菌中MALDI-TOF MS平均鉴定分值为2.075,最高鉴定分值为2.522,最低鉴定分值为1.714,鉴定分值高于2.000共63株,占64.29%,革兰阴性菌平均鉴定分值为2.151,革兰阳性菌平均鉴定分值为2.027,革兰阴性菌鉴定分值略高于革兰阳性菌。
2.4无法鉴定的菌株采用甲酸/乙腈萃取法重新鉴定的情况 从草岭和蚊子标本中各分离了1株无法鉴定的菌株,均在复苏过程中死亡,故无法进一步地鉴定。对其他4株无法鉴定的菌株采用甲酸/乙腈萃取法重新进行MALDI-TOF MS鉴定,鉴定分值均在1.6以下,无法鉴定至种属,见表2。

表2 昆虫标本中无法鉴定菌株两次鉴定的分值及测序鉴定的结果
2.5全基因组测序鉴定 无法鉴定的菌株通过全基因组测序鉴定为塔斯曼尼亚欧文菌、牛类芽孢杆菌、Paenibacillus aquistagni和藤黄微球菌。
2.6药敏试验 对肠杆菌目细菌进行抗菌药物的敏感性试验,昆虫来源的肠杆菌目细菌对抗菌药物敏感性较高,仅3株菌对头孢唑啉耐药,6株菌对四环素耐药,1株菌对复方磺胺甲噁唑耐药,其他菌株对检测的药物均敏感,见图1。

注:AMP为氨苄西林;AMS为氨苄西林/舒巴坦;CFZ为头孢唑啉;CTX为头孢噻肟;CFX为头孢西丁;CAZ为头孢他啶;IPM为亚胺培南;GEN为庆大霉素;TET为四环素;CIP为环丙沙星;SXT为复方磺胺甲噁唑;CHL为氯霉素;白色块表示敏感;灰色块表示耐药;*表示天然耐药。
3 讨 论
在微生物鉴定方面,传统鉴定方法,如依靠菌落形态和生化反应的鉴定方法,因其特异性低、鉴定细菌种类有限等缺点不能完全满足临床实际需要,虽然16S RNA基因测序分析技术、基因芯片分析技术、PCR技术能够成为手工鉴定方法的替代方法,但其操作复杂、耗时长且试验成本较高,而MALDI-TOF MS技术与常规生化方法和其他替代方法相比,具有方便、快速、准确等优点,在常规工作流程中,MALDI-TOF MS可以使微生物鉴定时间缩短1 d左右,同时由于改进了微生物菌落样品的制备方法,其鉴定的准确性和速度得到进一步提高[17]。MALDI-TOF MS质谱鉴定系统的可靠性通过0~3的鉴定分值来确定,分值<1.700被认为是不可靠的鉴定结果,分值为1.700~<2.000可以鉴定为属的水平,分值>2.000可以鉴定为种的水平[18]。本研究通过MALDI-TOF MS对从昆虫标本中分离的104株菌进行鉴定,98株菌的鉴定分值均在1.700以上,平均鉴定分值为2.075,属于可靠的鉴定结果,鉴定效率达94.23%,与MARKO等[18]的鉴定结果相当。
在应用MALDI-TOF MS进行细菌鉴定的过程中,常用的操作方法是直接挑取菌落涂布于靶板上,滴加甲酸后进行鉴定,这种方法操作简单、快速,可以高精度地进行细菌鉴定[17]。但是革兰阳性细菌由于细胞壁结构的原因,细胞中蛋白质暴露不彻底,也会采用甲酸/乙腈萃取法。LEE等[19]的研究表明,甲酸/乙腈法的鉴定结果优于单独甲酸法的鉴定结果。本研究中对直接甲酸法无法鉴定的4株菌,采用甲酸/乙腈萃取法重新进行鉴定,但是仍然无法给出可靠的鉴定结果,其可能原因为该质谱仪菌库中无此细菌或者是细胞中的蛋白质仍然无法彻底暴露,造成该4株菌无法鉴定。通过全基因组测序技术鉴定的塔斯曼尼亚欧文菌,该菌为革兰阴性,兼性厌氧,氧化酶阴性,过氧化氢酶阳性,GEIDER等[20]于2006年首次从果树中分离出来;牛类芽孢杆菌为革兰阳性,过氧化氢酶阳性,需氧或兼性厌氧,属于芽孢杆菌属,GAO等[21]2016年报道从牦牛乳分离得到;Paenibacillus aquistagni为革兰阳性,氧化酶阳性,过氧化氢酶阳性,兼性厌氧,SIMON等[22]2017年报道从工业废水中分离得到。
目前,国内外已经对医院昆虫及其传播病原体的潜力进行了研究,但是,大多数研究中的昆虫主要集中在一个类型,特别是对爬行昆虫的研究较多,例如蟑螂或蚂蚁[23-24]。本研究中,除采集了蚂蚁之外,在医院环境中同时采集了瓢虫、天牛、非洲蜂、黄胡蜂、金牛、蟋蟀、蜘蛛、长脚盲蛛、草蛉、长脚蚊、枯叶蛾、飞蛾、粉蝶、棕静螳等昆虫,涉及鞘翅目、膜翅目、半翅目、直翅目、蜘蛛目、脉翅目、双翅目、鳞翅目、螳螂目。所有分离株中革兰阳性菌56株(57.14%),革兰阴性菌共41株(41.84%),与KAPPEL等[7]的研究中分离到的优势菌一致,但不同的是,本研究中革兰阴性菌的分离率高于该研究。BOIOCCHI等[2]也报道肠杆菌目细菌为昆虫标本中的优势菌。本研究中的肠杆菌目细菌的耐药率较低,这与文献[2]的报道有所差异,可能是由于地理环境和采样环境的不同所造成的。本研究分离到的革兰阳性菌中,芽孢杆菌为优势菌,这与之前报道一致[2]。在所有昆虫中,膜翅目中的非洲蜂和鳞翅目中的粉蝶分离的细菌最多,分别为14株和15株。非洲蜂中的优势菌株为革兰阴性菌,共9株,主要为肠杆菌目细菌;粉蝶中有11株为芽孢杆菌,但是仍然有阴沟肠杆菌、克罗诺杆菌属、解鸟氨酸克雷伯杆菌及粪肠球菌等临床常见致病菌。在医院环境中须注重这两类昆虫的防护,避免其携带的菌株在医院传播。
本研究中所采集的16只昆虫,经过乙醇处理后,有5只昆虫有菌生长,分别是非洲蜂、蟋蟀、飞蛾、粉蝶和棕静螳,其生长的菌株均为芽孢杆菌属,无肠杆菌目细菌或葡萄球菌属细菌生长。本研究表明75%乙醇可以杀灭大部分昆虫标本中的细菌,特别是革兰阴性菌和除芽孢杆菌外的革兰阳性菌,在医院环境中可以作为常规消毒产品使用。
综上所述,培养组学联合MALDI-TOF MS鉴定系统能够高效地对医院环境中的昆虫标本所携带的菌株进行种属鉴定,虽然在所有菌株中革兰阳性菌为优势菌株,但是昆虫标本中分离到的临床常见革兰阴性菌也应该引起重视,其可能成为潜在的病原菌。所以在医院环境中,应该采取合适的防护措施,避免昆虫流动。同时本研究也为临床感染风险评估和预防控制策略提供了新思路。
