高效液相色谱测定甲酸盐中的甲酸
2020-08-18谭子璇严欣茹
万 宇,谭子璇,严欣茹,吴 兵
(四川吉隆达生物科技集团有限公司,四川 广汉 618300)
抗生素应用于畜牧养殖业的历史可追溯到20世纪40 年代,抗生素能有效防治动物疾病,提高动物生产性能,大幅提高养殖效益,使畜禽的大规模工厂化养殖成为可能。然而,随着人类对抗生素认识的不断加深,抗生素所产生的副作用也越来越受到关注。近年来,抗生素的滥用问题给人类带来了巨大的困扰:抗生素使用不当,会导致细菌产生耐药性,产生超级细菌;抗生素的滥用,会造成药物残留超标,导致动物免疫力下降,严重影响动物源性食品安全;抗生素作为饲料添加剂使用,给人类健康和生态系统带来了明显危害。欧盟早在2006 年就已全面禁止抗生素作为饲料添加剂使用,美国也于2017 年开始禁止在饲料中使用预防性抗生素。在饲料中禁止添加抗生素已是大势所趋,为维护我国动物源性食品安全和公共卫生安全,农业农村部发布第194 号公告,禁用促生长类药物饲料添加剂。饲料禁抗迫在眉睫,酸化剂是目前主流的替抗选择。酸化剂当中,甲酸因具有良好的抑菌效果受到人们的关注。甲酸又名蚁酸,分子式为HCOOH,相对分子质量46.03。甲酸是一种小分子有机酸,对大肠杆菌和沙门氏菌等微生物有一定的抑制作用,但是由于甲酸有较大的刺激气味且腐蚀性强,限制了甲酸在饲料中的应用,而具有稳定性质和较强缓冲能力的甲酸盐更适宜于饲料加工。甲酸盐的物理性质稳定,不易吸潮,流动性好,pH 接近中性,不会造成生产设备的腐蚀,利于饲料加工。在动物体内,甲酸盐是动物组织和血液的天然成分,合理添加不会对动物的健康造成危害。甲酸盐可以在酸性条件下游离出甲酸,能有效降低胃肠道的pH,且具有缓冲功效,有利于胃肠道pH 的稳定,抑制有害细菌的繁殖,促进有益微生物的生长,防止和减少仔猪腹泻、下痢等现象的发生,提高饲料的消化吸收率。甲酸钙在饲料中的应用较早,1998年,农业部发布了14 类饲料添加剂,甲酸钙位列其中。试验表明,在仔猪断奶后几周的饲料中添加甲酸钙可以提高仔猪生长速率,提高饲料转化率,并减少仔猪的发病率。同时,甲酸钙还有防霉保鲜的功效,在青贮饲料中添加甲酸钙,可提高乳酸的含量,抑制丁酸的产生,增加青贮饲料的营养成分和风味。二甲酸钾是一种有机酸盐,分子式为HCOOH·HCOOK,是由甲酸钾和甲酸分子通过氢键结合而成的二聚体,相对分子质量为130.14,在酸性条件下稳定,在碱性条件下分解为甲酸和甲酸钾。二甲酸钾是欧盟批准的第一种用于替代抗生素促生长的非抗生素饲料添加剂,我国于2005 年批准其作为饲料添加剂。字正浩研究表明,在仔猪基础日粮中,添加二甲酸钾可以提高饲料利用率,提高断奶仔猪的生长性能和健康水平;和复合抗生素相比,在减少肠道内容物肠杆菌数量的同时,不会抑制胃肠道内容物中乳酸杆菌数量[1]。林文爽研究表明,二甲酸钾具有良好的防霉效果,与甲酸防霉性能相当,且比甲酸更适合用于饲料添加剂[2]。可在替代抗生素促生长的同时,替代常用饲料防霉剂,降低饲料生产成本。铜、铁等金属离子催化自由基反应的能力很强并能催化电子传递反应,对饲料和预混料中的维生素有破坏作用,造成维生素的损失。甲酸盐为络合物,金属离子与甲酸通过配位健结合,不易电离,比硫酸盐等无机盐产生更少的金属离子。赵金伟研究了甲酸盐(铁、锌、铜)及硫酸锰组合效应对维生素稳定性的影响,结果表明,甲酸亚铁、甲酸锌及甲酸铜的组合与硫酸亚铁、硫酸锌及硫酸铜的组合相比,可减少预混料中维生素A和烟酰胺的损失[3]。
目前,测定甲酸的方法常用的有氧化还原滴定法、离子色谱法、高效液相色谱法和气相色谱法[4-10]。其中,氧化还原滴定法是通过高锰酸钾与甲酸定量反应,过量的高锰酸钾在酸性条件下,将碘化钾氧化成单质碘,析出的碘用硫代硫酸钠标准滴定溶液滴定,间接法测定甲酸含量,很多有还原性的杂质会对检测结果造成干扰。氧化还原滴定法常用于钻井液中甲酸钾和甲酸钠的测定,在甲酸钙、二甲酸钾等金属价态稳定的甲酸盐中可以推广使用,但不适用于变价金属盐(铜、铁、锰等)中甲酸含量的测定;气相色谱需要将甲酸转化成衍生物,操作较繁琐,硅胶管的解析效率不稳定,检测结果相对偏差较大。离子色谱和高效液相色谱法检测甲酸含量是普遍使用的方法,离子色谱通过纯水提取甲酸根离子,并经固相萃取柱净化,以氢氧化钾溶液淋洗,阴离子交换柱分离,电导检测器检测;和离子色谱相比,高效液相色谱仪的普及率更高,本文采用高效液相色谱法检测甲酸盐(铜、锰、锌、亚铁)中甲酸的含量。甲酸是一种酸性较强的有机酸,pKa 为3.745,在水中有很大的电离,大部分以离子形式存在,在色谱柱上保留较少,故常采用抑制电离的方法将甲酸转化为分子形式在色谱柱上保留。
目前,甲酸的高效液相色谱测定多使用磷酸及其盐作流动相,郑婷等使用流动相为0.1 mol·L-1磷酸二氢钠缓冲溶液:乙腈=98:2,磷酸调节pH=2[11];黄志英等采用的流动相为乙腈+0.02%磷酸溶液(5+95,v/v)[12];雷萍等用0.404 g 庚烷磺酸钠用纯水溶解后,加入0.2 mL磷酸,定容至1 L配制成缓冲液,缓冲液:乙腈=90:10[13]。磷酸及其盐在有机酸的检测中应用比较广泛,但和很多金属离子易产生不溶物,会对设备和检测结果造成影响,样品不能直接进样,需进行前处理,操作比较繁琐,且容易产生损耗、影响检测精度。本文采用稀硫酸溶液作为流动相,操作简捷,同时避免了由于化学沉淀所引起的测定误差。
1 试验材料
1.1 仪器与试剂
高效液相色谱仪(WUFENG LC-UV100 plus);分析天平(感量为0.0001 g);超声波清洗器;微孔滤膜(孔径0.45 μm);甲酸(标准品);乙腈(色谱纯);甲醇(色谱纯);硫酸(分析纯);水(超纯水);甲酸铜(自制);甲酸锌(自制);甲酸锰(自制);甲酸亚铁(自制)。
1.2 色谱及检测条件
色谱柱:C18柱,长250 mm,内径4.6 mm,粒度5 μm(极性色谱柱);柱温:30 ℃;流动相:0.0275%硫酸溶液;流速:1 mL·min-1;检测波长:206 nm;进样量:20 μL。
2 方法与结果
2.1 pH的选择
考虑到一般色谱柱的耐酸能力,使用流动相的pH 范围2≤pH≤9,根据甲酸的电离常数,流动相的pH选择2.5,即硫酸溶液的浓度为0.0275%。由于未添加缓冲物质,试样直接用水定容容易造成pH不稳定,导致出现负峰,见图1。经试验,试样溶液用流动相溶解并定容能够消除pH 不稳定造成的影响,不需添加缓冲物质,增加操作步骤。

图1 甲酸亚铁样品色谱(未用流动相定容)
2.2 溶剂和波长的选择
甲醇的截止波长为205 nm,乙腈的截止波长为190 nm,甲酸在206 nm 处有最大吸收。为避免干扰,波长选用210 nm 进行试验。流动相中分别添加5%的甲醇和乙腈进样,结果表明添加甲醇和乙腈均会对检测结果造成干扰。减小甲醇和乙腈的比例,仍有不同程度的干扰。甲酸的极性较强,保留时间靠前,不需要加入有机相进行调整,波长调整至206 nm,甲酸有更好的吸收。不同的金属离子在甲酸出峰前均有不同程度的峰响应,加入甲醇和乙腈均使甲酸出峰时间前移,不利于峰分离,故本文流动相中未添加。
2.3 标准工作液的制备
称取甲酸标准品适量,配制成20 mg·mL-1的甲酸标准溶液。准确吸取1、2、3、4、5 mL 标准溶液于100 mL容量瓶中,用流动相定容至刻度,混匀。得到浓度分别为200、400、600、800、1 000 μg·mL-1的标准工作液。

图2 甲酸标准样品色谱
2.4 试样溶液的制备
称取试样约0.1 g(精确至0.000 1 g),用流动相溶解并定容于100 mL 容量瓶中,摇匀。取部分溶液过0.45 μm滤膜,滤液作为试样溶液。
2.5 线性关系分析
分别取标准工作液(2.3)和试样溶液(2.4),按(1.2)列出的条件进行液相色谱分析测定。甲酸标准品色谱图见图2。测定中应调整试样溶液的浓度,使甲酸浓度落在标准曲线的相应范围内。
标准工作液浓度由低至高进行进样,以标准品色谱峰峰面积为纵坐标(Y),标准品浓度(μg·mL-1)为横坐标(X),作线性回归方程:
R2=0.9999,Y=1.3444X-11.323
2.6 精密度试验
取同1 份样品,相同体积20 μL,重复进样6次平行测定(n=6),结果见表1。

表1 精密度试验结果
2.7 重复性试验
取同一样品(甲酸锌Zn-2020050503),按试样溶液制备方法平行制备6份测定。甲酸含量平均值为47.48%,RSD为0.6%。甲酸锌样品色谱见图3。
2.8 加样回收率试验
准确吸取已知浓度的样品加入一定量的标准工作溶液,按照试样溶液方法制备试样溶液,测定结果平均回收率为98.8%,RSD为0.8%。

图3 甲酸锌样品色谱
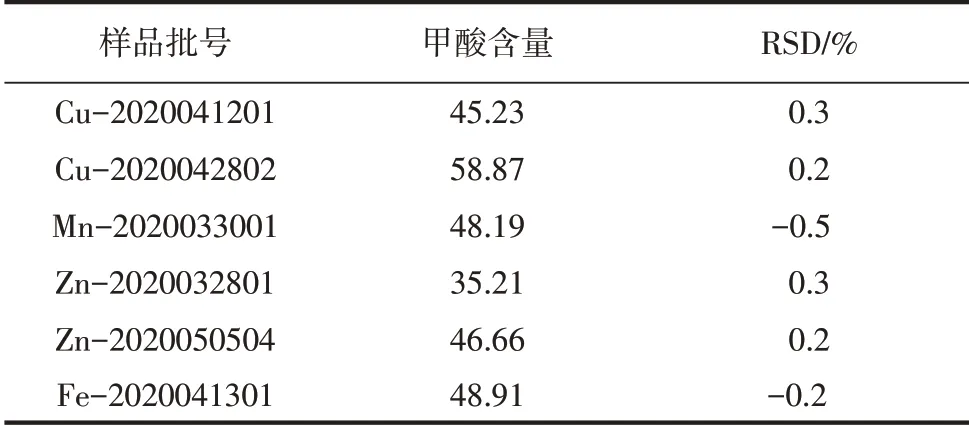
表2 不同甲酸盐样品的测定
2.9 样品测定
分别取不同批次的甲酸盐样品,按照试样溶液方法制备,分别进样测定,结果见表2(n=3)。甲酸铜、甲酸锰、甲酸亚铁样品色谱分别见图4~图6。
结果表明,按照本文方法对不同的甲酸盐样品进行测定,相对标准偏差为-0.5%~0.3%,峰型良好,干扰小,准确度高。

图4 甲酸铜样品色谱

图5 甲酸锰样品色谱

图6 甲酸亚铁样品色谱
3 讨论与分析
本文为简化操作步骤,流动相未添加缓冲物质,样品处理时直接用流动相溶解并定容。从结果看,峰型稳定,分离度好,无干扰。但本文仅选取了部分具有代表性的甲酸盐进行试验,不能代表所有甲酸盐的性质,且不同仪器设备的性能可能存在差异。若仍出现pH 不稳定的情况,可考虑加入适量硫酸铵进行调节,通过铵盐的缓冲增强稳定性,但高浓度的硫酸-硫酸铵体系可能会对色谱柱和泵产生一定的影响。
样品用流动相溶解有利于保持试样溶液的稳定性。甲酸盐基本呈中性,亚铁离子、二价锰离子有较强的还原性,亚铁离子在pH>5时,极易氧化成三价铁,三价铁溶解度极低,易沉淀析出;二价锰离子在中性或碱性条件下也易氧化成四价锰,形成二氧化锰析出。沉淀的产生会对检测结果产生干扰,流动相定容使样品溶液呈酸性,避免氧化。对比图1和图2可以看出,试验溶液pH的降低同时增大了金属离子的电离,金属离子的峰响应明显降低,降低了对甲酸检测的干扰。
该方法可以推广到大部分甲酸盐的检测,部分与硫酸根易产生沉淀的金属离子(如钡离子、银离子等)不适用于该方法。
4 结 论
目前,甲酸钙和二甲酸钾已在饲料中大量使用,甲酸铜、锌、铁等在饲料中可作为硫酸盐的替代品,有潜在应用价值,但我国均无相应的国家或行业质量标准,其生产都是参照企业标准执行。各企业采用的生产工艺不同,部分企业副产甲酸盐,产品中可能会带入部分杂质,导致产品的质量状况差异较大,不利于甲酸行业的发展。与其他有机酸相比,甲酸价格便宜,抑菌效果好,是饲料替抗的主流选择之一,在饲料中有良好的应用前景。利用高效液相色谱法检测甲酸盐中的甲酸,方法简捷,检测结果可信度高,能够实现甲酸的定性定量检测,为甲酸盐的质量评估提供参考。
