程序性死亡蛋白-1抑制剂治疗晚期肺癌出现垂体免疫不良反应3例
2022-04-11顾阳春曹宝山
顾阳春,刘 颖,谢 超,曹宝山△
(北京大学第三医院 1. 肿瘤化疗与放射病科,2. 放射科,3. 内分泌科,北京 100191)
免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)已被广泛用于治疗肺癌,代表性药物为程序性死亡蛋白-1(programmed cell death protein 1,PD-1)及其配体-1(PD-1 ligand 1,PD-L1)的单克隆抗体,其引发的免疫相关不良反应(immune related adverse events,irAEs)在临床中备受关注。垂体irAEs包括垂体炎和垂体功能减退,通常认为其常见于细胞毒T淋巴细胞相关抗原-4(cytotoxic T lymphocyte antigen 4,CTLA-4)抑制剂治疗后,而较少见于PD-1/PD-L1抑制剂治疗后[1-5]。但近年来,PD-1/PD-L1抑制剂治疗后出现垂体irAEs的病例报道也不断出现,且具有独特的临床特征[6-11]。其中,当垂体功能减退仅表现为中枢性(继发性)肾上腺皮质功能减退,即仅有促肾上腺皮质激素(adrenocorticotropic hormone,ACTH)缺乏时,称为孤立性ACTH缺乏(isolated ACTH deficiency,IAD),IAD是一类特殊的垂体irAEs[12]。本文将介绍3例肺癌患者接受不同PD-1抑制剂治疗后出现IAD的诊治过程,并进行文献回顾,以提高临床医生对垂体irAEs的认识。
1 病例资料
病例1是68岁男性,于2018年10月确诊右肺腺癌ⅣB期[cT3N3M1c,美国癌症联合委员会(American Joint Committee on Cancer,AJCC)第8版分期,下同],PD-L1的肿瘤细胞(tumor cell,TC)阳性比例分数为 70%,免疫细胞(immune cell,IC)阳性比例分数为5%,肺癌常见驱动基因均为阴性(表1)。2018年11月9日,患者开始一线治疗:帕博利珠单抗(pembrolizumab)单药治疗(200 mg/次,每3周一次),最佳疗效为部分缓解(partial remission,PR)。1周期后,患者出现免疫性肝炎,根据不良事件通用术语标准5版(Common Terminology Criteria for Adverse Events,CTCAE)分级(下同)[13],转氨酶升高达2级,经甲基泼尼松龙40 mg/d[0.5 mg/(kg·d)]静脉治疗1周后,转氨酶升高降至1级。甲基泼尼松龙逐渐减量至8 mg/d时,患者恢复帕博利珠单抗治疗,但转氨酶仍有波动,半年后恢复正常。2019年5月14日,患者彻底停用甲基泼尼松龙,9月肺癌进展,表现为肺内病灶较前略增大,右腋窝新发淋巴结转移,淋巴结切除活检病理支持肺腺癌来源;同时发现胃壁增厚,胃镜病理确诊胃原发腺癌。患者拒绝化疗,于2019年9月30日开始二线治疗:帕博利珠单抗联合阿帕替尼(apatinib)250 mg/d。肺癌再获PR,同时胃壁变薄,胃癌疗效为疾病稳定(stable disease,SD)。2020年4月患者出现恶心2级、头晕1级、全身无力3级,血压和心率正常,经全面评估排除肿瘤进展。颅脑增强磁共振显像(magnetic resonance imaging,MRI)未见新发脑血管病及脑转移表现。血液生化检查提示低钠血症3级(血钠121 mmol/L,参考正常范围137~147 mmol/L,下同), 血钾正常。8:00 a.m.血皮质醇 < 1 μg/dL(参考正常范围 5~25 μg/dL,下同),ACTH 2.2 ng/L(参考正常范围 7.2~63.3 ng/L,下同), 均显著降低,诊断为中枢性(继发性)肾上腺皮质功能减退。全面评估患者垂体功能:甲状腺功能中三碘甲状腺素(triiodothyroxine,T3)、四碘甲状腺素(tetraiodothyroxine,T4)和促甲状腺素(thyroid stimulating hormone,TSH),性激素中卵泡生成素(follicle-stimulating hormone,FSH)、黄体生成素(luteinizing hormone,LH)、睾酮(testosterone,T)及泌乳素(prolactin,PRL)均正常。进一步评估患者垂体形态:鞍区动态增强MRI见垂体内结节性病变约7 mm×7 mm×10 mm,边界清楚,呈等T1长T2信号,增强扫描强化不明显,垂体柄不粗,垂体后叶可见(图1 A~C)。对比患者确诊肺癌前以及免疫治疗期间定期复查的脑MRI,垂体均显饱满且无动态变化。内分泌科会诊诊断垂体功能减退3级,为IAD。因患者无肾上腺危象,仅进行替代治疗(泼尼松5 mg/d), 同时给予补钠对症处理。患者的低钠血症逐步纠正,5 d后症状全部消失。帕博利珠单抗治疗延迟1周后恢复用药。此后,患者未再出现恶心、呕吐和无力等症状,定期监测血钠维持正常,每2~3个月复查8:00 a.m.血皮质醇持续<1 μg/dL,ACTH波动于1.5~1.8 ng/L,鞍区动态增强MRI示垂体病变无变化。2021年11月30日末次随访时,患者继续帕博利珠单抗联合阿帕替尼治疗,泼尼松替代治疗维持5 mg/d。
病例2是66岁男性,于2020年12月确诊右肺腺癌ⅣB期(cT4N3M1c),PD-L1表达水平未测,肺癌常见驱动基因均为阴性(表1)。患者参加一种新型PD-1抑制剂HX008(200 mg/次,每3周1次)联合培美曲塞(pemetrexed)+卡铂(carboplatin)作为一线治疗的临床研究(临床研究登记号CTR20202387),于2021年1月6日开始用药,最佳疗效获PR,期间患者无明显恶心和呕吐,仅出现白细胞减少1级。2021年6月(用药7周期后)出现恶心2级和呕吐1级,伴双膝无力1级和活动后呼吸困难1级,持续2周;血液生化检查示血钠135 mmol/L,8:00 a.m.血皮质醇(4.3 μg/dL)和血ACTH(1.5 ng/L)均降低,甲状腺功能正常,性激素和PRL水平未测;诊断为垂体功能减退2级,中枢性(继发性)肾上腺皮质功能减退。肺计算机断层扫描(computed tomography,CT)诊断为免疫性肺炎2级;颅脑增强MRI示垂体未见明显异常信号(图1D~F)。因并存免疫性肺炎2级,暂停HX008治疗,并于2021年6月18日开始高剂量泼尼松75 mg/d [1 mg/(kg·d)]口服治疗。1 d后症状全部消失,6 d后泼尼松开始减量,当减至10 mg/d时(2021年7月29日)恢复HX008治疗。2021年8月19日复查,8:00 a.m.血皮质醇7.6 μg/dL,ACTH 28.4 ng/L,均恢复正常;复查颅脑增强MRI示垂体较前无变化。因此,将泼尼松减量至替代治疗剂量5 mg/d。2021年12月17日末次随访时,患者继续HX008联合培美曲塞维持治疗,8:00 a.m.血皮质醇(10.6 μg/dL)和ACTH(27.6 ng/L)仍正常,故将泼尼松替代治疗进一步降至2.5 mg/d。
病例3是63岁男性,2020年4月确诊右肺鳞状细胞癌ⅢC期(cT4N3M0),PD-L1表达水平未测(表1)。2020年5月15日开始一线治疗:信迪利单抗(sintilimab,200 mg/次,每3周1次)联合吉西他滨(gemcitabine)+奈达铂(nedaplatin),最佳疗效获PR;期间皮疹1级,白细胞减少2级。2021年1月(共5周期用药后)肺癌进展,进行多西他赛(docetaxel)单药二线治疗和安罗替尼(anlotinib)单药三线治疗。2021年6月7日肺癌再次进展,拟再次使用含PD-1抑制剂的方案。治疗前进行评估, 8:00 a.m.血皮质醇降低(1.5 μg/dL),血ACTH正常(8.0 ng/L),甲状腺功能和血钠正常。疑诊中枢性(继发性)肾上腺皮质功能减退,因无症状未进一步诊治,叮嘱患者在感染等应激状态下需警惕肾上腺危象的发生。2021年6月10日患者开始四线治疗:替雷利珠单抗(tislelizumab,200 mg/次,每3周1次)联合白蛋白结合型紫杉醇(albumin-bound taxol)+卡铂,2周期后疗效为SD。2021年7月24日,患者出现粒细胞减少3级,伴发热、贫血3级和乏力3级,就诊外院急诊,测血压和心律正常,胸部X线片提示肺部感染,血液生化检查提示低钠血症4级(116 mmol/L),血钾正常。经抗感染和补钠治疗,仍间断低热,乏力持续2级,血钠升至133 mmol/L。2021年7月30日收入我科病房, 8:00 a.m. 血皮质醇降低(3.1 μg/dL),血ACTH正常(7.2 ng/L),血钠再次下降(128 mmol/L),甲状腺功能、性激素水平和PRL正常;鞍区动态增强MRI示垂体高度4 mm,增强扫描强化欠均匀,垂体柄不粗(图1G~I)。诊断为垂体功能减退3级,为IAD。因无肾上腺危象,患者于2021年8月4日开始泼尼松替代治疗5 mg/d,同时升红细胞药物治疗,随后体温和血钠逐步恢复正常,乏力和贫血减轻至1级。2021年9月9日,患者恢复替雷利珠单抗联合白蛋白结合型紫杉醇治疗,之后每2~3个月复查, 8:00 a.m.血皮质醇波动于2.7~5.1 μg/dL,血ACTH波动于1.5~10.8 ng/L,鞍区动态增强MRI示垂体无变化。2021年12月2日末次随访时患者开始替雷利珠单抗单药维持治疗,继续泼尼松替代治疗5 mg/d。
2 讨论
垂体irAEs通常指以垂体炎症和细胞浸润为特征的垂体炎,也包括垂体功能减退[13],因难以获得垂体组织进行病理诊断,垂体irAEs只能依据内分泌检测、MRI检查和症状进行临床诊断。诊断垂体irAEs的临床标准为:一种或多种垂体前叶激素缺乏,可伴有颅脑神经系统症状和垂体肿大[1]。垂体irAEs最常出现缺乏的激素是ACTH和TSH,也可出现PRL增多和血管加压素(arginine vasopressin,AVP)缺乏等罕见情况[1, 6-7, 14]。当垂体功能减退仅表现为ACTH缺乏时,称为IAD[12];垂体炎则更强调多个垂体前叶激素缺乏或垂体肿大[14]。发生垂体炎和IAD的患者在年龄、性别、肿瘤类型和抗肿瘤治疗史方面并无差异,但在相关ICIs药物类型、发生率、发生时间和垂体影像改变方面存在差异[6]。
垂体irAEs的类型和发生率与ICIs药物种类有关。在使用CTLA-4抑制剂的患者中,垂体irAEs发生率较高(8%~17%),以垂体炎居多, ACTH缺乏常伴有TSH缺乏和/或FSH/LH缺乏,头痛、视力障碍和垂体肿大的比例相对较高,也可表现为IAD[1-7, 15]。然而,在使用PD-1抑制剂的患者垂体irAEs发生率很低(0.4%~1.5%),常表现为IAD[1-7, 14, 16]。以晚期肺癌为例,PD-1抑制剂联合化疗的临床研究中,垂体炎发生率仅0.7%~1.1%,垂体功能减退的数据不详[17-18]。日本的一项前瞻性研究表明,肺癌患者接受PD-1抑制剂治疗后,垂体irAEs发生率为3.7%(4/108),均为IAD[6]。2018年10月至2021年10月期间本中心收治的晚期肺癌患者中,一线采用PD-1/PD-L1抑制剂联合化疗或靶向药物者55例,垂体irAEs发生率为5.45%(3/55),同样均为IAD。
垂体irAEs的发生时间在不同ICIs药物间也存在差异。与CTLA-4抑制剂相关的垂体irAEs(垂体炎为主)发生较早,中位时间为治疗开始后的9.3~10.5周;而与PD-1/PD-L1抑制剂相关的垂体irAEs(IAD为主)发生较晚,中位时间为治疗开始后的25.8~27.1周[6-7, 15]。本文病例2的垂体irAEs发生于PD-1抑制剂治疗开始后的5个月,而病例1和3的垂体irAEs发生更晚,分别为17个月和12个月后(表1)。我们推测,病例1因先出现免疫性肝炎而使用高剂量糖皮质激素,并以小剂量维持了4个月,可能延迟了其他irAEs的发生;病例3因使用PD-1抑制剂的总次数较少且停用约6个月,引起的炎症反应也可能较轻。文献中也报道过停用PD-1抑制剂纳武利尤单抗(nivolumab)4~6个月出现垂体irAEs的病例[8-9]。因此,在ICIs治疗期间和结束后至少半年内,都要警惕垂体irAEs。
垂体irAEs的患者MRI可见垂体肿大和垂体柄增粗,其发生率在ICIs药物间差异较大[7, 15, 19-20]。CTLA-4抑制剂相关垂体irAEs的垂体肿大发生率较高(81%~98%),而PD-1/PD-L1抑制剂相关的垂体肿大发生率较低(18%~28%)[7, 15]。垂体肿大和垂体柄增粗可恢复,且该过程可能发生在确诊垂体irAEs前[1]。蝶鞍病变、垂体萎缩和纤维化也可见于垂体irAEs患者,但其与免疫损害的关系不确定[19-20]。发生IAD的患者几乎不出现垂体肿大,部分患者的垂体还有缩小甚至萎缩[6, 10-11, 13-14]。本文3例肺癌患者根据肺癌诊疗规范定期复查颅脑MRI,在确诊IAD前后垂体形态均未出现变化。
垂体irAEs的临床表现不特异,易被更常见的肿瘤相关症状或其他治疗相关不良反应所掩盖,尤其在没有头痛和视力障碍等神经系统表现时。为及时发现垂体功能减退,定期监测8:00 a.m.血皮质醇和ACTH以及甲状腺功能十分必要;当发现中枢性(继发性)肾上腺皮质功能或甲状腺功能减退时,需进一步全面排查可能并存的其他垂体功能紊乱,还需关注血钠水平。确诊垂体irAEs时,39%~62%的患者存在低钠血症[7, 15]。ICIs治疗后,重度低钠血症的发生率为5.5%,其中6.6%由继发性肾上腺皮质功能减退引起[21]。皮质醇水平降低可通过多种途径直接或间接引起抗利尿激素(antidiure-tic hormone,ADH)水平升高,上调肾小管对ADH的敏感性,从而引起低钠血症[7]。本文3例患者均出现不同程度的疲劳、无力、上消化道症状和低钠血症,其中2例为重度低钠血症。
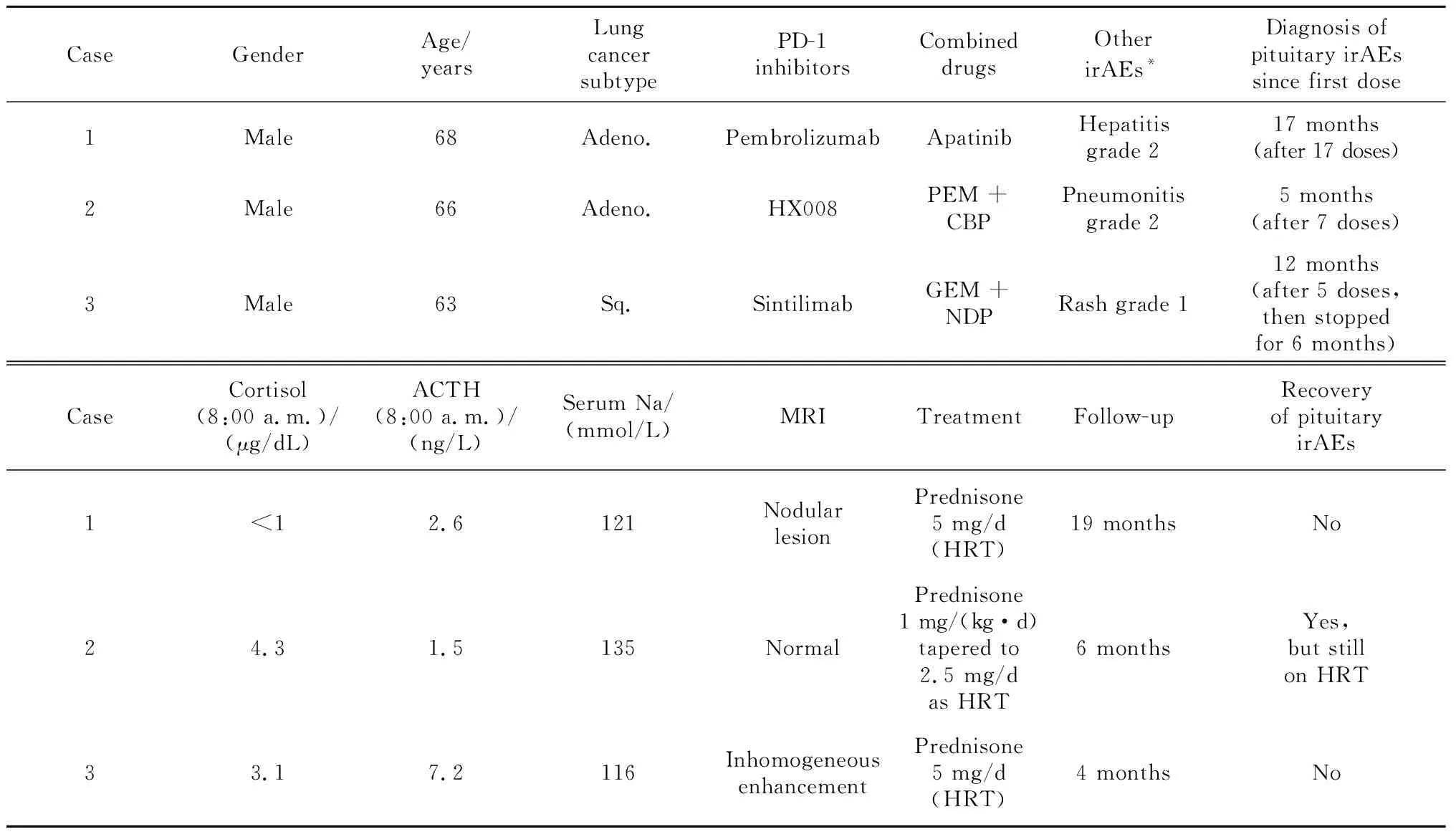
表1 3例PD-1抑制剂治疗诱发垂体免疫不良反应患者的临床特征Table 1 Clinical features of 3 cases diagnosed with pituitary immune-related adverse events induced by PD-1 blockade therapy
垂体irAEs的临床症状易缓解,通常仅需激素替代治疗,当垂体肿大引起头痛或视力障碍等神经系统急性症状严重时,才使用高剂量糖皮质激素[22-25],但内分泌功能减退却不易恢复,高剂量糖皮质激素对此也毫无帮助,尤其是继发性肾上腺皮质功能减退几乎无法恢复[13-15, 26-27]。但也有罕见个案报道了一例26岁的转移性肾透明细胞癌患者,在纳武利尤单抗和伊匹木单抗(ipilimumab)联合治疗期间,出现继发性肾上腺皮质功能和性腺功能减退而诊断为垂体炎,有重度乏力和畏寒症状,无头痛、视力障碍和垂体肿大,依旧进行高剂量泼尼松[1 mg/(kg·d)]治疗[28]。该患者2 d后症状完全消失,6周内将泼尼松逐渐降至替代治疗剂量5 mg/d,5个月后血皮质醇水平恢复正常,停用泼尼松2个月后仍维持正常[28]。年轻、及时给予高剂量泼尼松治疗、ACTH降低程度较轻,可能是该患者肾上腺皮质功能得以恢复的原因[28]。本文病例2也观察到血皮质醇和ACTH的恢复,可能与垂体irAEs发现及时,症状较轻,以及因免疫性肺炎采用了高剂量泼尼松治疗有关。这两个病例提示,如果在垂体免疫性炎症的初期及时发现并适当干预,垂体内分泌功能恢复的概率有提高的可能。
垂体irAEs的发生机制仍不明确,尤其是PD-1抑制剂诱发的irAEs。已有研究认为,垂体异位表达抗原、淋巴细胞和巨噬细胞浸润、Ⅱ型和Ⅳ型超敏反应、抗垂体抗体(antipituitary antibodies,APAs)和人类白细胞抗原(human leukocyte antigen,HLA)基因型等都可能与CTLA-4抑制剂诱发垂体炎相关[29-32]。血清APAs对IAD的诊断价值可能较高,基线血清APAs的存在也可能具有预测作用[32],但受限于APAs检测方法的特殊性,本文3例患者均未进行。
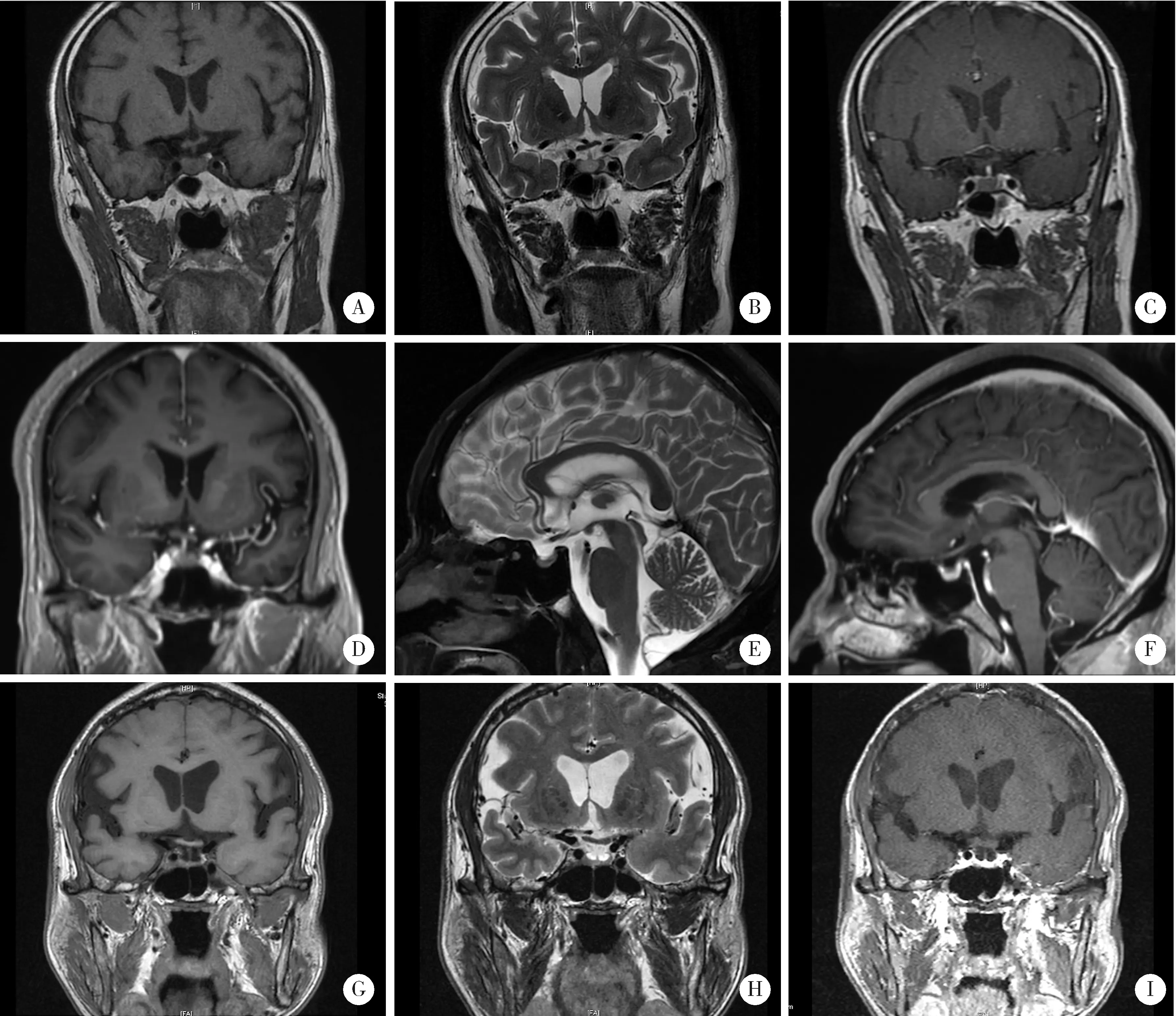
Case 1: A, T1-weighted coronal image; B, T2-weighted coronal image; C, T1-weighted coronal image post-gadolinium. Case 2: D, T1-weighted coronal image post-gadolinium; E, T2-weighted sagittal image; F, T1-weighted sagittal image post-gadolinium. Case 3: G, T1-weighted coronal image; H, T2-weighted coronal image; I, T1-weighted coronal image post-gadolinium.图1 各例患者确诊垂体功能减退时的脑磁共振成像Figure 1 Magnetic resonance image of each patient when diagnosed with hypopituitarism
总之,本文3例肺癌患者均为PD-1抑制剂抗肿瘤治疗疗效较好,伴有其他系统irAEs,说明机体免疫反应被充分激发。其垂体irAEs诊治过程提示,PD-1抑制剂相关垂体irAEs的发病时间跨度大,常表现为IAD,临床症状不特异且严重程度不同,虽经激素替代治疗症状缓解迅速,但内分泌功能恢复情况有所不同。因此,在使用PD-1抑制剂治疗的患者中,也要警惕垂体irAEs的发生,尤其在疗效好、用药久、伴有其他irAEs时。
