垂体影像学特征在无功能性垂体腺瘤术后内分泌功能评估中的作用
2022-08-03康盈盈朱丽娟王文节孙剑瑞
康盈盈 朱丽娟 王文节 孙剑瑞
随着CT、MRI 技术的发展,无功能性垂体腺瘤(nonfunctional pituitary adenoma,NFPA)的诊断率逐渐提高。NFPA 病人的垂体柄受压可引起多巴胺能抑制,继发高泌乳素血症。对于垂体功能减退但无明显神经功能缺损的NFPA,临床通常采用保守治疗,或者手术切除,以改善垂体功能。近年来,临床倾向采用经鼻蝶入路神经内镜手术。然而,这些手术对恢复原有激素功能的作用仍存在争议。本文探讨垂体影像特征在NFPA 经鼻蝶入路神经内镜切除术后神经内分泌功能评估中作用,为临床提供参考。
1 资料和方法
1.1 一般资料 回顾性分析2010 年3 月~2021 年5 月经鼻蝶入路神经内镜手术切除的96例NFPA的临床资料,其中男53 例,女43 例;平均年龄(55.7±14.1)岁。纳入标准:18 岁以上,术后病理确诊为NFPA。排除术后病理证实为功能性垂体腺瘤、曾接受过垂体病变手术或放疗的。
1.2 临床表现 无症状9 例,存在视野缺损59 例,头疼43 例,颅神经损伤10 例,意识障碍1 例,低钠血症1 例。11 例女性闭经/泌乳,7 例女性发生希恩氏综合症。
1.3 手术方法 采用双鼻孔入路神经内镜手术。为了保护垂体,采取选择性保留腺体的肿瘤切除术。首先,对肿瘤进行分块切除,以缓解受压的正常腺体。若假包膜容易剥离,则选择假包膜外整体切除。肿瘤切除后,不建议使用过氧化氢灌洗,可用明胶海绵混合fbrin 胶或Floseal 轻微按压,以控制垂体出血。采用带蒂皮瓣或中鼻甲游离粘膜、自体脂肪以及硬脑膜密封胶进行鞍底重建。
1.4 随访及评估指标 术后随访12~144 个月,平均(69.0±43.4)个月。
1.4.1 术前指标 包括人口学资料、术前症状、术前激素状况。分析术前血浆促甲状腺激素(thyroid-stim⁃ulating hormone,TSH)、甲状腺素(thyroxine,T4)、促卵泡生成素(follicle-stimulating hormone,FSH)/促黄体生成素(luteinizing hormone,LH)、雌二醇(女性)、睾酮(男性)、催乳素水平。生长激素(growth hor⁃mone,GH)缺乏症诊断标准为存在低水平的胰岛素样生长因子1(insulin like growth factor 1,IGF-1;按性别和年龄标准化),并伴有其他三个垂体激素轴缺陷。基线皮质醇<5 μg/dl可诊断为肾上腺皮质功能减退。基线皮质醇水平在5~15 μg/dl,进行Synac⁃then 试验,皮质醇<18 μg/dl 可诊断为肾上腺皮质功能减退。基线皮质醇水平>15 μg/dl可排除肾上腺皮质功能减退。
使用1.5T 或3.0T MRI 扫描仪进行术前MRI 检查,包括2 mm 层厚的轴位、冠状位和矢状位扫描。使用半自动Smartbrush 医学软件测量肿瘤体积,如果术后MRI 没有肿瘤的证据,评估为全切除。根据Knosp分型及垂体柄、垂体腺状态测量海绵窦侵犯程度。
1.4.2 术后指标 游离T4和TSH正常化;FSH/雌二醇正常化;FSH/LH/睾酮正常化;基线皮质醇水平>15 μg/dl 或Synacthen 试验或胰岛素耐受性试验后皮质醇水平>18 μg/dl;GH/IGF-1 正常化时,考虑为术前缺陷的改善。术后2、12个月复查激素功能,上述至少一项指标未达到正常水平,且较术前下降≥50%,需小剂量或长期生理剂量激素替代治疗,则视为术后激素恶化。
1.5 统计学分析 使用SPSS22.0软件分析;计量资料以±s
描述,进行t
检验;计数资料使用Fisher精确概率法或χ
检验;采用多因素logistic 回归模型分析术后垂体功能恶化的影响因素;P
<0.05 为差异有统计学意义。2 结果
2.1 手术前后垂体功能检测结果 术前54例(56.3%)出现垂体功能减退(1个激素轴异常2例,2个激素轴异常18 例,3 个激素轴异常25 例,4 个激素轴异常9例),其中性腺功能减退43 例,甲状腺功能减退34例,肾上腺皮质功能减退17例,生长激素缺乏24例,高泌乳素血症31 例。术后2、12 个月分别有67 例(69.8%)和55 例(57.3%)存在垂体功能减退。与术前相比,术后2、12个月,性腺功能减退、甲状腺功能减退、生长激素缺乏无明显变化(P
>0.05),高泌乳素血症明显减少(P
<0.05),但是肾上腺皮质功能减退、尿崩症术后2 个月明显增加(P
<0.05)、术后12 个月又明显减少(P
<0.05)。16 例(16.7%)术后至少一个激素轴改善,19 例(19.8%)术后12 个月出现少一个激素轴功能恶化。见表1。表1 本文无功能垂体腺瘤经鼻蝶入路神经内镜手术前后垂体功能变化(例)
注:与术前相应值比,*<0.05;与术后2个月相应值比,#<0.05
内分泌功能缺陷性腺功能减退甲状腺功能减退肾上腺皮质功能减退生长激素缺乏高泌乳素血症尿崩症术前43(44.8%)34(35.4%)17(17.7%)24(25%)31(32.3%)0(0%)术后2个月38(39.6%)38(39.6%)45(46.9%)*22(22.9%)2(2.1%)*11(11.5%)*术12个月36(37.5%)35(36.5%)28(29.2%)#23(24%)2(2.1%)*3(3.1%)#
2.2 手术前后垂体的影像检测结果 术前MRI 检查发现垂体柄50 例(52.1%;图1),发现垂体腺52 例(54.2%;图2)。术后MRI 复查发现垂体柄85 例(88.5%),发现垂体腺86例(89.6%)。

图1 无功能垂体腺瘤手术前后垂体柄MRI表现
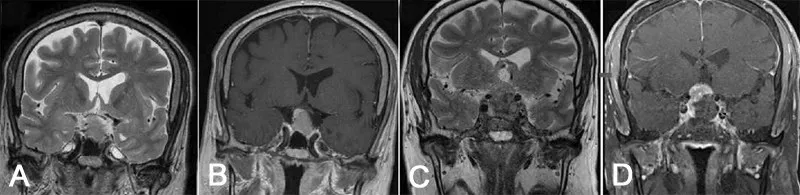
图2 无功能垂体腺瘤手术前后垂体腺MRI表现
术前垂体腺可见病人垂体功能减退发生率(61.5%,32/52)与垂体腺不可见病人(50.0%,22/44)无明显差异(P
>0.05);然而,术前垂体腺可见病人术后12 个月新发至少一个激素轴恶化率(9.6%,5/52)明显低于垂体腺不可见病人(29.5%,13/44;P
<0.05)。术前垂体柄可见病人垂体功能减退发生率(58.0%,29/50)与垂体柄不可见病人(54.3%,25/44)无明显差异(P
>0.05),术前垂体柄可见病人术后12个月新发至少一个激素轴恶化率(16.0%,8/50)与垂体腺不可见病人(23.9%,11/46)也无明显差异(P
>0.05)。2.3 术后激素恶化的影响因素96 例术前肿瘤体积平均(8.54±6.15)cm,术后平均(0.52±1.13)ml,肿瘤切除率平均(94.7±9.4)%,肿瘤全切除率为56.2%(50/96)。术后激素恶化病人的肿瘤全切除率[26.3%(5/19)]明显低于术后激素未恶化的病人[58.4%(45/77);P
<0.05]。术后激素恶化病人的肿瘤体积[(11.90±2.14)cm]明显大于术后激素未恶化的病人[(7.52±0.93)cm;P
<0.05]。多因素logistic 回归分析显示术前垂体腺不可见是术后激素恶化的独立影响因素(P
<0.05,表2)。表2 本文无功能垂体腺瘤经鼻蝶入路神经内镜手术后激素恶化影响因素的logistic回归分析
危险因素年龄≥70岁肿瘤体积≥10 cm3肿瘤未全切除术前垂体腺不可见术前垂体柄不可见单因素分析 多因素分析比值比1.61 5.94 4.30 3.98 2.57 95%置信区间0.49~5.19 1.87~18.83 1.34~13.87 1.25~12.69 0.98~8.31 P值0.428 0.002 0.015 0.020 0.073比值比1.85 2.78 1.72 3.01 2.05 95%置信区间0.782~3.246 0.92~12.73 0.73~6.84 1.10~14.49 0.79~8.22 P值0.356 0.108 0.134 0.041 0.203
3 讨论
3.1 NFPA 术前激素评估的意义NFPA 在组织学上多是良性的,但仍有部分病人预后不良。NFPA垂体功能减退的发生率在37%~85%,因此,建议在手术治疗前对所有疑似NFPA 的病例进行所有垂体激素轴的评估。NFPP 垂体功能减退是肿瘤对健康腺组织的压迫和破坏,以及垂体柄的压迫导致下丘脑刺激释放激素的中断。NFPA 病人垂体激素轴损害发生率由高到低依次是GH轴(61%~100%)、促性腺轴(36%~96%)、促肾上腺皮质轴(17%~62%)和促甲状腺轴(8%~81%)。对于术前仅表现为垂体功能减退的NFPA 病人,考虑到术后垂体功能改善和恶化率的差异性,改善率在13~57%,恶化率在2~33%,术前全面评估和围手术期科学管理十分重要。
3.2 术后激素功能恶化的影响因素分析 文献报道,肿瘤大小、肿瘤切除程度、催乳素水平和肿瘤侵袭性与NFPA 术后垂体功能恶化有关。据报道,高达85%的NFPA 存在一个或多个垂体前叶轴功能障碍。蝶鞍病变可通过功能性肿瘤激素分泌过多或通过机械压迫垂体腺和垂体柄影响内分泌功能,导致垂体激素的产生/分泌减少,进而导致单个激素轴的缺陷,或者更罕见的全垂体功能减退。肿瘤对垂体柄/垂体腺的压迫可导致术前MRI 不可见。本文结果显示,术前垂体柄是否可见与术前垂体功能减退无关,然而术前垂体腺不可见与术前垂体功能减退有关;多因素logistic回归分析显示,术前垂体腺不可见是术后12 个月新发至少一个激素轴恶化独立危险因素。这与Jahangiri 等报道一致。垂体功能减退是NFPA 术后常见并发症,术前垂体腺MRI 不可见会增加术后垂体功能恶化风险。一方面说明垂体腺受压迫程度更轻者,术后垂体功能恶化的风险更低;另一方面,垂体腺良好的暴露,更有利于手术操作,避免损伤肿瘤周围组织,更好地保存垂体组织和内分泌功能。本文结果显示,垂体柄是否可见与术前垂体功能减退以及术后12 个月新发至少一个激素轴恶化均无明显关系。垂体柄是连接下丘脑和垂体后叶的主要通道,在正常情况下,是易于识别的[13]。然而,在病理状态下,垂体柄多会发生形状扭曲、移位或渗入肿瘤内。术中如果可以看到下丘脑-垂体束,则很容易识别垂体柄的位置,因此术前垂体柄的可识别性可能并不是影响激素功能恶化的主要因素。但是,垂体柄在术后内分泌功能中的重要作用也不可忽视,术中对该结构进行保护仍然是十分重要的。本文结果还显示较大的肿瘤体积似乎也与术后至少一个激素轴的恶化有关,虽然这可能并不是影响术后激素功能恶化的独立危险因素。因为,这种联系可能与手术操作,以及血流再灌注效应和因占位效应引起的高压突然减压相关。另一个需要考虑的因素是肿瘤硬度。
总之,垂体功能减退是NFPA 常见的临床表现,术前垂体功能评估具有重要意义。术后垂体激素轴可能恶化,垂体影像学特征,例如垂体腺可见程度、肿瘤大小等,可作为评估术后垂体功能恶化的指标。
