基于溶菌酶相转变对聚乙烯包装材料的抗菌生物改性
2022-04-01董世建李述刚
王 战,付 星,董世建,李述刚,4,*
(1.湖北工业大学生物工程与食品学院,湖北 武汉 430068;2.华中农业大学食品科学技术学院,湖北 武汉 430070;3.安徽荣达食品有限公司,安徽 广德 242000;4.合肥工业大学食品与生物工程学院,安徽 合肥 230009)
近年来,食品工业和消费者对食品加工、包装和储藏过程中食品的保鲜防腐越来越关注。食品包装旨在通过保护食品不受环境影响,避免发生生化变化从而延长食品货架期[1-4]。如何在延长食品贮存寿命、保证营养风味的同时最大化减少对环境的影响至关重要[5]。在众多应用于食品包装的聚合物中,聚乙烯(polyethylene,PE)由于其良好的性能和低廉的价格应用广泛[6]。为了得到具有抗菌性的PE薄膜,可将PE薄膜与不同的活性物质,如天然抗氧化剂和抗菌剂等,复合制备食品抑菌保鲜膜。Cooksey提出有一种抗菌膜是将抗菌剂直接涂覆或吸附在包装材料上[7]。如在PE膜表面涂覆壳聚糖[8]、明胶[9]等,使包装膜具一定的有抗氧化性和抗菌性。Romani等采用鱼的废弃物提取蛋白,利用蛋白水解产物多肽改性PE膜,一方面充分利用了鱼资源;另一方面改善了PE膜作为食品包装材料的抗氧化性等性质[10]。
溶菌酶是一种胞壁质酶,可通过水解细胞壁中的糖苷键,导致细菌溶解死亡[11]。溶菌酶的来源广泛,细菌、真菌、植物以及各种哺乳动物的组织中均可提取出溶菌酶[12-14]。在食品工业中,溶菌酶因对人体无毒性、无副作用而应用广泛[15-16]。近年来,许多研究选择将溶菌酶与多糖等其他活性物质进行复配,使溶菌酶更稳定,抗菌更高效,如酰化壳聚糖复合物[17]、植酸[18]、壳聚糖和纳米纤维素[19]等,在活性物质与溶菌酶的协同增效作用下,溶菌酶的抗菌谱与应用范围得到拓宽。刘琨毅等将溶菌酶与乳铁蛋白复合制得的涂膜,能够抑制耗牛肉中微生物的生长[20]。陈占祎等利用溶菌酶的凝胶特性,将其与原花青素和聚乙二醇复合得到水凝胶,与没有添加原花青素的水凝胶相比,其强度、韧性和抗菌性能得到极大提升[21]。溶菌酶与还原剂作用可得到一种淀粉样蛋白,该蛋白可通过自组装在载体表面形成一层薄膜,且该薄膜具有良好的机械性、抗菌性[22]等。溶菌酶经三(2-羧乙基)膦(tris(2-carrboxyethyl)phosphine,TCEP)打断二硫键后发生解折叠,三级结构及部分二级结构破坏,暴露疏水基团;疏水相互作用使解折叠溶菌酶分子聚集,从水溶态转变为疏水态,这一转变过程即为溶菌酶的相转变[23]。Yang Peng等将溶菌酶与TCEP的混合液定义为相转变溶液[23]。但该方法的研究应用主要集中在金属材料方面,如对金属钛表面的改性,以改善其在骨移植[24]和药物缓释[25]领域的应用;对贵金属如金离子进行回收,实现循环经济[26]等。现阶段对溶菌酶相转变产物改性食品包装材料的研究鲜见报道。
本实验拟用PE膜为对象,研究溶菌酶在TCEP的作用下变性聚集所形成的涂层对PE膜的改性效果,重点对溶菌酶和TCEP的不同反应时间下产物的涂层微观形貌、化学结构、元素组成、表面水相接触角等进行表征,并研究溶菌酶相转变类淀粉聚集体所形成的薄膜在不同条件下的稳定性以及对金黄色葡萄球菌的抑制作用。以期提高PE膜的抗菌性能,促进溶菌酶相转变体系改性PE膜在食品包装材料中的应用。
1 材料与方法
1.1 材料与试剂
PE膜 佛山双富包装有限公司;溶菌酶、TCEP、4-羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES) 美国Bio-sharp公司;金黄色葡萄球菌(CMCC(B)26003) 上海鲁微科技有限公司;无水乙醇、甲醇等试剂均为国产分析纯;实验用水除特殊说明外均为去离子水。
1.2 仪器与设备
Nano ZS+MPT-2纳米粒度及电位分析仪 英国Malvern公司;Nicolet IS-50傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)仪 赛默飞世尔科技(中国)有限公司;PHI 5000 VersaProbe III X射线光电子能谱(X-ray photoelectron spectroscopy,XPS)仪高德英特(北京)科技有限公司;Empyrean锐影X射线衍射(X-ray diffraction,XRD)分析仪 荷兰帕纳科仪器公司;SU-8010扫描电子显微镜(scanning electron microscope,SEM) 日本日立公司;OCA 15EC接触角测量仪 德国Dataphysics公司。
1.3 方法
1.3.1 溶菌酶的相转变
称取一定量的HEPES溶于超纯水配制10 mmol/L HEPES缓冲液,通过0.45 μm有机滤膜进行过滤。然后以该缓冲液为溶剂分别配制2 mg/mL的溶菌酶溶液和50 mmol/L的TCEP溶液,并使用5 mol/L NaOH溶液调节TCEP溶液至pH 7,4 ℃下保存备用。溶菌酶相转变溶液为现配现用,将配制好的溶菌酶溶液和50 mmol/L TCEP溶液在室温下等体积混合,振荡15 s后即可得到溶菌酶相转变溶液[24]。
1.3.2 PE膜的改性
将PE膜剪成1.0 cm×1.5 cm长方形片段,先后用无水甲醇、无水乙醇和超纯水,分别在超声条件下浸泡清洗10 min。随后平铺在洁净器皿表面,晾干待用。然后取现配的溶菌酶相转变溶液500 μL于处理后的PE膜上[27],室温下分别静置20、60、120、180 min后,用HEPES缓冲液漂洗薄膜表面,采用氮气吹干后置于干燥皿中备用,剩余溶菌酶相转变溶液丢弃。以未经改性的PE膜为空白对照。
1.3.3 溶菌酶相转变溶液粒径测定
采用纳米粒度及电位分析仪测定溶菌酶相转变溶液的粒径分布。取与PE膜反应不同时间的溶菌酶相转变溶液进行测定。取1.5 mL样品装于比色池,平衡时间为1 min,散射角均为173°,测量温度25 ℃,样品折射率为1.43,分散剂折射率为1.33[27]。
1.3.4 PE膜的结构表征及性质测定
1.3.4.1 红外光谱表征
取不同改性时间下的PE薄膜,测定其FTIR,解析PE涂层中的二级结构,重复3 次。将干燥后的不同改性时间下的PE膜剪裁成0.5 cm×1.0 cm长方形后,在4 000~400 cm-1范围内对样品进行128 次扫描,分辨率为4 cm-1[27]。
1.3.4.2 光电子能谱表征
利用XPS仪直接测定不同改性时间下的PE膜,对其进行定性分析。选择单色器A1,能量为1 486.69 eV,功率为25 W,以能量为160 eV的恒定能量分析模式测试,设置C 1s结合能为284.8 eV,对样品进行C、O、S、P、Cl 5 种元素的定性分析,判断涂层的元素构成及官能团[28]。
1.3.4.3 X射线衍射表征
通过XRD分析仪对改性PE膜进行测试,X射线波长为0.154 nm,电压45 kV,电流200 mA,衍射角度10°~60°,扫描速率为3(°)/min[29]。
1.3.4.4 SEM观察
利用导电胶将不同改性时间的PE膜固定在样品台上,喷金30 s后,置于SEM下抽真空,加速电压为30 kV,工作距离保持在1~5 mm,室温下观察同一样品不同区域的微观形貌,在不同放大倍数下对同一区域涂层微观形貌进行观察,调焦后拍照对比不同改性时间下PE膜的涂层形貌区别[29]。
1.3.4.5 水相接触角测定
PE膜表面不同改性时间所形成的涂层水相接触角由接触角测量仪进行测定,添加800 μL的超纯水于注射器中,打开光源和摄像头,轻微旋转接触角测量仪上控制注射器的按钮,缓慢滴加10 μL超纯水至样品表面,静置15 s待样品表面水滴不再移动后,停止录像。选择水滴稳定时图像标注接触角大小,保存数据。样品均重复测定3 次,结果取平均值[26]。
1.3.4.6 稳定性评价
探究不同温度、超声条件、溶剂环境和离子强度下改性PE膜的稳定性。将处理120 min的改性PE膜样品分别置于5、25、50、75 ℃下,2 h后取样并按1.3.4.5节方法测定表面水相接触角;样品置于80、120、160 W和200 W的超声功率下超声10 min,随后取样并按1.3.4.5节方法测定水相接触角;样品置于pH 1.0(盐酸溶液)、pH 12.0(氢氧化钠溶液)的极性环境以及石油醚、三氯甲烷等有机溶剂中,浸泡2 h后,用超纯水清洗样品,待自然风干后,按1.3.4.5节方法测定样品的水相接触角;样品分别置于浓度为50、100、150、200 mmol/L的氯化钠溶液中,静置2 h,待样品自然风干后按1.3.4.5节方法对其进行水相接触角测定[24]。
1.3.4.7 抗菌性评价
将金黄色葡萄球菌菌株在琼脂培养基中于37 ℃下培养16 h,然后取过夜的菌悬液接种于新鲜培养基至OD600nm=0.5,此时细菌浓度为5×108CFU/mL[28]。将PE膜紫外灭菌处理30 min。取浓度为5×108CFU/mL的金黄色葡萄球菌100 μL接种到改性不同时间的PE膜上,于37 ℃生化培养箱中培养48 h后,用灭菌后的超纯水清洗膜表面。取清洗液中存活的金黄色葡萄球菌稀释后接种至平板上,置于37 ℃生化培养箱中培养36 h后,通过菌落计数法比较不同处理条件下金黄色葡萄球菌的生长情况[30-31],以未经任何处理的接种组为空白组,测定未改性PE膜和改性PE膜处理组的菌落数。重复3 次,取平均值计算杀菌率。杀菌率按下公式计算。
1.4 数据统计与分析
所有实验均平行处理3 次,利用Origin 2017软件进行数据分析并作图。
2 结果与分析
2.1 溶菌酶相转变过程中的溶液粒径变化
溶菌酶相转变过程中混合溶液粒径变化见图1A。溶菌酶与TCEP反应5 min所得混合溶液的平均粒径约为531.2 nm,当反应时间延长至10 min时,溶液平均粒径增至955.4 nm,此时的溶菌酶相转变聚集体在重力作用下沉降于PE膜表面,形成薄膜。溶液粒径随着反应的进行而不断增大,60 min时达到2 305 nm。如图1B所示,反应至60 min时,溶液的聚合物分散系数(polymer dispersity index,PDI)约为0.7,不同粒径的颗粒聚集在混合液中,此时溶液体系分布逐渐混乱[32]。该现象与Wang Dehui等的发现一致,颗粒粒径的增大是因为溶菌酶在TCEP的作用下解折叠暴露疏水基团,在疏水作用的驱动下聚集发生沉降,继而溶液中交联的聚集体颗粒粒径逐渐变大[24]。
2.2 溶菌酶相转变改性对PE膜结构的影响
2.2.1 FTIR分析
FTIR用以检测涂层表面的功能性官能团种类以及官能团之间可能存在的相互作用类型[33]。如图2所示,与空白对照的PE膜样品相比,改性PE膜的FTIR存在明显变化。改性20 min的样品在1 650 cm-1附近有新的吸收峰,同时在2 360 cm-1处吸收峰加强,这种变化是由官能团C=O、O—H、N—H伸缩振动所致,表明溶菌酶在TCEP的作用下,20 min内即可形成一定的相转变涂层,且该涂层中共含有羧基、羟基、氨基等亲水性功能基团;与空白对照相比,改性PE膜在1 000 cm-1附近的吸收峰消失,这是由于溶菌酶相转变聚集体黏附在PE膜表面,覆盖了空白膜自身对该波段光谱的反射,同时也说明PE膜表面成功附着溶菌酶相转变涂层。随着改性时间延长至60 min,PE膜在2 360 cm-1附近波段的振动更加明显,但改性时间为120 min和180 min组的特征峰强度变化逐渐趋于稳定,说明溶菌酶与TCEP反应20 min即可在PE膜表面形成薄膜,该薄膜在60 min后逐渐趋于稳定。

图2 不同改性时间下PE膜的FTIR图Fig. 2 FTIR spectra of native and modified PE films at different reaction times
2.2.2 元素组成变化
XPS是一种通过测定光电子相对能量强度对元素含量进行定量分析的表征手段。以284.8 eV处的C 1s为内部参考[34],得到宽谱图(图3A),对其中的N、C、O元素峰图放大后得到图3B~D。图3A宽谱图表明,未改性的PE膜表面仅一个特征峰,即PE膜主要由C元素组成,而改性PE膜表面出现至少4 个特征峰,其中由图3B、D可知,与空白对照组相比,改性PE膜399、532 eV处峰强度增加,表明N元素、O元素含量大量增加,且由于TCEP中存在有微量的S元素(164 eV)、P元素(132 eV),所以改性PE膜在164 eV和132 eV处的峰强度也有所增加,表明PE膜表面覆有一层涂层,图3C中特征C峰强度的变化亦论证了C元素含量的下降。涂层的主要元素组成为C(来源于溶菌酶)、N、O,以及少量的P、S。通过图3B~D可以证明PE膜表面成功接枝上了活性基团,为薄膜表面的进一步修饰提供了活性位点[35]。


图3 不同改性时间下PE膜的XPSFig. 3 XPS profiles of native and modified PE films at different reaction times
2.2.3 晶型结构与结晶度
如图4所示,改性后的PE膜与空白PE膜相比,衍射峰位置一致,均在衍射角为22°和29°处有明显的衍射峰,最强衍射峰均在22°处[36]。即溶菌酶相转变改性不会改变PE膜晶型。不同改性时间下PE膜的衍射峰无明显差别,说明随着改性时间的延长,聚集体在PE膜表面的堆积不会影响薄膜自身的结构。结合XPS和FTIR结果可知,溶菌酶自组装体对PE膜表面的黏附缘于溶菌酶分子中羧基、氨基等活性基团和自身的类淀粉样蛋白结构这些活性成分在薄膜表面的疏水作用与表面相互作用,从而达成改性的目的,与薄膜自身内部结构无关[37]。
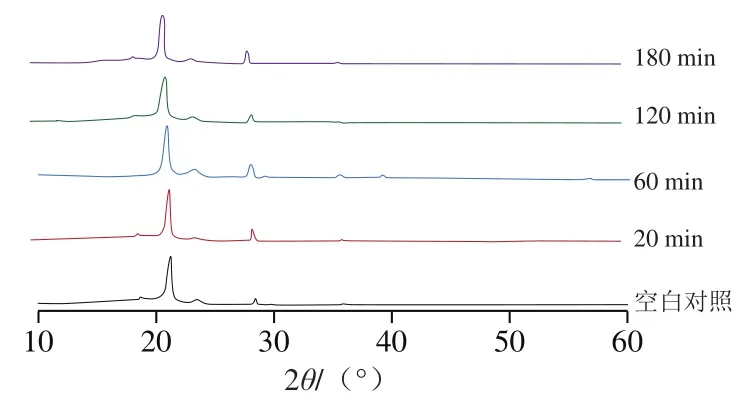
图4 不同改性时间下PE膜表面的XRD图Fig. 4 X-ray diffraction (XRD) spectra of native and coated PE films at different reaction times
2.2.4 微观形貌
从图5可以看出,20 min样品膜表面某一处有致密的聚集体(蛋白质)聚集,其余区域显示聚集体聚集较少。60 min改性样品的聚集体分布较为均匀,但聚集体之间空隙较大,120 min改性后的PE膜中,聚集体较为均匀地分布在基底(PE膜)表面,且蛋白之间未出现过度融合。180 min改性样品表面涂层分布致密均匀,但由5 000 倍放大图可知,180 min改性条件下的溶菌酶相转变聚集体之间发生较大程度的融合,即溶菌酶相转变聚集体的形成时间越长,粒径越大,相邻颗粒更倾向于发生蛋白融合。当改性时间过长时,溶菌酶相转变聚集体易在材料表面发生堆积,使得涂层不均匀,稳定性下降。改性时间为120 min时,涂层最为致密,且融合程度较低。这是因为在改性初期,PE膜与溶菌酶相转变溶液之间的表面张力因布朗扩散运动而快速降低,使得纳米颗粒能在界面之间实现动力平衡,完成自组装[38-39];随着改性时间延长至120 min,此时聚集体数量增加,相转变溶液表面张力降低速率逐渐缓慢,界面处趋于形成一张完整的薄膜而实现新的热力学平衡,已吸附于界面的粒子阻碍连续相中的粒子继续吸附至界面[37]。溶菌酶在TCEP的作用下在PE膜表面形成聚集体,该聚集体在表面张力及疏水性作用下形成一层致密的蛋白薄膜[24]。

图5 不同改性时间下样品的表面微观形貌Fig. 5 Microstructure images of native and modified PE films at modification times
2.2.5 水相接触角
材料表面的水相接触角越小,亲水性越好。由图6可知,未经改性的PE膜水相接触角大小为103°,改性后的PE膜的表面水相接触角均在70°左右,表明溶菌酶相转变形成的涂层对PE膜的疏水性有较大影响。未改性的PE膜表面呈疏水性,改性后的PE膜由于其表面的涂层富含羧基、羟基和氨基等亲水性基团,故呈亲水性[35]。不同改性时间下的PE膜表面的亲水性差别不大,表明溶菌酶发生相转变的速度极快,亲水性薄膜可以在溶菌酶与TCEP接触的20 min内基本形成,该结果与肉眼所观察相转变混合溶液的浑浊度变化现象一致。
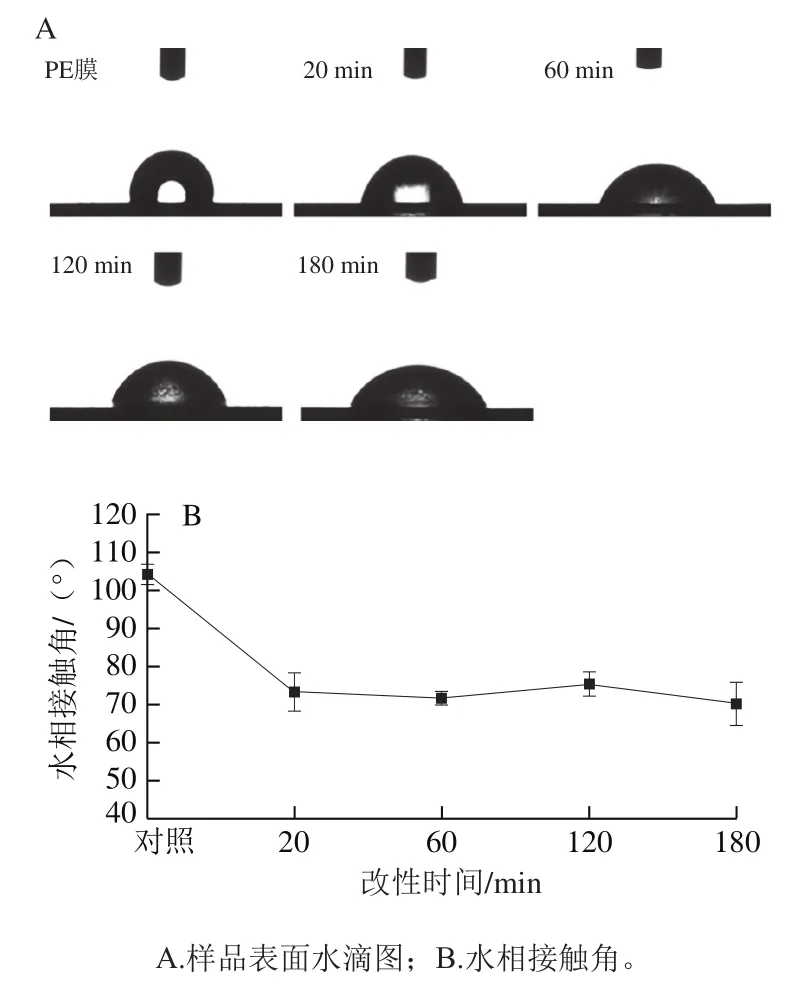
图6 不同改性时间下PE膜的水相接触角Fig. 6 Water contact angle of native and modified PE films
2.3 溶菌酶相转变改性对PE膜稳定性的影响
以未经改性的PE膜(对照1)和制备的改性时间为120 min的PE膜(对照2)为对照样品,经不同处理的样品表面水相接触角分析结果如图7所示。不同温度、溶剂环境、离子强度以及超声环境下的改性PE膜仍呈现出亲水性。由图7A可知,在不同温度环境下,改性PE膜表面亲水性变化不大,其中室温(25 ℃)下的PE膜水相接触角几乎无变化;由图7B可知,改性PE膜经极酸、极碱处理后未出现疏水情况,表明溶菌酶相转变涂层不受强酸、强碱腐蚀,相较于酸性环境,碱性溶液处理后的改性PE膜亲水性进一步增强,与新引入的—OH有关。同时,改性PE膜在石油醚、三氯甲烷等极性溶剂溶液中仍保持稳定,反映出薄膜涂层的抗蚀特性。由图7C可知,经过NaCl溶液处理后的PE膜水相接触角降低,是因为经不同浓度NaCl溶液处理的PE膜表面会附有一定的离子,这些离子易与水结合,进而使水相接触角有所下降[40]。而水相接触角低主要是因为涂层的黏附,所以不同离子强度不会影响涂层的黏附。由图7D可知,不同超声处理对溶菌酶相转变涂层的黏附无明显影响,PE膜仍表现出一定的亲水性,且当超声条件为160 W时薄膜的水相接触角与未经超声处理的PE膜接触角差别最小。综上所述,溶菌酶相转变涂层可稳定地黏附在PE膜表面,不受温度、超声、离子强度和强酸强碱、极性溶剂的影响。由FTIR和XPS结果可知,薄膜在PE膜表面的稳定黏附是因为溶菌酶自组装分子层在基底表面引入了活性官能团—NH2、—COOH、—OH、—SH。这些官能团通过静电作用、疏水作用、氢键与界面相互作用[35],从而使涂层能够稳定黏附在基底表面。

图7 不同温度(A)、极性溶剂(B)、离子强度(C)和超声功率(D)环境下样品的水相接触角Fig. 7 Water contact angle of different PE films under different conditions of temperatures (A), polar solvent (B), ion strength (C) and ultrasound power (D)
2.4 溶菌酶相转变改性对PE膜抗菌性的影响
食品在包装过程中极易受到葡萄球菌的污染,且细菌性食物中毒有很长的潜伏期,致死率较低[41]。金黄色葡萄球菌作为一种最常见的病原菌,将可能引起人体局部化脓感染,诱发肺炎等炎症,严重时可导致败血症,是一种危险的对人体有极大危害的致病菌[42]。如图8所示,未经任何处理的平板上金黄色葡萄球菌生长旺盛,然而经过PE膜处理的菌种生长受到一定的抑制作用,表明PE膜对金黄色葡萄球菌表现出一定的抑菌性,这可能是菌落在与PE膜接触培养时缺少营养物质所致。经改性PE膜处理后的平板上金黄色葡萄球菌的生长明显受到抑制,其中改性120 min的PE膜对金黄色葡萄球菌的抑制效果最好,平板上的菌落数最少。由菌落计数结果可知,溶菌酶溶液和PE膜均对金黄色葡萄球菌表现出一定的抑制作用,但当溶菌酶相转变对PE膜改性后,其抑菌效果大大提高,改性PE膜对金黄色葡萄球菌均有良好的抑菌效果。溶菌酶是通过水解细胞壁中肽聚糖主链上N-乙酰胞壁酸和N-乙酰葡萄糖胺之间的β-1,4-糖苷键起抑菌作用[43]。而改性后的溶菌酶相转变涂层由于表面呈现丰富的净正电荷与氨基,这些氨基提高了薄膜的表面抗菌能力[22,44]。有研究指出,相转变后的溶菌酶能够提高薄膜表面的净正电荷[22],可使微生物膜的静电场发生紊乱,因而对革兰氏阳性菌有较好的抑制能力。
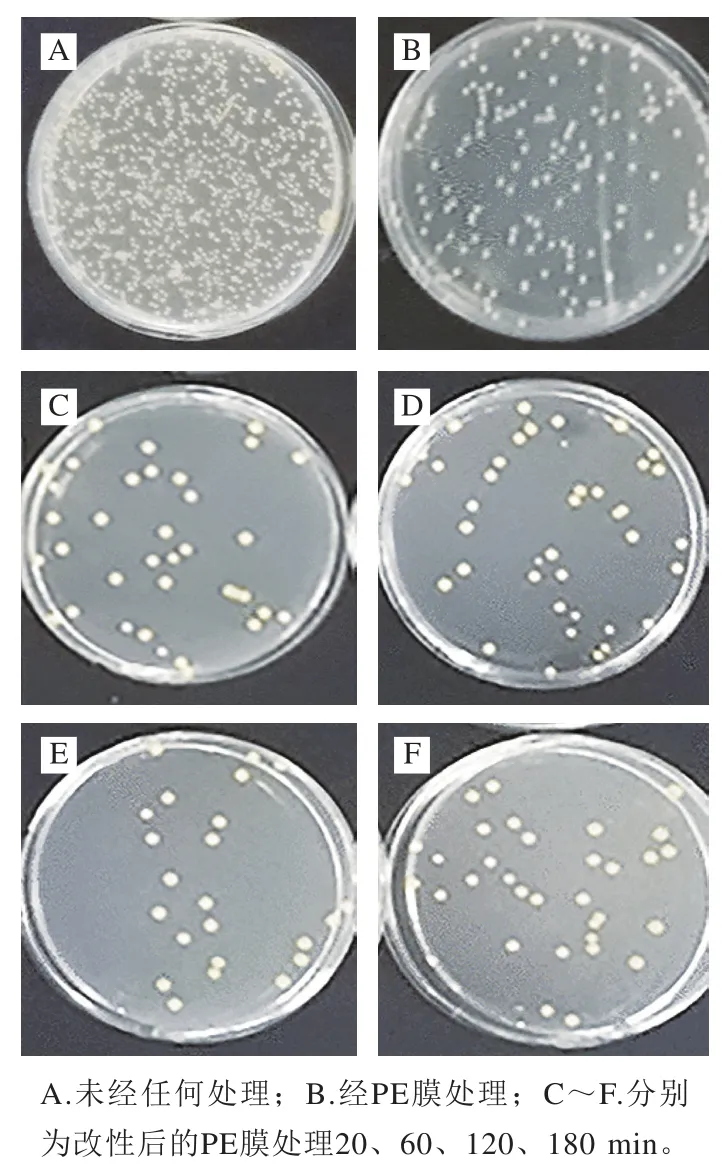
图8 不同改性条件下PE膜对金黄色葡萄球菌的抑制效果Fig. 8 Inhibitory activity of modified PE films toward Staphylococcus aureus
3 结 论
本实验研究结果表明溶菌酶可被TCEP迅速还原,在基底表面形成蛋白质基涂层。且随着反应时间的延长,涂层愈加均匀、致密。此外,水相接触角、FTIR分析等结果表明,改性后的PE膜表面富含羟基、氨基等亲水性活性基团,不同改性时间的涂层在不同温度、离子强度、极性溶剂和超声条件下均能稳定黏附在薄膜表面,且对金黄色葡萄球菌均表现出极佳的抗菌性能。本实验可为蛋白质基改性PE材料在后续食品包装领域的应用提供新的思路。但本实验中的溶菌酶仅对革兰氏阳性菌有明显作用,为提高溶菌酶抑菌能力的广谱性,仍需进一步研究。
