食品中氟喹诺酮类药物残留的快速检测研究进展
2022-04-01孙敏君徐阳鑫刘秀英励建荣
孙敏君,高 雪,徐阳鑫,刘秀英,励建荣
(渤海大学食品科学与工程学院,辽宁省食品安全重点实验室,生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心,辽宁 锦州 121013)
人类在日常生活和生产中都需要消耗大量的动物源性食品[1],畜牧业和水产养殖业是动物源性食品的主要供应来源[2]。为了解决畜牧业和水产养殖中动物疾病问题,抗生素类兽药被广泛应用于畜牧业和水产养殖业中细菌性疾病的预防和医治[3-5]。目前,我国允许在动物养殖中使用的抗生素类兽药主要有氨基糖苷类、四环素类、酰胺醇类、磺胺类和部分喹诺酮类药物[6]。
自1962年Lesher等[7]研制出第一个喹诺酮类抗菌剂药物萘啶酸,喹诺酮类药物迅速发展,到现在为止已开发了四代喹诺酮类药物[8]。第三代含氟的喹诺酮药物——氟喹诺酮类药物(fluoroquinolones,FQs),通过抑制DNA回旋酶,破坏DNA的合成和复制,从而导致细菌死亡[9-10]。由于其具有抗菌谱广、杀菌力强和价格低廉等特点[11-12],已然成为兽医的常用药物。但由于养殖和生产过程中一些不合理用药以及过量用药物问题的发生[13],残留的FQs通过食物链被人体摄入后,会对中枢神经系统和肝肾器官产生危害及毒性作用[14-15]。对于食品中FQs的检测,传统的检测方法有液相色谱法、酶联免疫法、电化学分析法及微生物分析法等[16],但均存在操作繁琐、设备庞大和检测时间较长等缺点。因此,研发应用设备简便、灵敏度高的快速检测方法具有十分重要的意义[17]。
荧光是物质被紫外线或X射线照射时发射出的各种颜色、不同强度的可见光。荧光分析法就是利用荧光强度及颜色变化进行定性和定量分析,是近十几年发展迅速的一种检测方法。它的特点是灵敏度较高且操作简单、响应时间短(由激发光照射后,几纳秒至几微秒即可发射可见光),正因为这些优点,使得荧光分析法在食品安全检测工作中被广泛应用且得到的很好的发展[18]。如Wang Chongwen等[19]设计了一种荧光定量分析试纸条,可在30 min内对食品中蛋白质毒素进行快速定量检测。2020年Chen Jiamin等[20]研发了一种基于铂纳米颗粒的荧光生物传感器,建立了快速检测水产品新鲜度敏感指标(次黄嘌呤)的荧光分析法。除此之外,荧光分析法同样被广泛地应用在生物医学领域、药物分析以及环境检测等工作中的痕量分析[21]。若将荧光分析法应用于食品中FQs药物残留检测,可以简化操作、缩短检测时间、提高灵敏度及降低检测成本。本文综述近些年运用荧光法快速检测食品中FQs残留的研究进展以及部分FQs残留限量,旨在为食品中FQs残留检测提供参考。
1 部分氟喹诺酮类药物残留限量
我国政府对FQs残留的危害性十分重视,农业农村部公告第2292号[22]规定“自2015年12月31日起,停止生产用于食品动物的洛美沙星(lomefloxacin,LOM)等4 种FQs兽药,同时撤销相关批准文号”。2019年9月6日发布的GB 31650—2019《食品安全国家标准食品中兽药最大残留限量》规定了达氟沙星(danofloxacin,DAN)等4 种FQs兽药在动物性食品中最大残留限量(maximum residue limit,MRL)[23]。国际食品法典委员会(Codex Alimentarius Commission,CAC)为保障消费者健康制定了关于动物源性食品中FQs的MRL[24],在2009年,欧盟委员会发布了《食品中药物活性物质最大残留限量》(EU)No 37/2010号条例[25],同样制定了部分FQs在动物源性食品的限量标准,主要药物的名称和在食品中的MRL如表1所示。
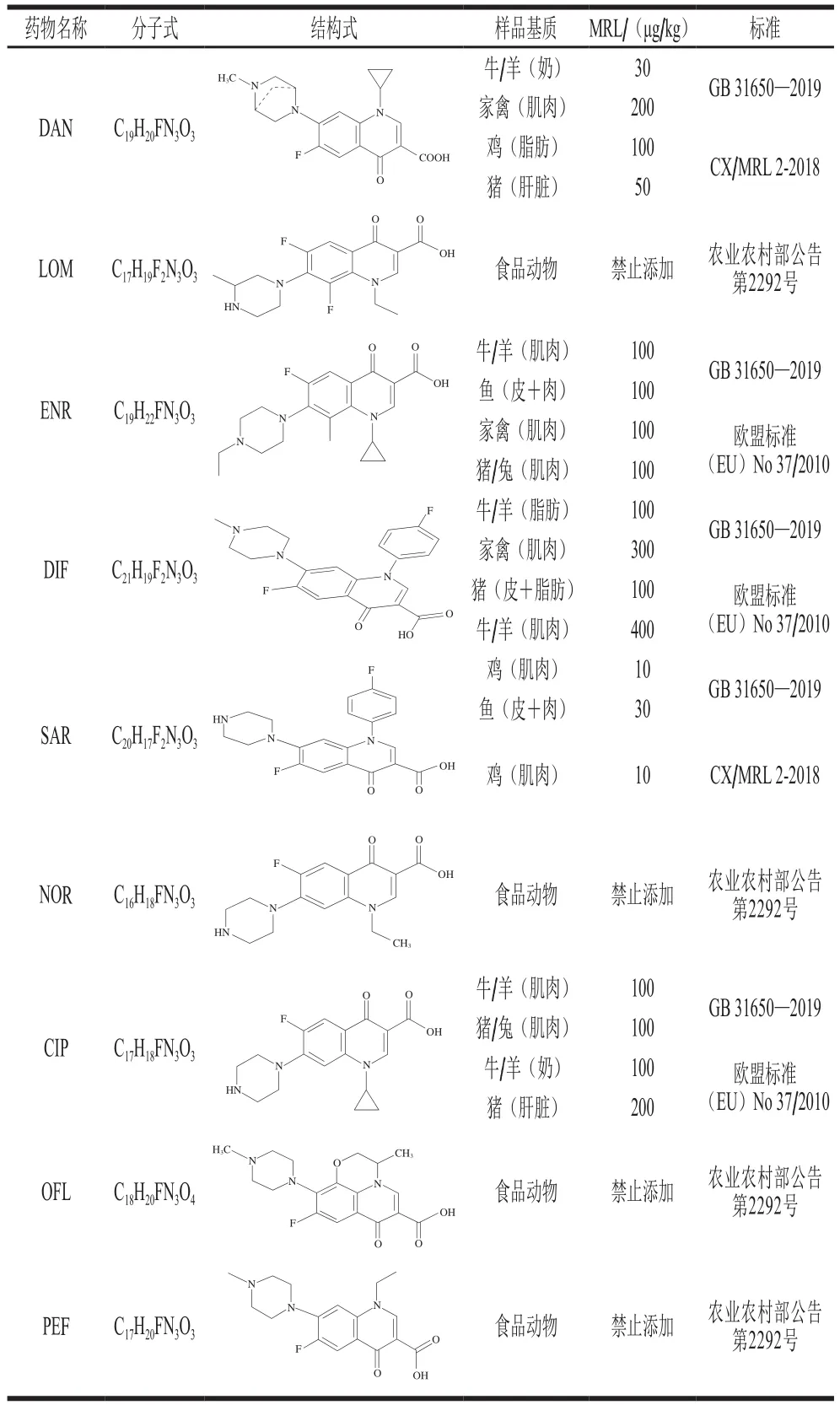
表1 部分FQs在食品中MRLTable 1 Maximum residue limits of some fluoroquinolones in foods
2 氟喹诺酮类药物残留荧光检测法
采用荧光分析法检测FQs,首先是对荧光材料的选择,荧光材料是荧光分析方法的重要基础。目前常用的荧光材料主要有有机荧光染料、纳米金、纳米银(Ag nanoparticles,AgNPs)、稀土发光纳米材料、量子点(quantum dots,QDs)等[26]。稀土发光纳米材料分为上转换发光和下转化发光两种。上转换纳米颗粒(upconversion nanoparticles,UCNPs)发光是在近红外较低能量激发下,发射较高能量荧光,具有背景干扰小的优势[27]。UCNPs通常由无机基质和掺杂稀土离子组成[28]。QDs是半导体纳米材料,具有电致发光和光致发光的特性[29],包含金属QDs和碳QDs(carbon quantum dots,CDs)。金属QDs一般由IIB-VIA族或IIIA-VA族元素合成,如CdTe QDs、ZnSe QDs等。CDs相对其他荧光材料具有很强荧光可调性,且低毒、稳定性高,近年来受到广泛的关注和应用[30]。如Ding Hui等[31]以L-谷氨酸和邻苯二胺为前体,通过改变反应溶剂并按适当的比例组合,合成了荧光发射从蓝色到近红外可调谐的CDs。
荧光分析的方法有很多,如直接的荧光增强和猝灭法、荧光免疫分析法、分子印迹聚合物(molecularly imprinted polymer,MIP)荧光检测法、荧光适配体传感器检测法、比率荧光和荧光比色分析法等。这些方法和技术的应用使荧光分析法朝着便捷、痕量以及智能的方向发展。
2.1 荧光增强检测法
荧光增强检测法是检测物通过给电子取代基与荧光物质形成共轭体系,产生共轭效应而引起荧光增强。荧光增强检测法可分为两种,一种是通过抑制光致电子转移(photoinduced electron transfer,PET)而使荧光增强[32],在PET体系中,电子供体通过间隔基与荧光团相连,PTE体系可导致荧光团猝灭,电子供体与检测物结合后,PET受到抑制,荧光恢复,如图1A所示[33]。另外一种是分子内电荷转移(intramolecular charge transfer,ICT)使荧光团荧光增强,检测物通过配位或氢键的形成作用于荧光团的供电子基团(供体)或吸电子基团(受体),供体供电子能力或受体的吸电子能力越强,ICT效应越强[34],增强荧光发射(图1B)。
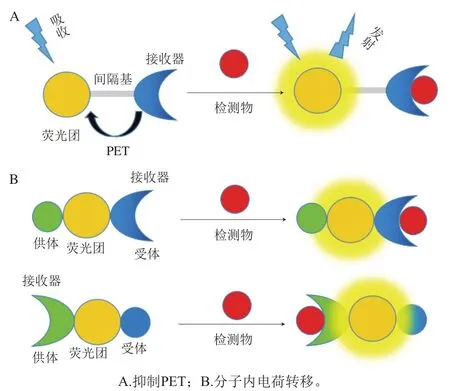
图1 荧光增强示意图[33]Fig. 1 Schematic diagram of fluorescence enhancement[33]
Hua Jianhao等[35]利用CDs建立了FQs的荧光增强检测法。该方法以聚(4-苯乙烯磺酸-共聚-马来酸)为前体,通过水热法合成了硫掺杂CDs(sulfur-doped carbon quantum dots,S-CDs)作荧光探针并结合Fe3O4磁纳米粒子(magnetic nanoparticles,MNPs),MNPs独特的超顺磁性使它在外加磁场下快速富集,去除外部磁场后,立即在溶液中重新分散[36]。基于S-CDs和NOR/CIP之间的强氢键相互作用和电荷转移,引起S-CDs荧光增强。通过外部磁铁作用,构建了CIP和NOR的吸附-洗脱-检测的荧光分析法。NOR和CIP的检测线性范围分别为0.02~1.25 μmol/L和0.02~1.0 μmol/L,检出限分别为4.6 nmol/L和6.7 nmol/L。
Kaur等[37]采用化学共沉淀法合成了聚乙二醇包覆的Tb3+掺杂的ZnS纳米粒子,用于NOR荧光检测。聚乙二醇包覆的Tb3+掺杂的ZnS纳米粒子在波长334 nm的激发下,产生两个发射峰(490 nm和545 nm),分别对应于Tb3+的5D4→7F6和5D4→7F5电子跃迁。随着NOR的加入,纳米粒子在545 nm波长处的荧光增强。以此来检测NOR残留量。
2.2 荧光猝灭与恢复检测法
荧光猝灭分析法是利用检测物和某一种荧光物质形成复合物或产生能量转移而产生猝灭作用,猝灭作用主要包括静态猝灭和动态猝灭,以及内滤效应(inner filter effect,IFE)等。图2A是荧光静态猝灭示意图,检测物和荧光物质分子发生络合反应,形成不发光的复合物。动态猝灭是检测物与荧光物质的激发态分子发生相互作用而引起的猝灭效应(图2B)。在IFE机制中,检测物(吸收体)的吸收与荧光团的发射带重叠,引起非辐射能量转移,导致荧光发射强度减小或猝灭[38]。
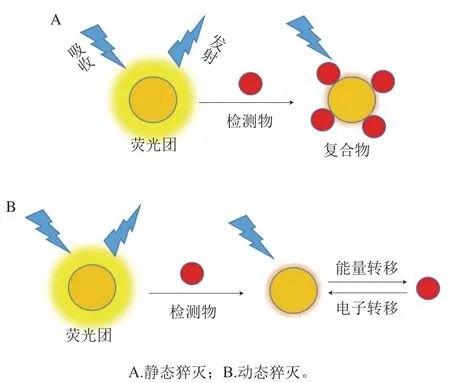
图2 荧光猝灭示意图Fig. 2 Schematic diagram of fluorescence quenching
Lu Wenjing等[39]以邻苯二胺和4-氨基丁酸为前驱体并采用水热一步法合成了亮黄色荧光CDs。由于NOR和CDs之间的络合反应形成稳定的复合材料,导致静态荧光猝灭。并且观察到CDs-NOR猝灭的荧光可以通过引入组氨酸来恢复。CDs-FQs系统具有在“开启”模式下监测组氨酸水平的潜力。对实际样品牛奶中FQs残留分析表现出良好的检测性,NOR、CIP和OFL检测线性范围分别为0.05~150.00、0.2~2.0、0.4~10.0 μmol/L,NOR、CIP和OFL的检出限分别为17、35、67 nmol/L。
Guo Xingjia等[40]以苹果酸和甘氨酸为原材料,采用水热法合成了棕色的CDs,当在368 nm激发波长下,CDs在452 nm发射蓝色荧光。并且Cu2+存在下通过电子转移可猝灭CDs的荧光,而加入ENR后可以逐渐恢复。由于ENR对Cu2+的结合亲和力高于CDs,二者形成了较大尺寸的配合物,CDs原始荧光才得以恢复。为此,设计了基于CDs-Cu2+体系荧光恢复的快速灵敏荧光传感策略,用于ENR的选择性检测。
Qian Sihua等[41]用溶剂热法制备了近红外(nearinfrared,NIR)-CDs,NIR-CDs显示出宽的激发带范围(200~600 nm),最佳的激发和发射波长分别在420 nm和680 nm处。对于FQs(以NOR为例)检测,随着NOR浓度增加,引起的NIR-CDs荧光强度下降是以IFE为基础的稳定猝灭机制所致。
2.3 荧光免疫分析法
荧光免疫分析法是利用抗体和抗原的特异性反应与荧光技术联结起来的一种检测方法。主要是通过荧光标记的抗体与抗原与结合,通过检测抗原抗体复合物的特异性荧光[42],最后根据荧光强度变化对检测物进行定性和定量分析。
Hu Gaoshuang等[43]利用UCNPs作为信号探针,建立了动物源性食品中FQs的荧光免疫分析方法。该方法以包衣抗原修饰的聚苯乙烯颗粒为免疫探针,结合羧基功能化的抗NOR单克隆抗体,建立了UCNPs生物传感体系NaYF4∶YbEr作为荧光免疫信号探针(在542 nm波长处记录发射强度,在980 nm波长处激发)。以水产品(海鲈鱼、鱿鱼和虾)进行检测。NOR的检测限为10 pg/mL,检测线性范围在1×101~1×104pg/mL。
Li Shijie等[44]基于CDs/AgNPs建立了荧光免疫层析分析法,应用于ENR的特异性检测。采用水热合成法制备氮掺杂CDs(nitrogen-doped carbon quantum dots,N-CDs),并根据荧光共振能量转移原理构建了一个N-CDs-AgNPs-抗ENR多克隆抗体共轭物的猝灭体系。当ENR存在时,破坏了荧光共振能量体系,使N-CDs荧光得以恢复,且能够在30 min内通过简单的操作检测ENR,检测限为0.1 μg/L。
Kergaravat等[45]将NOR的羧基通过活性酯法共价连接到牛血清白蛋白(bovine serum albumin,BSA)的赖氨酸基上。图3为在96 孔聚苯乙烯微孔板上建立的荧光免疫法检测FQs示意图。该方法是基于一种间接免疫竞争法,即样品中的FQs与固定在磁珠(magnetic bead,MB)上的FQs竞争抗FQs抗体,加入抗免疫球蛋白G抗体标记过氧化物酶及其底物(邻苯二胺),以邻苯二胺产物(2,3-二甲苯胺)的荧光强度为信号检测FQs,荧光信号与FQs浓度间接相关。ENR、CIP、DAN、OFL、SAR和NOR的检出限和定量限分别为13、10、13、30、29、22 μg/L和40、30、40、100、88、65 μg/L。
图3 荧光竞争免疫分析法检测FQs示意图[45]Fig. 3 Schematic diagram of fluoroquinolone detection by fluorescence competitive immunoassay[45]
2.4 分子印迹聚合物荧光检测法
分子印迹技术是模仿抗体抗原、酶与底物的特异性识别原理[46],将模板分子(检测物)先记忆,然后再洗脱,在印迹材料上形成特定的MIP,可以自然、选择性地识别检测物[47]。MIP具有良好的识别性能,但是缺乏检测信号传输,将荧光物质通过聚合反应与MIP相结合,形成分子印迹荧光传感器,以荧光信号作检测分析(图4)。常见的分子印迹荧光传感器分为有机染料分子印迹荧光传感器、稀土分子印迹荧光传感器和QDs分子印迹荧光传感器[48]。
Wu Chunxia等[50]选择异硫氰酸荧光素(fluorescein isothiocyanate,FITC)有机染料作为荧光信号材料,在FITC改性二氧化硅纳米球表面合成MIP,以亲水性功能单体丙烯酰胺在荧光印迹纳米粒子上制备有效的CIP识别位点,采用多步沉淀法合成了MIPs@SiO2-FITC,激发波长为470 nm,发射波长为525 nm。荧光强度随着猝灭剂(CIP)浓度的增加而降低。制备的MIPs@SiO2-FITC具有良好的选择性,检出限是4.04 nmol/L。
Tang Yiwei等[51]采用NaYF4∶Yb3+、Er3+UCPs并结合MNPs,通过局域光聚合法制备了多功能MIP荧光探针。该方法在UCPs分散的正丙醇溶液中加入Fe3O4纳米粒子和正硅酸四乙酯,利用水解反应制备了磁性上转换发光纳米粒子。使MIP成为磁性富集、分子识别和上转换荧光的三元探针。
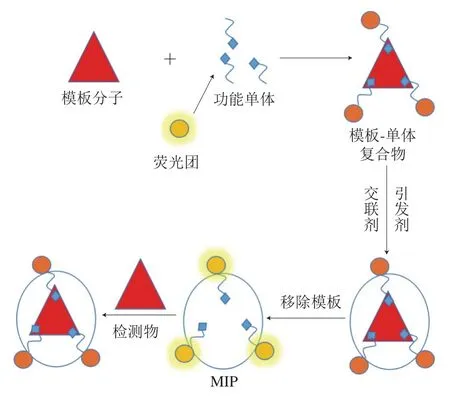
图4 MIP荧光检测法示意图[49]Fig. 4 Schematic diagram of molecularly imprinted polymer fluorescence detection[49]
Shi Tian等[52]以3-氨丙基三乙氧基硅烷为功能单体,聚乙二醇辛基苯基醚作为表面活性剂,NOR为分子模板,在硅烷化CdTe QDs表面合成了MIP。将模板分子洗脱后,得到与NOR分子的大小、形状和化学基团互补的特定三维印迹腔。NOR结合MIP-CdTe QDs后由于电子转移引起荧光猝灭,洗脱NOR后荧光再次出现,成功地制备了对NOR具有特异性的分子印迹荧光纳米探针。检出限为0.18 μmol/L。
2.5 荧光适配体传感器检测法
适配体是RNA寡核苷酸或DNA单链,它能特异性地与多种靶分子结合,如核酸、蛋白质、金属离子、抗生素以及细胞等,具有很高的亲和力、选择性和敏感性[53]。适配体在与靶点结合前后具有明显不同的构象,以荧光团修饰适配体互补DNA链或直接修饰适配体,适配体和靶分子结合后可以影响荧光物质的荧光信号的变化[54-56],无论是增强还是减弱,都可以反映结合过程的程度,从而可以对目标物进行定性和定量检测,如图5所示。

图5 荧光适配体传感器检测FQs示意图[56]Fig. 5 Schematic diagram of fluoroquinolone detection by fluorescence aptamer sensor[56]
Liu Xiuying等[57]设计了一种基于适配体修饰的Fe3O4MNPs与Yb、Er离子对掺杂UCNPs相结合的荧光适配体传感器。Fe3O4首先与具有适配体互补DNA链的UCNPs反应,在适配体与其互补DNA之间形成双链结构,生成杂交探针。因为探针在有ENR条件下优先与靶点结合,导致之前的部分双链结构解离后,杂交探针中的部分UCNPs被释放,荧光强度减弱,得到特异性好、灵敏度高的用于ENR测定的荧光适配体传感器。
2017年Liu Xiuying等[58]又提出了一种新型的ENR荧光“双识别”检测方法。将生物素化ENR适配体固定在UCNPs表面,以捕获ENR作为识别的第一个保障。当适配体在已有靶标上正确折叠后,结合分子印迹技术与ENR剩余官能团相互作用是第二个保障。对鱼类样本检测表现出良好的检测性能。
Reinemann等[59]采用荧光素标记寻找具有OFL特异性的适配体序列,并确定适配体-靶标体系的解离常数,经过8 轮的指数富集配体进化技术程序,获得了一个对几种FQs药物具有较高特异性的适配体。可以看出利用适配体、分子印迹技术以及免疫结合的特异性与高灵敏度的荧光分析法联用,能够进行识别性强,灵敏度高的分析检测,对于食品中FQs药物残留检测具有广阔的应用前景。
2.6 比率荧光检测法
只有一个荧光信号的产生可能有背景干扰的限制,基于比率的传感结构利用两个及以上不同波长荧光信号的比较(图6),然后计算其信号强度比[60],对FQs残留进行检测分析,能够更好地避免假阳性结果,进一步提升检测准确性。

图6 比率信号采集的示意图[33]Fig. 6 Schematic diagram of radio signal acquisition[33]
Liu Xiqing等[61]以桂花叶片为碳源,通过水热处理制备蓝色荧光CDs,采用溶胶-凝胶法与巯基乙酸修饰的红色CdTe QDs结合,随着CIP的加入,在657 nm波长处荧光逐渐猝灭,但在465 nm波长处左右,荧光强度逐渐增强,利用比率荧光选择性灵敏地测定CIP,检出限为0.012 7 nmol/L,线性范围为0~60 nmol/L。
Lu Changfang等[62]以硒酵母为原料,通过水热法合成了CDs。它们进一步与核黄素偶联,形成双发射比率荧光探针,在370 nm激发波长下,探针显示双发射峰,峰值在443 nm和510 nm。当加入CIP时,由于CDs与CIP之间的氢键和共轭效应所致,在相同的激发条件下CDs的蓝色荧光增强。而核黄素的荧光(510 nm)强度保持不变。以荧光强度比率(I443nm/I510nm)反映CIP的浓度。检测限为0.13 μmol/L。
Gui Rijun等[63]通过水热法制备了氨基功能化的CDs和羧基功能化硅QDs(Si quantum dots,SiDs)。CDs和SiDs通过碳二亚胺活化偶联反应结合形成CDs/SiDs共轭物。将共轭物用双(3-吡啶基甲基)胺(bis(3-pyridylmethyl)amine,BPMA)进行了功能化修饰,加入CuCl2溶液形成了CDs/SiDs-BPMA-Cu2+检测体系。在Cu2+存在下,Cu2+与CDs/SiDs-BPMA的表面配体有配位作用,引起SiDs荧光猝灭。而随着CIP的加入,Cu2+可以与CIP的C3-羧基和C4-酮基结合,产生一种新的Cu2+-CIP配合物,破坏了电子能量转移,荧光恢复。此外,Cu2+和CIP的加入不会影响红色荧光的CDs。以此建立了ISiDs/ICDs比率荧光检测法。
2.7 荧光比色分析法
荧光比色分析法是以荧光颜色变化为检测形式,通过裸眼或目测比色计进行观察,实现定性和定量分析,视觉画面的变化使人脑更容易更直接获取信息,达到可视化的实时现场荧光检测。荧光颜色变化分为颜色强度的变化和色调的变化[64],例如从暗红色到浅红色的变化,或者由黄绿色变成蓝色(图7)。

图7 荧光颜色随检测物浓度变化示意图Fig. 7 Schematic diagram showing fluorescence color changes with concentrations of analytes
Ye Yingwang等[65]报道了基于智能手机上QDs荧光比色分析法,通过将荧光信号转换为视觉颜色效果以实现对真实食品和环境样品中FQs的无标签现场检测。以黄绿色荧光的CdTe QDs匹配加替沙星(gatifloxacin,GFLX)的本征蓝色荧光,可在紫外光激发下形成双发射荧光信号,随着GFLX浓度的增加,通过PET,有效地触发在557 nm波长处黄绿色QDs的荧光猝灭,并伴随着448 nm波长处蓝色荧光强度显著增强。以QDs作为感应中心涂覆滤纸条,并嵌入到装有紫外灯的智能检测平台。一旦GFLX接触到感应中心,智能手机的内部摄像头启动图像捕获功能,以收集变化荧光颜色的实时图像。GFLX的检测线性范围在0.85~3.60 μmol/L,检出限为0.26 nmol/L,检测应答时间为5 min,可以看出该智能平台符合现场对食品中FQs残留快速检测的要求。
何伟杰[66]利用红色荧光CDs和蓝色荧光SINPs构建了可视化荧光探针(CDs@SINPs),利用加入Cu2+发生电子转移,猝灭SINPs荧光,再加入CIP与Cu2+键和,抑制光电子转移,SINPs蓝色荧光恢复,探针出现了由红色向蓝色的变化。并制备了荧光测试纸条,在实际样品检测中,可以通过肉眼观察到测试纸的颜色变化,实现CIP的可视化检测。
3 结 语
FQs抗菌药物已经广泛应用于畜牧业和水产养殖业中细菌性疾病的预防和医治。但由于不规范用药问题的发生会导致药物残留,残留药物被人体摄入后会产生危害。我国农业农村部对FQs残留的危害性十分重视,并制定了残留限量标椎。对于FQs残留检测方面,荧光分析法相比传统的高效液相色谱、液相色谱-串联质谱技术和毛细管电泳法具有简单、快速、灵敏度高以及成本低等优势,是检测食品中FQs药物残留高效率方法。如表2所示,各类荧光分析法在食品中FQs检测的应用具有较低检出限,并可在几分钟至几十分钟的时间内完成快速检测。
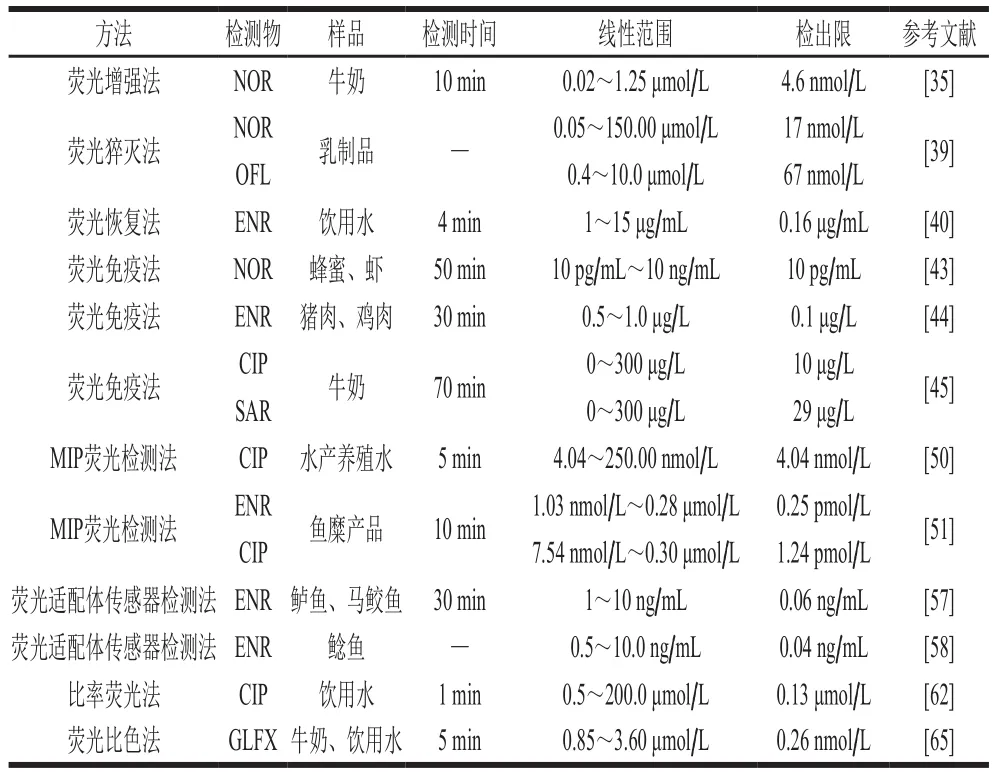
表2 荧光分析法在检测食品中FQs的应用Table 2 Application of fluorescence analysis in detection of fluoroquinolones in food
简单的荧光增强与猝灭检测法稳定性和抗干扰性较差,不能适用复杂的食品环境基质,荧光免疫分析法、分子印迹荧光传感器以及荧光适配体传感器都具有很强的特异性识别功能,在成分复杂的食品中,能够识别目标,提高荧光检测法的特异性和选择性,适用于检测环境干扰因素较多的检测条件。而比率荧光法提供了一种自校准方法,绕过了仪器和环境因素,能够提升检测的稳定性。
荧光比色分析法作为可视化的检测方法,比以上的荧光检测法具备直观可视化的特点和优势。在检测环境不能满足相应设备仪器的条件下,用荧光比色试纸进行检测判断,采用肉眼辨别荧光颜色变化,作为对检测物的定性及半定量分析,可以达到高效率、低耗能的现场快速检测。但同样也存在荧光颜色变化是否明显,以及能否达到更低的检测限要求的问题和挑战,以荧光比色法研发可视化的智能检测平台和荧光比色试纸,将为现场实时快速检测食品中FQs药物残留开拓新的视野,是未来几年荧光分析检测的研究热点。
