多糖与肠道菌群相互作用的研究进展
2022-04-01刘荣瑜张子依宋冬雪陈锦瑞汲晨锋
刘荣瑜,王 昊,张子依,宋冬雪,陈锦瑞,汲晨锋,*
(1.哈尔滨商业大学药物工程技术研究中心,黑龙江 哈尔滨 150076;2.哈尔滨商业大学 抗肿瘤天然药物教育部工程研究中心,黑龙江 哈尔滨 150076)
多糖是构成生命的四大基本物质之一,由至少10 个以上的单糖分子通过缩合、失水而成的高分子聚合物,分子结构式为(C6H10O5)n,结构模型如图1所示。多糖在自然界中广泛存在,主要存在于植物细胞壁、动物细胞膜以及微生物细胞壁中[1]。天然多糖具有广泛的生物学效应,如抗氧化[2]、抗肿瘤[3-4]、免疫调节[5]、抗突变[6]、抗炎[7]、抗菌[8]、抗凝血[9]、降血糖[10]、降血脂[11]、保护肝脏[12]等作用,还能够直接影响机体物质和能量的代谢,维持人类身体健康[13]。
图1 多糖分子结构模型Fig. 1 Model for the molecular structure of polysaccharides
肠道菌群由寄居在宿主胃肠道内的多种微生物如细菌、古细菌、真菌、病毒等构成。人类肠道的细菌总数可达到100万亿 个,大约由1 000多个种类组成,仅仅一个人的结肠内就有400 种以上的菌种。人类肠道菌群以细菌为主,厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)占主导地位(图2)。肠道菌群功能强大,具有保护肠屏障防止病原体入侵宿主、参与维生素(VK、VB)的合成、代谢功能、营养功能等屏障功能[14]。
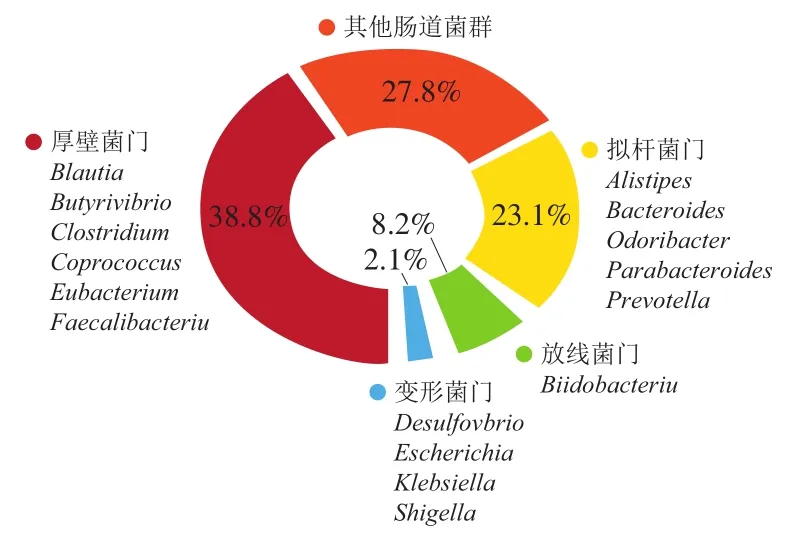
图2 肠道微生物主要组成菌属Fig. 2 Major intestinal bacterial genera
短链脂肪酸(short-chain fatty acids,SCFAs)也称为挥发性脂肪酸,是有2~6 个碳链的有机脂肪酸。肠道微生物可以将难消化的多糖发酵转化为SCFAs(如丁酸、丙酸和乙酸)。SCFAs能够为肠道上皮细胞提供能量,维持水电解质的平衡,调节肠道菌群平衡,改善肠道功能,且在抗病原微生物、抗炎、抗肿瘤、预防肥胖、预防非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)和预防2型糖尿病(type 2 diabetes mellitus,T2DM)方面具有重要作用[15-16]。其中,丁酸能够为肠道上皮细胞提供近60%~70%的能量,具有促进肠道内葡萄糖的生成、参与肠道内糖代谢、维持能量稳态的作用;丙酸能够参与并调节胆固醇的合成,减少促炎因子的产生,减轻结肠细胞的DNA损伤,还可以同肝脏中的脂肪酸受体相互作用从而调节葡萄糖的产生;乙酸是肠道主要代谢物之一,可直接刺激神经系统降低食欲,预防肥胖相关的高胰岛素血症和高甘油三酯血症[17]。虽然大量的证据表明,增加SCFAs的产生有利于宿主发挥抗肥胖和抗糖尿病作用,但一些体外和体内研究表明,SCFAs在肠道中的过度产生或积累也可能提升肥胖和T2DM风险[18]。
多糖是肠道菌群主要能源和营养来源,对肠道菌群有调节作用,对促进宿主机体健康发挥着重要作用。但在通常情况下宿主自身缺乏降解多糖的酶,导致机体不能直接消化吸收多糖,而肠道菌群则可以分泌多种降解酶,将多糖降解成机体可以吸收利用的物质,如SCFAs等[19]。因此,研究多糖与肠道菌群之间相互作用的关系对维持促进机体健康有着重大意义。本文总结了多糖与肠道菌群相互作用机制,包括多糖对肠道菌群调节的作用:1)多糖对肠道菌群的益生元作用;2)多糖对多种疾病(炎症性肠病、肿瘤、肥胖和糖尿病、腹泻)肠道菌群的调节作用。还有肠道菌群对多糖的代谢作用:1)肠道菌群对植物多糖的代谢作用;2)肠道菌群对动物多糖的代谢作用。以期为机体生命健康和合理膳食等方面的深入研究提供科学依据。
1 多糖对肠道菌群调节作用
多糖对人类健康有着深远的影响,多糖中有些不可被人体直接消化的成分可以诱导肠道微生物群的组成或代谢改善,促进肠道菌群中双歧杆菌等有益菌的增殖、抑制大肠杆菌等有害菌的生长来调节肠道菌群的结构,平衡肠道微生态,维持肠道菌群丰富度和多样性,促进宿主机体健康。此外,多糖的发酵产物SCFAs对糖代谢相关疾病的改善有重大作用[20]。
1.1 多糖对肠道菌群的益生元作用
益生元是一种不可消化的食物成分,包括果糖、低聚糖、阿拉伯低聚糖、异麦芽低聚糖、低聚木糖、抗性淀粉、乳糖、乳生物酸、甘露聚糖、软糖、多酚和多不饱和脂肪酸,对宿主机体健康有积极作用[21-22]。益生元通过抑制病原体和刺激免疫系统来维持机体胃肠道健康,同时可以通过调节肠道菌群的组成和活性、改变肠道环境,对多种由于肠道菌群紊乱引起的疾病如炎症性肠病(infammatory bowel diseases,IBD)、结肠癌等起到预防作用[23]。多糖可作为益生元,对肠道微生物种类的增殖产生影响,可以提高肠道菌群中有益菌乳酸菌、双歧杆菌等的丰度,降低肠道菌群中致病菌的丰度[24],部分多糖作用机制总结如表1所示。

表1 多糖对肠道菌群的益生元作用机制Table 1 Probiotic mechanism of polysaccharides on intestinal flora
菊粉是植物中储备性多糖,可以显著提高小鼠胃肠道SCFAs浓度,降低肠道pH值,抑制有害菌的生长,并选择性增加放线菌门中有益菌双歧杆菌的数量[25]。乳酸菌胞外多糖在人肠道内的代谢产物可以有效抑制肠道内有害菌大肠埃希菌的生长,显著增加SCFAs含量,尤其是丁酸的含量[26]。麦冬多糖可以增加小鼠肠道内丁二酸的含量,增加双歧杆菌和乳酸菌的数量,减少链球菌和大肠杆菌的数量[27]。木聚糖可以增加双歧杆菌、乳酸菌等数量;给喂食高脂/高糖饮食的小鼠食用AXs可以使小鼠肠道中维生素性菌株丰富度显著提高[28]。香菇多糖、海葵多糖可以促进正常小鼠肠道内总SCFAs的产生,维持肠道稳态,为机体提供能量[29-30]。RG I可以作为肠道菌群的益生元,刺激双歧杆菌和乳酸菌等益生菌的生长[31]。胃肠道中的SCFAs浓度越高,肠腔中pH值越低,可以有效地抑制某些有害菌的繁殖,从而加速有益菌的功能[32]。给正常小鼠喂食杏鲍菇多糖可以使小鼠结肠中SCFAs浓度升高,包括乙酸、丙酸、丁酸、异丁酸、正丁酸和异戊酸。盲肠和结肠中内容物pH值明显下降并呈剂量依赖性降低。对正常小鼠粪便进行操作分类单元(operational taxonomic units,OTUs)聚类分析发现,在门水平上小鼠肠道菌群中厚壁菌门、拟杆菌门和变形菌门为主要的优势菌门,随着杏鲍菇多糖的摄入,厚壁菌门相对丰度显著降低,拟杆菌门相对丰度升高,变形菌门无明显的变化;在类水平上,类杆菌、杆菌以及乳酸杆菌等有益菌相对丰度显著增加而有害菌梭菌数量则明显降低。对正常小鼠粪便微生物进行α-多样性分析,发现Chao指数上升,说明杏鲍菇多糖可以使小鼠粪便微生物丰富度增加,进而发挥益生元作用。
1.2 多糖对多种疾病肠道菌群的调节作用
多糖也可通过调节肠道菌群来改善炎症性肠病、肿瘤、肥胖、糖尿病以及腹泻等多种疾病,促进机体健康,主要作用及机制如表2所示。

表2 多糖对多种疾病主要作用及其机制Table 2 Major therapeutic effects and mechanisms of polysaccharides on many diseases
1.2.1 炎症性肠病
炎症性肠病被定义为胃肠道慢性炎症性疾病,其确切的发病机制尚不明确,但在病理中最直观的变化是肠黏膜屏障受损、免疫失衡以及肠道菌群结构紊乱。多糖可以通过调节肠道菌群丰富度和多样性,恢复肠道菌群结构来缓解炎症性肠病症状。
DSS诱导的结肠炎大鼠肠道内厚壁菌门的相对丰度明显低于正常大鼠,丁酸产生菌普氏粪杆菌丰度明显减少,拟杆菌门相对丰度高于正常大鼠,肠道菌群多样性减少。金针菇多糖显著提高了小鼠盲肠中SFCAs的浓度,其中乙酸、丙酸、丁酸、戊酸和异戊酸的含量明显增加,通过调节结肠炎大鼠肠道菌群微生态来改善大鼠结肠病理损伤,减轻炎症反应,经金针菇多糖治疗的大鼠结肠结构与形态有明显恢复,炎性细胞浸润明显减少。对经过金针菇多糖治疗的结肠炎大鼠肠道微生物进行OTUs聚类分析发现:在门水平上,大鼠肠道优势菌门分别是厚壁菌门、拟杆菌门和变形菌门,金针菇多糖可以显著提高厚壁菌门的丰度、降低拟杆菌门丰度,使厚壁菌门/拟杆菌门比值恢复到正常水平;对大鼠肠道微生物进行α-多样性分析发现,结肠炎大鼠肠道内容物ACE指数、Chao1指数以及Shannon指数全都有所提高,证明金针菇多糖可以改善结肠炎大鼠肠道菌群多样性和丰富度;β-多样性分析发现,通过主坐标分析(principal coordinates analysis,PCoA)显示金针菇多糖治疗的结肠炎大鼠肠道菌群的组成与结肠炎大鼠肠道菌群组成具有显著差异,说明金针菇多糖对结肠炎大鼠肠道微生物结构组成有良好的影响;线性判别分析效应量(linear discriminant analysis effect size,LEfSe)分析显示金针菇多糖可以有效降低结肠炎大鼠肠道菌群中引起疾病的螺杆菌科丰度,增加毛螺菌科的丰度,促进乳酸菌的生成[33]。
黄芪和党参多糖联合可以增加肠道内产异戊酸和丁酸菌群数量,提高异戊酸和丁酸浓度,进一步通过SCFA受体参与免疫调节,促进肠上皮黏液分泌,减轻肠黏膜屏障受损程度,恢复菌群平衡和结构多样性,改善小鼠结肠炎症状。对结肠炎小鼠肠道菌群进行OTUs聚类分析发现,在门水平上,结肠炎小鼠厚壁菌门、变形菌门丰度上升,拟杆菌门丰度显著下降,经联合多糖治疗后,厚壁菌门和拟杆菌门的相对丰度被调节回正常水平,显著降低了变形菌门丰度;在纲水平上,联合多糖明显的抑制了由于结肠炎引起的类杆菌和杆菌的减少,并下调了梭菌的数量。对小鼠肠道微生物进行α-多样性分析发现联合多糖可以提高小鼠肠道菌群丰富度和多样性。β-多样性分析发现,结肠炎小鼠与联合多糖治疗结肠炎小鼠的肠道菌群结构具有明显差异,证明联合多糖可以影响小鼠肠道菌群的组成[34]。
1.2.2 肿瘤
癌症(恶性肿瘤)是一种严重威胁世界人民生命健康的疾病。肠道菌群群落种类和大小的改变或者严重病理性失调会引发大肠癌,而多糖可通过调节肠道菌群,平衡肠道在体内摄取能量,发挥抑制肿瘤生长的作用。
地皮菜活性多糖可以显著改善AOM/DSS引起的大肠癌小鼠肠道菌群的改变,改善大肠黏膜屏障、抑制肿瘤细胞的增殖分化、减少癌细胞数量、缓解大肠癌症状。地皮菜多糖能够改善小鼠大肠黏膜腺体结构紊乱,恢复腺体形态,降低肿瘤细胞数量。对大肠癌小鼠肠道菌群进行OTUs聚类分析发现,厚壁菌门和拟杆菌门所占比例较大,地皮菜多糖可以提高发挥抗肿瘤作用的厚壁菌门丰度,降低诱导大肠癌的拟杆菌门相对丰度;在属水平上,明显提高毛螺菌科毛螺菌属、丁酸单胞菌属、丁酸球菌属等丁酸产生菌的数量,有效抑制拟杆菌-S24-7科和拟杆菌门的数量。对大肠癌小鼠肠道菌群进行α-多样性分析发现,小鼠肠道菌群的Sobs指数、Chao指数以及ACE指数均有所升高,表明菌群丰富度增加;Shannon指数上升、Simpson指数下降,表明菌群多样性也得到了提升。β-多样性分析发现地皮菜多糖治疗小鼠的肠道菌群组成与大肠癌小鼠相比具有显著差异。综合α-和β-多样性分析可知,地皮菜多糖可有效调节小鼠肠道微生物丰富度和多样性,恢复肠道菌群结构多样性,维持肠道菌群整体平衡[35]。
粒毛盘菌YM130胞外多糖可以改善结肠癌小鼠肠道菌群失衡,缓解由癌症导致的小鼠体质量下降、结肠长度缩短,恢复小鼠肠道屏障功能,减轻肠上皮损伤,并可以下调促炎因子水平,减轻炎症反应、增强肠道免疫力,从而抑制肿瘤生成,改善小鼠结肠癌症状。对结肠癌小鼠肠道菌群进行OTUs聚类分析发现以厚壁菌门、变形菌门以及拟杆菌门为主要菌群。在门水平上,粒毛盘菌YM130胞外多糖可显著提高拟杆菌门和厚壁菌门的相对丰度,降低变形菌门和芽单胞菌门相对丰度;在属水平上,明显增加了瘤胃菌属、乳杆菌属、毛螺菌属、双歧杆菌属等12 种有益菌的数量,降低了拟杆菌属、脱硫弧菌属、大肠志贺氏杆菌等10 种致病菌的相对丰度。对小鼠肠道微生物进行α-多样性分析发现,Chao 1、Shannon指数明显提升,说明结肠癌小鼠肠道菌群的丰富度以及多样性得到了改善;β-多样性分析发现,结肠癌小鼠与粒毛盘菌YM130胞外多糖治疗小鼠的肠道菌群结构具有明显差异,说明此多糖可以改善小鼠肠道菌群结构;此外,粒毛盘菌YM130胞外多糖还可以增加肠道中乙酸、丙酸以及丁酸的含量,提高SCFAs的浓度[36]。
Su Jiyan等[38]的研究发现,灵芝多糖能抑制4T1-乳腺癌移植小鼠模型肿瘤的体内生长,显著增加荷瘤小鼠外周血中的细胞毒性T细胞(cytotoxic T cell,Tc)数量和Tc/辅助T细胞(helper T cell,Th)的比值。此外,灵芝多糖还明显下调了脾脏中程序性死亡受体1(programmed cell death protein 1,PD-1)和肿瘤中细胞毒性T淋巴抗原-4(cytotoxic T lymphocyte antigen-4,CTLA-4)。通过对粪便微生物的基因序列分析发现,灵芝多糖能够重塑荷瘤小鼠的肠道微生物群结构,包括5 个菌门中18 个菌属,以及负责代谢、细胞过程和环境信息处理中信号通路的基因调控,促进向正常小鼠的方向发展。OTUs聚类分析发现,在门水平上,厚壁菌门和拟杆菌门占比90%以上,灵芝多糖可以提高厚壁菌门、变形菌门相对丰度,降低放线菌门、拟杆菌门、蓝细菌门相对丰度;在属水平上,灵芝多糖可以提高3 个与增强免疫应答相关菌属的相对丰度,包括螺杆菌、不动杆菌以及理研菌。α-多样性分析发现,移植瘤小鼠肠道微生物群的总体多样性没有受到影响;β-多样性分析发现,灵芝多糖可以恢复移植瘤小鼠肠道微生物群,与正常小鼠相似,证实了灵芝多糖可以重塑肠道菌群的结构[37-38]。
1.2.3 肥胖及糖尿病
从2011年起,肥胖发病率在全球范围内便以惊人的速度持续增长,严重威胁到人类健康,T2DM主要是由胰岛素缺乏或胰岛素抵抗所引起的一种复杂的代谢紊乱疾病。多糖可以通过调节肠道菌群失调,改善肠道菌群结构起到预防肥胖的作用以及改善T2DM症状,包括降低甘油三酯、总胆固醇水平,增加胰岛素水平、总抗氧化能力等指标。
玉竹多糖对HFD诱导肥胖大鼠有治疗作用,玉竹多糖能够抑制小鼠体质量增加、降低TG和TC的含量。对肥胖大鼠肠道菌群进行OTUs聚类分析发现,大鼠肠道菌群主要由厚壁菌门、拟杆菌门、变形菌门以及螺旋体门4大优势菌门组成,在门水平上,玉竹多糖可显著抑制肥胖大鼠肠道内放线菌门和变形菌门相对丰度;在属水平上,玉竹多糖可以显著降低梭菌、肠球菌以及乳球菌相对丰度,将粪芽孢菌属和萨特菌属相对丰度调整为正常水平。对小鼠肠道微生物进行α-多样性分析发现,与肥胖大鼠相比,治疗小鼠肠道微生物Chao指数明显增高,表明小鼠肠道微生物丰富度升高;Shannon指数也得到了提升,表明大鼠肠道菌群多样性得到了恢复。β-多样性分析发现大鼠肠道菌群组成有显著差异。玉竹多糖显著提高了大鼠肠道内SCFAs的浓度,包括异丁酸、丁酸和缬氨酸[39]。
黑种草籽多糖可以改善STZ诱导T2DM小鼠症状,降低了小鼠TG、TC表达水平,增加了INS水平,调节肠道菌群紊乱。小鼠肠道微生物OTUs聚类分析显示厚壁菌门和拟杆菌门为小鼠体内两大主要组成,其次为变形菌门和放线菌门。经种子多糖治疗后小鼠肠道菌群中厚壁菌门相对丰度下降、拟杆菌门相对丰度上升、变形菌门相对丰度也有所降低;对肠道内5 个优势菌属进行分析发现种子多糖可以增加小鼠肠道内类杆菌、乳酸杆菌和f-Muribaculaceae-Unclassified菌属数量,减少毛螺菌科NK4A136和毛螺菌科未分类菌属的数量。经α-多样性分析发现,种子多糖降低了小鼠肠道菌群Chao指数,升高了Shannon指数,说明种子多糖降低了小鼠肠道微生物的物种丰富度但提高了微生物群落的多样性,改善了肠道菌群紊乱。由β-多样性分析得知,治疗小鼠与未治疗小鼠肠道内类杆菌和毛螺菌科NK4A136相对丰度具有显著差异,推测种子多糖主要调节这两种微生物数量来发挥作用。此外,种子多糖还升高了小鼠肠道内乙酸的含量,降低了丙酸的含量[40]。
1.2.4 腹泻
肠道菌群与机体之间应维持一种相对平衡的关系,当这种平衡被打破后,肠道菌群就会紊乱、失调,进而引起一系列的疾病,其中AAD则是肠道微生态失衡的经典标志。
葛根多糖可以将抗生素相关性腹泻小鼠体内碳水化合物、氨基酸和能量代谢恢复到正常水平,改善肠黏膜损伤,恢复肠道微生物群落结构、丰富度以及多样性。对小鼠肠道微生物群落结构进行OTUs聚类分析,发现葛根多糖可以降低小鼠肠道内放线菌门、变形菌门和软壁菌门的相对丰度;在属水平上则能有效逆转小鼠肠道内脱硫弧菌数量的减少,并提高粪球菌、棒状杆菌、短杆菌、寡源杆菌以及梭菌等有益菌的丰度。对腹泻小鼠肠道微生物区系进行α-多样性分析发现,葛根多糖治疗小鼠肠道微生物的Chao指数和Shannon指数有明显增高;β-多样性分析发现治疗小鼠肠道微生物组成与腹泻小鼠存在明显差异,说明葛根多糖对小鼠肠道菌群组成具有积极影响。葛根多糖增高了小鼠盲肠中乙酸、丙酸、丁酸含量,降低了不利于腹泻小鼠肠道环境平衡的异戊酸含量[41]。
红藻硫酸多糖可以预防小鼠细菌性腹泻,通过调节紊乱的肠道菌群,恢复肠道微生物丰富度和多样性平衡,可以显著降低小鼠腹泻率和腹泻指数,恢复肠组织黏膜结构和形态的完整性,显著减轻炎症反应。对小鼠肠内容物OTUs聚类分析发现拟杆菌门和厚壁菌门为优势菌群,在门水平上,硫酸多糖提高了腹泻小鼠厚壁菌门丰度,降低了放线菌门和变形菌门的丰度;在属水平上,提高了双歧杆菌属、乳酸杆菌属以及瘤胃菌属的相对丰度[42]。
2 肠道菌群对多糖的代谢作用
肠道菌群十分复杂,以细菌为主,主要由拟杆菌门和厚壁菌门组成,也包括少量放线菌门和变形菌门。人体肠道菌群可利用的主要能量和营养来源为宿主碳水化合物和膳食复合碳水化合物。膳食复合碳水化合物包括植物多糖和动物多糖。但人体消化道一般无法直接消化吸收动植物多糖,需要借助肠道菌群分泌的多种多糖降解酶,对其进行代谢降解才能被机体利用。人体肠道菌群中多糖的代谢是由碳水化合物活性酶(carbohydrate-active enzymes,CAZymes)介导的,包括多糖裂解酶(polysaccharide lyase,PLs)、糖苷水解酶(glycoside hydrolases,GHs)和碳水化合物酯酶(carbohydrate esterases,CEs)。人类基因组不会针对不同的糖苷键而编码足够的有效CAZymes,这一原因限制了人体对糖的酵解利用。而肠道微生物基因集约为人类补体基因的150 倍,可诱导数千种互补的CAZymes,并可以靶向消化代谢数十种多糖,帮助人体更好地吸收利用多糖,促进机体健康[43]。肠道菌群对多糖的作用机制如表3所示。

表3 肠道菌群代谢多糖机制Table 3 Metabolic mechanisms of polysaccharides by intestinal bacteria
2.1 肠道菌群对植物多糖的代谢
植物细胞壁为肠道菌群所需营养物质多糖的主要来源。植物多糖的成分包括纤维素、半纤维素、果胶以及阿拉伯半乳糖蛋白(arabinogalactan proteins,AGPs)。纤维素是由葡萄糖以β-1,4-糖苷键连接而成的大分子多糖;半纤维素由木聚糖、木葡聚糖和甘露聚糖组成;果胶是含有大量半乳糖醛酸、RG I、RG II以及同聚半乳糖醛酸(homogalacturonon,HG)的植物细胞壁多糖;AGPs是由β-半乳聚糖、阿拉伯糖和蛋白质构成的植物糖蛋白。植物多糖中最复杂的多糖为RG I、RG II、木聚糖和AGPs[50],本文以这4 种主要成分为例,阐释肠道菌群对其代谢降解的作用。
2.1.1 肠道菌群对RG I的降解作用
RG I主要由鼠李糖和半乳糖醛酸组成,RG I-B为[(→4)-α-D-Galp A-(1→2)-α-L-Rhap-(1→)]n[51]。转录组数据分析表明,RG I-B可以上调编码GHs和PLs的PULs表达。肠道拟杆菌降解RG I的主要作用机制如图3所示,RG I-B的降解首先是由细胞表面PLs引发的,进入细胞周质的低聚糖首先被2 种特异性不同的PLs解聚,然后进一步由GHs降解为具有鼠李糖-半乳糖醛酸重复序列的寡糖,并通过3 种主要β-1,4-半乳糖苷酶(BT4151、BT4156、BT4160)的协同作用,从RG I-B中降解出半乳糖基产物,进而达到降解RG I的目的。RG I-PULs除了降解RG I-B,还可以去除连接在RG I侧链上的单糖残基来降解RG I[46]。拟杆菌降解RG I多糖获得了营养,便可以使降解酶的催化性能得到优化,激活特定PULs的糖链,确保在整个生长过程中持续供应诱导分子,由于多糖被降解,机体也可以更好地利用吸收多糖,促进机体的健康,形成了多糖与菌群相互作用的良性循环。在人类结肠中,多形拟杆菌基因组中也存在RG I-PULs,但其具体的降解机制尚不清楚[48]。
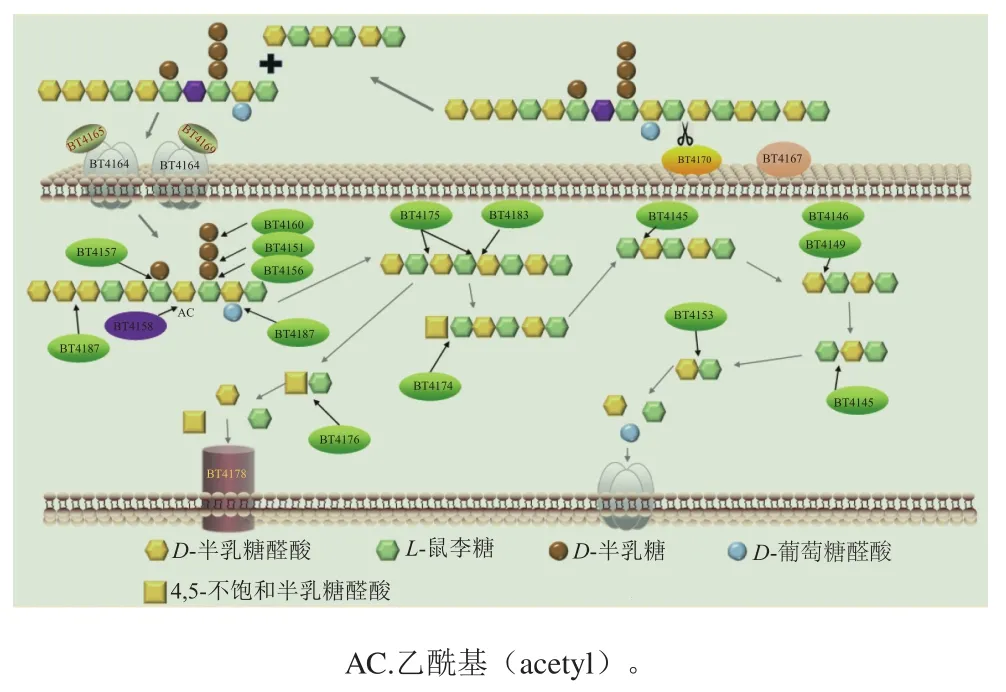
图3 RG I降解途径[46]Fig. 3 Schematic illustration of RG I degradation pathway[46]
2.1.2 肠道菌群对RG II的降解作用
RG II属于植物细胞壁多糖,由13 种不同的单糖和21 种不同的糖苷键排列成不同侧链的骨架构成。Ndeh等[45]通过肠道微生物Bacteroides thetaiotaomicron揭示了RG II的降解机制,确定了参与RG II降解的酶以及PULs(图4)。RG II的降解主要依赖PULs对其骨架进行裂解,骨架发生裂解之后促进酶的嵌入,使得侧链进一步发生降解。B. thetaiotaomicron可以裂解RG II中21 个糖苷键,大部分糖苷键裂解的过程仅发生在细胞周质。B. thetaiotaomicron利用7 个新的GH家族(GH137-GH143),包括1 个糖苷内切酶(BT1012、GH140)、1 个DNA水解酶(BT1020、GH143的N端)、2 个β-L-阿拉伯糖苷酶(BT0996、GH137的N端;BT1020、GH142的C端)、1 个α-2-O-甲基-L-葡萄糖苷酶(BT0984、GH139)、1 个α-L-葡萄糖苷酶(BT1002、GH141)和1 个α-半乳糖醛酸酶(BT0997、GH138),以及1 个新的果胶甲基酯酶(BT1017),通过促进BT1023来启动RG II骨架裂解,骨架裂解后,与GalAs相连的糖苷键进一步由BT1001进行断裂[50]。
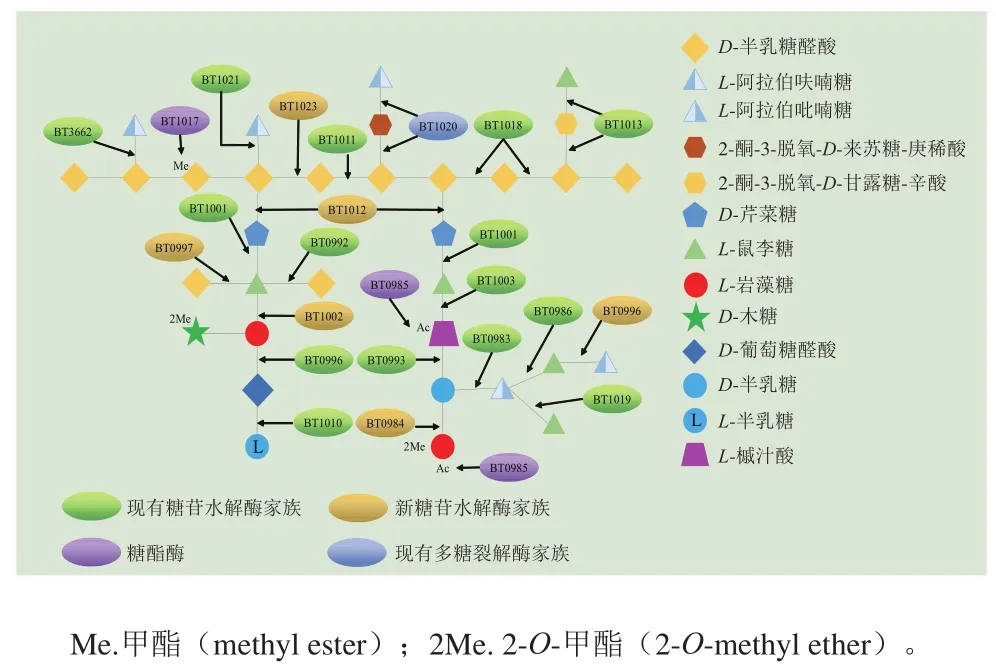
图4 RG II降解途径[45]Fig. 4 Schematic illustration of RG II degradation pathway[45]
2.1.3 肠道菌群对木聚糖的降解作用
木聚糖是植物半纤维素的主要成分,主要由β-D-(1→4)连接的木聚糖组成主链骨架结构,因侧链单糖种类不同而不同[52],主要分为葡萄糖醛酸木聚糖(glucuronoxylans,GXs)、AXs和葡萄糖醛酸阿拉伯木聚糖(glucuronoarabinoxylans,GAXs)[53]。木聚糖可以促进拟杆菌、双歧杆菌等有益菌的生长并诱导其发酵产生短链脂肪酸,在体内发挥益生元的作用。多糖降解通常发生在结肠近端,由于发酵产生SCFAs会使结肠pH值下降,而蛋白质降解则发生在结肠的远端,肠道菌群对木聚糖的降解恰好在结肠的远端进行,由于结肠远端的pH值降低,蛋白质的降解被抑制,因此有降低结肠癌风险的作用[54]。拟杆菌门中包括2 个不同的PULs(PULXylS和PUL-XylL),通过编码木聚糖降解酶降解木聚糖。双歧杆菌则只能利用gpPULs编码的ABC与细胞表面的糖结合蛋白结合,再通过1,4-β-木聚糖内切酶和β-木糖酶对木聚糖进行降解。厚壁菌门可以分泌多种木聚糖降解酶,包括乳酸菌和罗氏菌[55]。
2.1.4 肠道菌群对AGP的降解作用
AGP主要由阿拉伯糖和半乳糖组成,与含有丝氨酸、苏氨酸以及羟脯氨酸的蛋白质相连。在双歧杆菌属中只有少量长双歧杆菌(包括B. thetaiotomicron、粪拟杆菌、单形拟杆菌、卵形拟杆菌等)可以代谢简单的AGP,但活性较差[56-57]。其中多形拟杆菌可以编码3 种α-L-阿拉伯呋喃糖苷酶(GH51、GH146和BT0369),前2 种酶属于阿拉伯糖内切酶,它们在B. thetaiotomicron表面开始降解,然后通过SusCH/SusDH系统导入细胞质后,利用BT0369断开α-1,2-L-阿拉伯呋喃糖侧链对AGP进行降解。此外,B. thetaiotomicron中的Gal-PUL还可以编码1 个作用于周质的β-半乳糖苷酶(GH2家族)和1 个作用于细胞表面的β-1,4-半乳糖苷酶(GH53家族),由β-1,4-半乳聚糖酶在细胞表面水解成半乳糖链,然后导入到细胞周质中由β-半乳糖苷酶进一步降解[46]。
2.2 肠道菌群对动物多糖的代谢
动物多糖主要由糖胺聚糖(glycosaminoglycans,GAGs)和黏蛋白-O-聚糖组成,是机体肠道重要的营养来源。人体无法直接代谢动物多糖,需要借助肠道菌群进行降解和利用[50]。
2.2.1 肠道菌群对GAGs的降解作用
GAGs附着在细胞表面和细胞外基质的蛋白质上,属于蛋白多糖,是由葡萄糖胺(肝素(heparin,Hep)、硫酸乙酰肝素(heparan sulfate,HS))或半乳糖胺(硫酸软骨素(chondroitin sulfate,CS))与糖醛酸相连组成。人肠道菌群中的拟杆菌门可以产生降解GAGs的酶,研究表明,11 种不同拟杆菌对GAGs底物利用率不同,与其是否编码相关功能蛋白相关,其中B. thetaiotaomicron起到了主要的降解作用[20]。
2.2.1.1 肠道菌群对Hep/HS的降解作用
由于Hep和HS的聚合度不相同,所以有学者推测它们的降解可能发生在不同的细胞区间。Hep和HS的解聚发生在脱硫之前,Cartmell等[58]揭示了B. thetaiotaomicron通过表达的PLs、GHs、硫酸酯酶来如何共同解决Hep和HS的硫酸化问题。B. thetaiotaomicron对Hep和HS的降解机制如图5所示,当B. thetaiotaomicron遇到Hep或HS时可以激活PULs,PULs基因簇可以编码4 个PLs,其中PL-12裂解酶位于细胞表面,而其他3 种裂解酶(PL-12、PL-13、PL-15)则位于细胞周质。HS在细胞表面可被PL-12裂解酶降解,供机体利用。在细胞周质中,Hep和HS可同时被剩余3 种PLs降解,每种PL对不同硫酸化程度的亚结构都表现出特异性,最终双糖产物在糖苷键被GH88水解之前,其结构中的糖醛酸被硫酸酯酶脱去。目前为止,厚壁菌门基因组中只存在1 个可以编码PL的位点(PL-12),可能有助于Hep和HS的降解,但具体机制尚不明确。

图5 B. thetaiotaomicron 对Hep和HS的降解途径[58]Fig. 5 Degradation pathways of Hep and HS by B. thetaiotaomicron[58]
2.2.1.2 肠道菌群对CS的降解作用
拟杆菌门成员B. thetaiotaomicron、B. caccae、B. ovatus等编码PULs对CS的降解具有高度特异性。CS可由SusCH/SusDH对转运体系统转运至细胞周质中,然后B. thetaiotaomicron编码PLs将其裂解代谢。CS二糖可以降低肠道菌群中引起炎症菌群的相对丰度,而经过降解的CS发生了脱硫,CS脱硫后则会引起机体产生炎症,有益菌相对丰度减少,说明CS降解虽然能够为B. thetaiotaomicron提供营养,但却可能无法促进机体肠道菌群健康[59]。厚壁菌门对CS的降解过程与Hep和HS降解过程相似,不同的是CS只能被厚壁菌门成员中间链球菌降解成为低聚糖,然后再通过其他菌将其发酵成SCFAs,其中乙酸、丙酸、丁酸等发挥对肠道菌群调节的作用,维持正常机体肠道菌群的平衡、改善机体肠道菌群紊乱的状态,减轻由于肠道微生态失衡引起的疾病。
2.2.2 肠道菌群对黏蛋白-O-聚糖的降解作用
黏蛋白是一种高度糖基化修饰的高分子质量蛋白,其糖链主要是由N-乙酰氨基葡萄糖、N-乙酰半乳糖胺、岩藻糖和半乳糖组成的低聚糖构成,是胃肠道黏膜的主要屏障之一,能够有效阻止病原体和人肠道菌群进入黏膜上皮细胞,预防由病原体和微生物所引起的疾病[49]。结肠黏液中的黏蛋白可以为人体肠道菌群提供丰富的营养,因此肠道菌群对黏蛋白的代谢降解也十分重要。Ruas-Madiedo等[59]发现人体肠道菌群对黏蛋白的降解方式主要是通过代谢修饰O-聚糖,变形菌门中双歧杆菌可以代谢黏蛋白。降解黏蛋白需要特定的GHs,目前已发现12 种能够降解黏蛋白的CAZymes,它们分别是GH2、GH20、GH29、GH33、GH42、GH84、GH85、GH89、GH95、GH98、GH101和GH129。Tailford[60]和Katoh[61]等揭示了双歧杆菌属成员Bi. longum对黏蛋白的降解途径,降解作用位点如图6所示,MUC1在细胞外被Bi. longum基因组编码的GH101家族α-N-乙酰半乳糖胺内切酶降解为半乳糖-β-1,3-N-半乳糖胺,再借助ATP结合转运蛋白进入细胞质,在细胞中被GH12家族的半乳糖-N-二糖磷酸化酶进一步发酵成SCFAs,参与机体能量代谢以及碳水化合物代谢,对肠道微生物起到调节菌群紊乱、恢复菌群丰富度和多样性等积极作用。
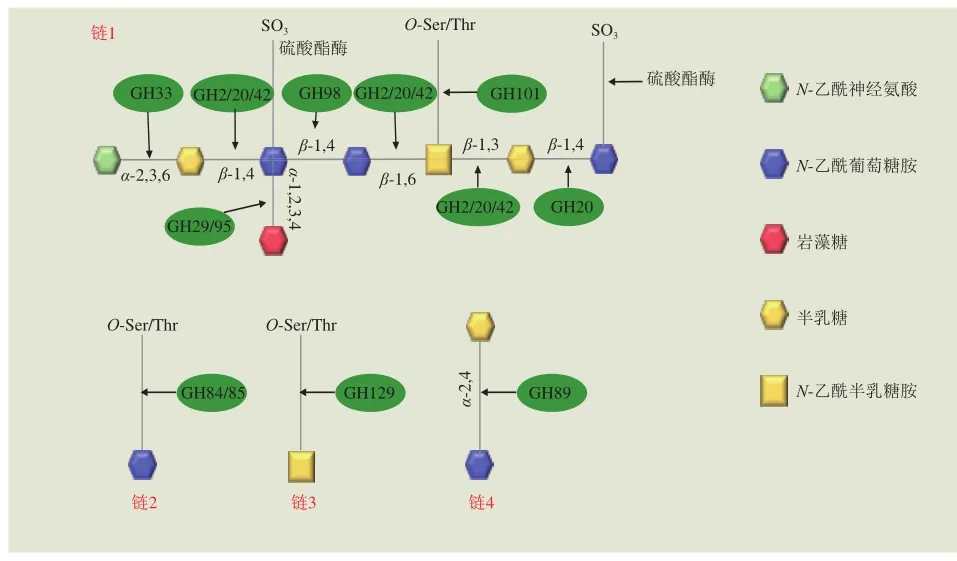
图6 糖苷键降解作用位点[60]Fig. 6 Action sites for glycoside bond degradation[60]
3 结 语
多糖可以通过调节肠道菌群将紊乱的菌群恢复到正常水平、增加菌群的丰富度和多样性,来维持机体肠道菌群平衡,起到治疗疾病和促进机体健康的作用,但多数多糖中发挥作用的确切活性成分结构和对菌群结构、丰富度、多样性具体的作用机制还不够清楚,需要对其制备方法、理化性质、一级结构信息和高级结构特征开展系统全面的研究工作,确定调节肠道菌群的物质结构基础,阐明构效关系[62]。并针对不同的成分分别研究其对肠道微生物群的作用,确定不同结构对疾病的影响;对不具有肠道菌群调节活性或活性较弱的多糖,可以进一步应用硫酸化、甲基化、磷酸化等方法对其结构进行修饰和改造,获得活性多糖衍生物,发挥治疗作用。
已有研究表明多糖联用能够重建结肠炎小鼠肠道菌群平衡、减轻结肠黏膜损伤程度、改善小鼠结肠炎症状,联用发挥的作用比单独用药作用更加显著[34]。多糖来源广泛,具有多种显著的活性,可对肠道菌群引起的不同类型疾病产生预防和治疗作用,根据其对机体肠黏膜屏障、免疫平衡和菌群结构的作用机制具有多样性的特点,可以在遵循中医药配伍原则的前提下,利用复合多糖来更好发挥多糖对肠道微生物的作用,进而更加有效地治疗疾病。
研究表明梭菌对结肠炎的治疗作用是具有两面性的,艰难梭菌会恶化结肠炎,而产孢梭菌则通过参与氨基酸代谢来维持肠黏膜屏障缓解结肠炎症状[27]。这一结果表明仅宏观地进行某一类肠道菌群的生物学功能分析和定义还不够科学和严谨,应按照分类的不同找出有治疗作用的具体肠道菌的种类,研究其对疾病具体的作用机制。肠道菌群对多糖的降解是通过编码PULs来实现的,但肠道菌群基因组是如何进行编码的研究目前尚属空白,为了能够更清晰了解降解机制,应该更加集中地分析代谢食物网以及关键基因。因此,仅对肠道菌群进行OTUs聚类分析、α-多样性分析和β-多样性分析是不全面的,应该利用更加深入全面高效的技术来明确菌群的具体结构变化、代谢能力和全部基因组的功能,便于更加深入了解多糖与肠道菌群的关系与作用。
高通量测序和宏基因组学已经成为分析肠道菌群的常用技术,高通量测序能够在较低的成本下大量地收集物种的遗传信息[63],无需培养菌群也能直接分析菌群组成和丰富度,并将其与相关疾病关联起来进行分析,但会出现系统性偏差,影响数据结果;宏基因组学可以对菌群进行无限次测序,分析菌群多样性,但其有效测序量较低、成本较高,并且全长基因物种分类数据库容量较低,只适用于丰度较高的菌群。因此,探索新方法来分析肠道菌群应成为未来的研究重点,包括宏基因组学、基因组学、转录组学、蛋白质组学、代谢组学、培养组学及全微生物分析等多组学联合分析技术,以为科学地阐明多糖与肠道菌群相互作用关系提供有力支撑[64-66]。
肠道菌群在体内数目庞大,且参与多种器官的调节,可作为疾病治疗作用的靶点。肠道菌群对机体生理轴的调节作用及信号通路还未被广泛研究,包括脑-肠轴、肠-心轴、肠-肝轴、肠-胆轴、肠-脾胃轴、肠-肺轴、肠-肾轴、肠-肌轴等[67-70]。今后还需要更多的基础和临床研究来探究肠-生理轴作用的具体机制、信号通路及靶点分子。
多糖可作为益生元来促进肠道中有益菌增殖、抑制致病菌的生长,维持肠道微生物菌多样性,促进肠道微生态平衡,也可通过调节肠道菌群丰度改善多种由于菌群紊乱引起的一系列疾病,而肠道菌群反过来也可以通过分泌多种多糖降解酶协助机体利用本身无法直接代谢吸收的多糖,促进机体健康。但多糖对某些肠道菌群具体调节机制目前还不明确,甚至某些多糖还会引起疾病,目前对于多糖治疗疾病具体用法用量研究较少;肠道菌群对多糖降解机制尚不明确,两者之间相互作用机制研究工作不够系统,因此,今后应从宏观到微观开展更加深入的研究工作。
