白藜芦醇酯化改性及其纯化表征研究进展
2022-04-01胡小宁李宁阳王新萍唐晓珍
胡小宁,李 甜,郭 芹,李宁阳,张 雨,屈 阳,王新萍,4,唐晓珍,*,王 强,*
(1.中国农业科学院农产品加工研究所,北京 100193;2.山东农业大学食品科学与工程学院,山东 泰安 271000;3.中国农业科学院生物技术研究所,北京 100081;4.新疆农业大学食品科学与药学学院,新疆 乌鲁木齐 830052)
白藜芦醇(resveratrol,Res)又称芪三酚,是一种存在于虎杖、花生、葡萄等植物中的非黄酮类多酚化合物,具有抗炎、抗氧化和抗肿瘤等作用,但存在熔点高、脂溶性差、靶点多、生物利用度低等问题,限制了其在食品领域的应用。为了解决以上问题,Res酯化改性近年来备受关注;酰氯法、Steglich法、酶法等成功用于Res芳香酯、Res长链脂肪酸酯、Res中链脂肪酸酯和Res长链脂肪酸酯的合成,并利用硅胶柱层析法、制备液相和重结晶法进行纯化,薄层层析法、傅里叶变换红外光谱(Fourier transform infrared spectra,FTIR)法、核磁共振及高效液相色谱法对Res酯进行表征,取得了重要的研究进展,但鲜见相关文献对其进行系统综述。本文重点综述了国内外Res酯的性质、Res酯化改性方法、分离纯化技术及表征方法的研究现状和最新进展,以期为Res酯的定向合成及应用提供方法和技术支撑。
1 Res酯的性质与作用
1.1 Res性质
Res化学名称为3,4’,5-三羟基二苯乙烯,分子式为C14H12O3,相对分子质量为228.25[1-2]。常温下为白色针状晶体,难溶于水和油,见光易分解,易溶于多数有机溶剂(如甲醇、乙醇、丙酮、乙醚、乙酸乙酯、氯仿等)[3]。在自然界中以顺式、反式Res和顺式、反式Res苷4 种形式存在,熔点为256~257 ℃,当温度高于280 ℃时开始热分解成苯酚和间二苯酚,超过425 ℃时氧化和热解生成一氧化碳和二氧化碳[4]。现有研究已证明Res在植物中主要以反式构象存在,反式Res的活性远高于顺式Res[5],且反式Res中4’-OH的活性>3-OH的活性>5-OH的活性,4’-OH为主要活性位点,由于4’-OH的键长最长,容易断裂,反应活性最好,即发生酯化反应时4’-OH最先参与反应[6]。这些活性的—OH在不同的条件下会与FeCl3(暗绿色)、氨水(红色)、醋酸镁的甲醇溶液(粉红色)等发生显色反应[7]。
1.2 Res酯的性质
Res的3 个羟基在一定条件下与羧酸、酰氯或酸酐等发生酯化反应生成单酯、二酯和三酯(图1),根据不同的原料比例和反应条件会生成不同的酯化产物。经过酯化的Res难溶于水,但其脂溶性大大提高,并且脂溶性随着脂肪酸链的延长而增加,随着脂肪酸不饱和度的增加而降低[8]。目前,酯化改性的Res主要是Res三酯,如Res芳香酯、Res长链脂肪酸酯、Res中链脂肪酸酯及Res短链脂肪酸酯,其中Res芳香酯比例最大。现有研究发现Res磺酸酯与乙酰阿魏酸酯为黄色固体,其余Res芳香酯为白色固体;Res长链、中链与短链脂肪酸酯大部分为黄色固体,脂肪酸烷基数目越多,与羟基发生反应的能垒就越高,酯化越困难,经过酯化后的Res由于部分羟基被长链烷烃取代,其分子间氢键作用力减小,熔点降低,且随着取代基团数量的增多而逐渐降低[9]。尽管Res酯化后活性的羟基被取代,但仍表现出良好的抗氧化活性[10]和稳定性。当改性变成Res三酯时,由于其结构中无酚羟基,故不能发生显色反应(图1)。
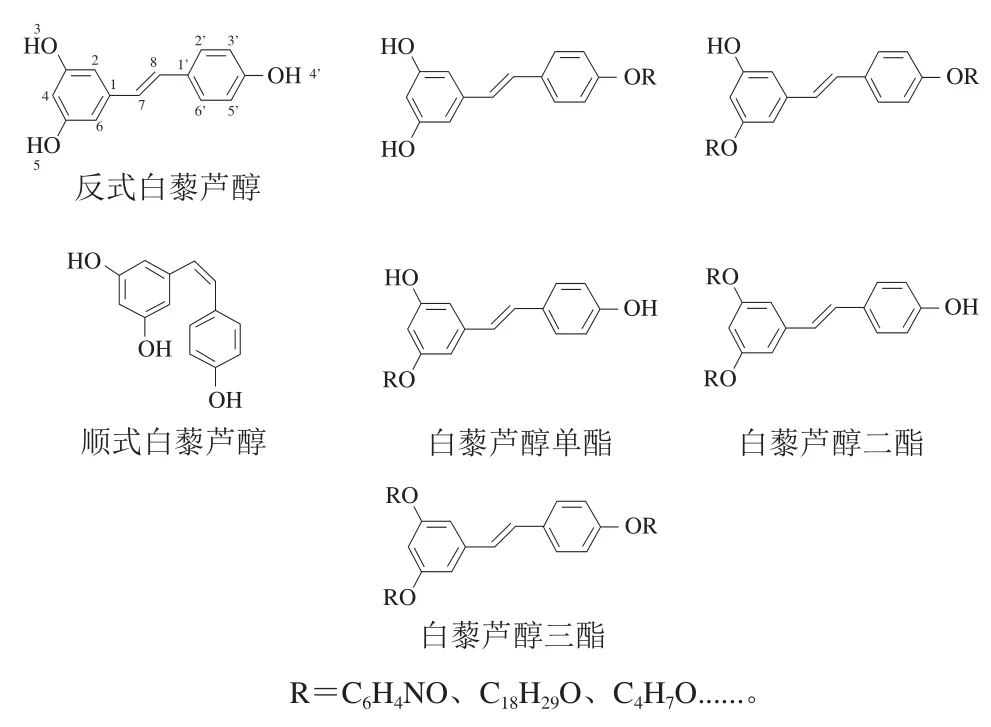
图1 白藜芦醇和白藜芦醇酯分子结构式Fig. 1 Molecular structures of resveratrol and resveratrol esters
Res酯化改性既提高了Res的脂溶性和稳定性,也降低了不饱和脂肪酸的氧化速率,对Res的高效利用具有重要实际意义,但对不同结构(单酯、二酯和三酯)、不同种类(芳香酯、脂肪酸酯等)Res酯的物理和化学性质研究较少,亟待系统地研究从而进一步拓展其应用范围。
1.3 Res酯的作用
关于Res的作用已有较多研究报道,且Res被证实具有抗炎[11-13]、降脂[14]、抗氧化[15-17]、抗肿瘤[18-20]和保肝[21-22]等作用。黄鹏等[23]研究发现Res烟酸酯对10%蛋清诱导大鼠足肿胀和二甲苯诱导大鼠耳肿胀的抑制作用优于Res,并且还可明显降低75%蛋黄液引起的高脂血症模型血清中甘油三酯和血清总胆固醇浓度升高。Res磺酸酯也具有较好的抗氧化作用,能够有效清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和2,2’-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2’-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基,同时还能显著抑制人体肺癌细胞A549生长,起到抗肿瘤作用,且其作用效果优于Res[24]。现有研究也发现Res桂皮酸酯能显著降低CCl4引起的小鼠血清中谷丙转氨酶、天冬氨酸氨基转移酶含量,从而起到保肝作用[25]。Res酯化后抗氧化活性随着取代数目增加而降低,依次为Res>Res-3-c(单酯)>Res-4’-c(单酯)>Res-3,4’-c(二酯)>Res-3,4’,5(三酯),三酯因为不含羟基所以几乎没有任何抗氧化活性,其中4’-OH是决定Res抗氧化性最重要的基团[8]。
从以上研究分析可知,Res酯化后生物利用度显著提高,且不同种类、不同结构的Res酯具有不同的活性和作用,且其在抗炎、抗肿瘤等方面的作用优于Res,但有关Res酯的作用研究主要集中在不同种类的活性对比上,体内的作用机制尚不清楚。此外,相关研究多集中于Res三酯,尤其缺乏对Res单酯和Res二酯的研究,且酯化取代位置、数量和羧酸种类的不同对其功效有何影响仍不清楚,不同酯化产物是否具有协同或者拮抗作用也亟待研究。
2 Res的酯化改性方法
Res含有3 个酚羟基,具有较高的生物活性,但其具有熔点高、脂溶性和水溶性差等特性导致生物利用度低,直接应用到食品中易结晶析出,特别是在Res含量高的体系中,严重影响食品品质。因此,为了增加Res的稳定性和脂溶性,降低熔点,提高其生物利用度,Res的酯化改性越来越受到国内外研究者和企业的高度关注。目前Res的酯化改性方法有化学改性法和酶催化法(表1)[26]。
2.1 化学改性法
2.1.1 酰氯酯化法
酰氯酯化法是将位阻大、难以直接酯化的羧酸先制成酰氯,再与Res发生酯化反应的一种方法,也是目前最常用的方法,酰氯的酯化能力比相应的羧酸和酸酐都强,但是改性路线复杂冗长,副产物较多。目前使用的酰氯试剂有氯化亚砜、草酰氯、五氯化磷和三氯化磷等,最常用的是氯化亚砜,但其在反应过程中会释放出氯化氢和二氧化硫等酸性气体,易对环境造成一定的污染。近年来,由于草酰氯更绿色环保,其逐步开始替代氯化亚砜[31]。由于Res难溶于水,为了增加其溶解度,常用丙酮、二氯甲烷(dichloromethane,DCM)和乙酸乙酯作为溶剂进行Res的酯化改性,其中丙酮的使用较多。此外,催化剂也是酯化改性Res的关键因素,现有文献已报道三乙胺、DMAP和吡啶等有机碱被用作酰氯酯化法的催化剂,为了达到最佳酯化率,应根据羧酸的不同选择合适的催化剂,虽然使用较多的是三乙胺,但是吡啶类催化剂可以解决反应结束时体系容易变黑色黏稠状的问题[25]。
酰氯酯化法的优化反应条件:反应物(Res、酰氯)的物质的量比1∶2~1∶3.5、反应温度25~65 ℃、反应时间2~5 h,产率可达78%~92%,但收率只有10%~35%。刘耀武等[29]在用三乙胺作催化剂的基础上优化了采用DMAP催化制备Res烟酸酯的工艺,将反应时间由4~6 h缩短至1.5~2.0 h[39]。有研究以草酰氯作为酰化试剂,三乙胺为催化剂,DCM为溶剂,在冰浴下制备了Res乙酰水杨酸酯和Res肉桂酸酯、Res亚麻酸酯、Res花生四烯酸酯和Res DHA酯,收率分别达到了16.0%、16.0%、10.0%、12.6%和10.2%[40]。最近一项研究采用三乙胺为催化剂,丙酮为溶剂,在室温下将Res和丙烯酰氯(物质的量比为1∶3.5)反应4 h,制备了一种新型Res丙烯酸酯,收率达30.2%[27]。

表1 白藜芦醇的酯化改性方法Table 1 Esterification modification methods of resveratrol
通过以上分析可知,催化剂在酰氯酯化法中至关重要,催化剂活性低或不添加催化剂很难得到酯化产物;同时发现反应条件对产物的种类起关键作用,但仅通过调控反应条件无法实现精准定向酯化。酰氯酯化法的机理是先利用羧酸与氯化亚砜或草酰氯反应生成相应的盐,再脱去二氧化硫或一氧化碳和二氧化碳生成相应的酰氯,接着与Res在DMAP、三乙胺等催化剂的作用下生成Res酯(图2)。可见,要实现Res的定向酯化可利用溴化苄和三异丙基硅基三氟甲磺酸酯(trifluoromethanesulfonic acid triisopropylsilyl ester,TIPS-OTF)等基团选择性保护酚羟基,待酯化结束后脱去保护基团即可实现定向酯化,但相关研究还需进一步实验验证。
2.1.2 Steglich酯化法
Steglich酯化法是以DCC或1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(1-ethyl-3-(3-dimethylaminopropyl)carbodiimide,EDC)为偶联试剂的酯化方法,该方法具有反应条件温和且改性路线相对简单等优点,但反应时间比酰氯法长,且催化剂价格昂贵。已有的研究采用丙酮、DCM、三氯甲烷和N,N-二甲基甲酰胺(N,N-dimethylformamide,DMF)作为溶剂,DCC与EDC作为良好的酯化缩合剂(活化羧酸),脱水促使反应正向进行。其中,应用最多的缩合剂是DCC,DCC具有价格低廉、无需保护Res酚羟基等优势,但反应之后会生成N,N’-二环乙基脲(N,N’-dicyclohexylurea,DCU),难以去除干净(图3)[35]。研究发现以Res和生物素(VH)为原料,DCC为缩合剂,DCM和DMF(9∶1,V∶V)作为溶剂,在低温(4 ℃)下制备Res生物素单酯,得率达31%[35]。王鑫等[34]以丙酮为溶剂,采用DCC与EDC作为缩合剂由DMAP催化Res与2-喹啉羧酸制备Res喹啉酸酯,产率最高可达84.1%和72.3%。Peng Wei等[41]以乙酸酐和TIPS-OTF作为保护剂,EDC-DMAP为缩合剂,以较高收率(51%~63%)定向酯化得到4’-Res布洛芬酯。
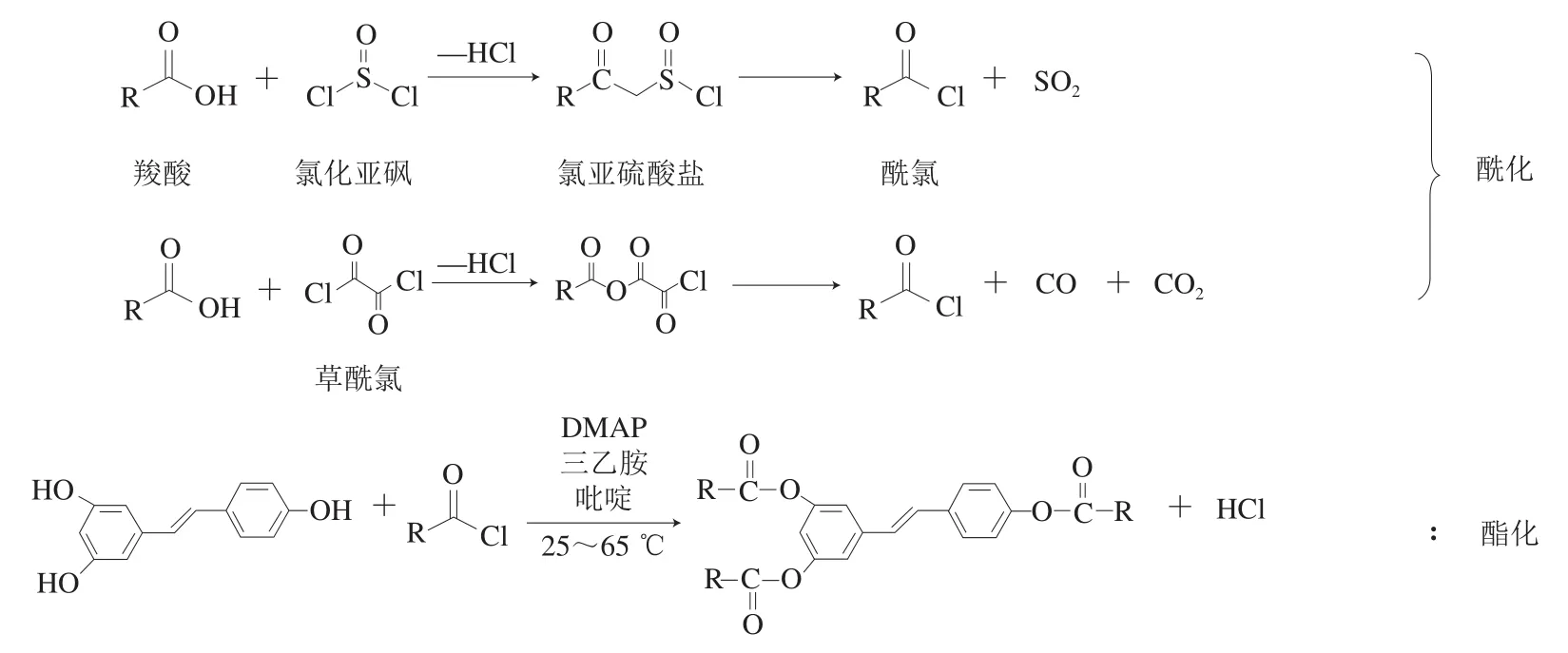
图2 酰氯酯化改性法机理Fig. 2 Reaction routes for acid chloride esterification modification method

图3 Steglich酯化法机理[35]Fig. 3 Reaction routes for Steglich esterification method[35]
Steglich酯化法机理与酰氯法类似,都是先用DCC或EDC将位阻大的羧酸活化为活性酯,接着与Res在DMAP的催化作用下生成Res酯(图3)。早期的Steglich酯化法仅用DCC作缩合剂,经过改进后采用EDC作缩合剂,反应后副产物仅需酸性和碱性溶液洗涤即可除去,得到纯酯产物,省去了色谱纯化。采用Steglich酯化法最关键的是无水体系,有水会造成反应不充分。目前Steglich酯化法可实现定向酯化(图3),但是相关理论研究较为匮乏。
2.1.3 其他方法
为了提高酯化率,微反应器酯化法也用于Res的酯化改性。李万梅等[42]将Res的氢氧化钠溶液与乙酸酐以1∶3~1∶6的物质的量比混合后置于微反应器中反应1~10 min(20~40 ℃),连续化制备Res三乙酸酯,产率达45%~95%(图4)。与酰氯酯化法和Steglich酯化法相比,该方法避免了使用大量吡啶和三乙胺等催化剂产生的三废,不仅减少了环境污染,还降低了反应温度并缩短了反应时间,提高了产品收率和纯度,但这种改性方法设备相对昂贵。在该反应中,若将乙酸酐置于二氯甲烷、二氯乙烷和正己烷等有机溶剂中可进一步提高Res酯的产率,但相关研究仍待加强。本课题组采用N,N’-羰基二咪唑(N,N’-carbonyldiimidazole,CDI)活化共轭亚油酸,成功制备Res共轭亚油酸酯,酯化率达96.87%(图5),CDI活化羧酸后副产物咪唑易溶于水,仅需水洗就可得到高纯度的Res酯,且无有毒有害气体产生,酯化效果优于EDC,极具发展潜力。
2.2 酶催化法
酶作为生物催化剂,与化学催化剂相比,作用条件温和,具有更好的选择性、能控制酯化的位置和数量、副反应少、产物易分离、纯化步骤相对简单等优点。常用的酶有诺维信脂肪酶435、脂肪酶TL IM、RM IM和PLG等,但存在成本过高、难以实现工业化生产等问题,当前Res酶法酯化还处于实验室研究阶段[43],溶剂一般选用甲基叔丁基醚和离子液体。传统的酶法是在水介质中催化反应,近年来非水介质催化无论在理论上还是在应用上都取得较大进展,为酶法提供了更加广阔的发展前景[43]。

图5 CDI催化酯化改性法机理Fig. 5 Reaction routes for CDI-catalyzed esterification modification method
酶法的一般反应条件:反应物的物质的量比(n(Res)∶n(羧酸))1∶6~1∶12,溶剂与Res体积-物质的量比1∶0.026~1∶0.044(L/mol),脂肪酶与Res质量-物质的量比100∶1~150∶1(g/mol),反应温度20~60 ℃、反应时间24~96 h下,酯化率达37.6%~41.7%,纯度80.3%~87.8%。周大勇等[36]将Res与二十二碳六烯酸(docosahexaenoic acid,EPA)溶于甲基叔丁基醚中,利用南极假丝酵母脂肪酶催化制备了Res EPA酯。Marian[37]首先采用酰氯法制备了Res异丁酸三酯与Res己酸三酯,然后在南极假丝酵母脂肪酶的作用下,经过40 ℃、24 h反应后得到了Res异丁酸二酯与Res己酸二酯,产率可达到25%和41%。不同脂肪酶对Res不同位置羟基酯化选择性不同,其中诺维信脂肪酶435酯化位点在4’-OH,脂肪酶QLG酯化位点在3-OH,脂肪酶PLG在3-OH与4’-OH选择性相同,脂肪酶TL IM在3-OH选择性大于4’-OH,脂肪酶RM IM在4’-OH选择性大于3-OH[44]。
综上所述,酶法的最大优点是能实现定向酯化,但其反应时间较长且产率较低;酶的活性在酶法酯化反应过程中也至关重要,酶的活性低或失活会导致反应难以进行,因此需要控制反应体系的温度、pH值等使酶处于最适酶活下,才能达到最佳酯化率;酶菌种的筛选及反应条件的优化还有待进一步研究。酶法酯化改性机理如图6所示。

图6 酶法酯化改性机理Fig. 6 Reaction routes for enzymatic esterification modification
3 Res酯的纯化方法
Res酯化改性得到的粗产物一般纯度低,还混有少量的Res和脂肪酸,而药品、食品等行业所需的是高纯度Res酯,因此需进一步分离纯化以提高其价值。到目前为止,Res酯纯化的主要方法有硅胶柱层析法、制备液相色谱法和重结晶法,为了获得更好的纯化效果,往往需要多种纯化方法复配使用。
3.1 硅胶柱层析法
硅胶柱层析法具有绿色环保、操作简单等优点,在Res酯的分离纯化中有很高的应用价值。酯化改性的Res粗产物中常常含有游离的Res、Res单酯、二酯、三酯和过量羧酸,硅胶柱层析法可将其分离,但其分离效率低且耗时长,不适用于工业化生产,而且整个过程还需要薄层色谱法进行辅助检测。其常用的洗脱液为正己烷-乙酸乙酯、石油醚-乙酸乙酯和正己烷-乙酸乙酯-甲酸等。Hu Xiaopei等[30]以正己烷和乙酸乙酯(15∶1~3∶1,V/V)为洗脱液分离得到了Res辛酸单酯、二酯和三酯。冯海燕[9]以正己烷-乙酸乙酯(5∶4,V/V)为洗脱溶剂,分离得到了Res月桂酸酯。
不同的Res酯需要的洗脱溶剂类型和体积比不同,其洗脱条件应根据目标产物的性质进行优化,但由于硅胶柱层析法粒径(200~300 目)相比高效液相色谱柱粒径(3~10 μm)大上百倍,有时无法将Res酯的5 种结构完全分离,若要获得单一目标物,需考虑分离效率更高的方法。
3.2 制备与半制备型液相色谱法
液相色谱法根据应用方向分为分析型、制备和半制备液相色谱法[45]。制备与半制备液相色谱法相比于其他纯化方法分辨率和成本高,常用于样品纯化的最后阶段。制备与半制备液相色谱由于柱长(前者20~70 cm,后者15~50 cm)、柱内径(前者高于20 mm,后者低于10 mm)和流速不同,两者上样量不同,制备型上样量更大(0.1~100.0 g),但是没有半制备型(<100 mg)灵敏[46]。在Res酯的纯化中,无论是制备液相色谱法还是半制备液相色谱法常用的色谱柱都为C18。常用的流动相为乙腈-水和甲醇-水[47]。以丙酮-水作为流动相(60∶40或55∶45,V/V)可有效分离Res月桂酸单酯与二酯[9]。Hu Xiaopei等[30]以甲醇-水为流动相,在306 nm紫外波长下,采用制备高效液相色谱法分离纯化得到了Res辛酸单酯和二酯。制备和半制备液相色谱法是目前最成熟的一种纯化方法,经纯化后样品纯度可达95%以上,但是其缺点也很明显,如设备昂贵、运行费用较高、溶剂消耗大、无法避免有毒溶剂的使用等。在现有研究中,制备和半制备液相色谱法还无法将Res单酯、二酯和三酯完全分离,在色谱柱选择和分离条件方面还有待优化。
3.3 重结晶法
重结晶法是利用结晶过程中不同物质溶解度不同而将混合物分离提纯的方法。当Res酯纯度较高时(杂质质量分数低于5%)宜采用重结晶法。重结晶法操作简单、纯度高、适合工业化生产,结晶溶剂的选择也尤为重要。常用的结晶溶剂有甲醇、石油醚-乙酸乙酯、无水丙酮和氯仿-乙醇,结晶溶剂从毒性极大的氯仿逐步向毒性低的丙酮和甲醇转变。现有研究以氯仿-乙醇作为结晶溶剂,采用重结晶法纯化Res烟酸酯,得到白色固体[29]。最新研究将Res月桂酸酯经硅胶柱层析和半制备液相色谱分离,再以甲醇重结晶制得高纯度的Res烟酸酯,纯度可达99.3%[33]。
由于羧酸的种类和结构不同,酯化改性后Res的物理化学性质有较大差异,在进行分离纯化时,要依据酯化产物溶解度、纯度要求以及不同改性方法引入副产物种类的不同来选择合适的纯化方法。
4 Res酯的表征方法
将Res酯分离纯化之后,需要对其进行表征来分析产物类型、纯度、分子质量和分子式等。常用的表征方法有薄层色谱法(thin-layer chromatography,TLC)、FTIR、高效液相色谱法(high performance liquid chromatography,HPLC)、高效液相色谱-质谱联用(high performance liquid chromatography-mass spectrum,HPLC-MS)和核磁共振(nuclear magnetic resonance,NMR)等。
4.1 薄层色谱法
TLC是利用同一吸附剂(通常选硅胶)对不同物质的吸附能力不同,从而实现对样品中不同组分的有效分离,根据展开后比移值(Rf)和斑点数目判断是否有新物质生成。酯化改性的Res一般包括5 种取代产物,需要经TLC分析,来判断产物类别,监测反应进程[9]。Res含有3 个-OH,极性较大,酯化改性后极性减小,并随着取代基数量的增多而减小(Rf随取代基数量的增多而增加)。目前,常用的展开剂组合有石油醚-乙酸乙酯和正己烷-乙酸乙酯,通常会加入少量甲酸或乙酸防止斑点拖尾,其中最常用的是石油醚-乙酸乙酯。现有报道采用TLC分离Res月桂酸酯,比较了以石油醚-乙酸乙酯-甲醇-乙酸和正己烷-乙酸乙酯-乙酸作为展开剂的分离效果,后者分离效果明显优于前者,当以正己烷-乙酸乙酯-乙酸(10∶7∶1,V/V)作为展开剂时分离效果最好[8]。Oh等[10]改性得到Res DHA酯,在薄层色谱板上显示出两种单酯、一种二酯和一种三酯,但是从HPLC-MS谱图看出有两种单酯和两种二酯,并未检测到三酯,说明仅仅采用一种检测方法无法准确判断出产物类别,要多种检测方法共同分析。
该方法虽然简单,但是选择合适的展开剂和比例使酯化改性后的粗产物全部分离是该方法的难点,即使产物与杂质完全分离,也无法达到将已分离产物大量回收的目的。本课题组以正己烷-乙酸乙酯-冰醋酸按10∶8∶0.1(V∶V∶V)的比例作为展开剂,采用TLC分析制备的Res共轭亚油酸酯,可将Res、Res单酯、共轭亚油酸、Res二酯和Res三酯完全分离(图7)。

图7 白藜芦醇共轭亚油酸酯的TLC图Fig. 7 Thin layer chromatogram of resveratrol conjugated linoleic acid ester
4.2 傅里叶变换红外光谱法
红外光谱在食品领域已经应用了几十年,直到20世纪70年代,随着科技的进步,FTIR再次激起研究者的兴趣,它可以提供化学键和官能团的特征频率,FTIR与传统红外光谱相比提高了谱图分辨率,降低了谱峰宽度,大大提高了仪器灵敏度和准确性,具有样品用量少、检测迅速、准确度高和无需样品前处理等优势[48]。利用FTIR可根据吸收峰来快速判断是否有Res酯生成,扫描范围一般在4 000~600 cm-1。对于Res,在3 500~3 000 cm-1有明显的羟基吸收峰,如果有Res酯生成,其羟基吸收峰强度会明显减小,并且会在1 740 cm-1和1 170 cm-1附近产生明显的酯基(分别为C=O和C-O)吸收峰,但无法确定具体是Res分子哪个羟基参与酯化反应,如果在3 000 cm-1以上没有强峰,说明Res 3 个羟基都参与反应[40]。利用FTIR只能判断酯化反应是否发生,要想准确判断酯化位置,需借助核磁进一步分析。
4.3 核磁共振法
NMR波谱法研究原子核对射频辐射的吸收,是对物质定性分析最强有力的工具之一,NMR近年来被广泛应用于Res和Res酯的相关分析,利用核磁可以判断Res分子哪个羟基发生反应。Res的H NMR化学位移在δ6.1~9.5[49],C NMR化学位移在δ100~160[50]。常用的检测溶剂有氚代二甲基亚砜、氚代氯仿(CDCl3)、氚代乙腈(CD3CN)、氚代丙酮和氚代甲醇(CD4O)。仪器兆赫数从之前的400 MHz逐渐升级为600 MHz,大大提高了谱图的分辨率。Res的核磁氢谱从低位移到高位移特征吸收峰依次是4’位、35位、2’6’位、CH=CH、3’5’位、26位、4位[51]。目前Res碳谱的相关研究较少。当酯化改性后,取代位置处-OH的吸收峰会消失,其他位置的吸收峰会发生微小的偏移,可准确判断酯化位点。但是所检测的样品需要把单酯、二酯和三酯分离,纯度要尽可能高,否则谱图杂峰过多,不利于解析。
4.4 高效液相色谱法
HPLC是检测Res及Res酯常用的方法,在低温下即可将Res与Res酯分离,可用来监测反应进程[52]。常用的色谱柱为C18,常用的流动相有乙腈-水、甲醇-乙腈-水,近年来开始用更环保的甲醇-水、丙酮-水来代替乙腈,常加入醋酸、甲酸等酸性改性剂来调整峰型,获得最大分离度。检测波长一般在306 nm,常用的检测器有紫外检测器(ultraviolet detector,UV)和二极管阵列检测器(photo-diode array,PDA),UV只能获得单一波长的色谱图,而PDA可得到某一波长范围内所有波长色谱图,但是其灵敏度比UV低一个数量级。利用HPLC可计算Res酯的纯度和酯化率,并且可以判断产物类型。Res极性大,保留时间较短,如果制备单酯、二酯和三酯,保留时间依次延长。现有研究以丙酮-水作为流动相、UV检测器,采用HPLC依据峰数目来判断所制备Res月桂酸酯的类别,分离效果良好[9]。最新报道以乙腈-水作为流动相,采用PDA检测器来检测3 种Res辛酸酯在口腔、胃相和肠道的变化情况,研究了不同消化条件对酯键的影响[30]。HPLC-MS是在液相色谱基础上发展起来的新技术,与HPLC相比选择性更好、灵敏度和准确度更高,既能检测单一成分,又能检测混合物,既能定性,又能定量,其效果明显优于PDA和紫外检测器,最重要的是质谱具有强大的结构鉴定能力,可以根据分子质量将未知峰准确判断出来[53]。冯磊等[35]采用HPLC-MS,以甲醇-水-1%乙酸为流动相,检测得到Res生物素酯的纯度>90%,相对分子质量为454.2。在分离Res酯时,往往会遇到单酯或二酯无法完全分离。为了更好地分离Res单酯、二酯和三酯,往往需要加大流动相中水相的比例,因为有机相的比例过高会导致Res酯难以停留在柱中。
5 结 语
虽然我国对Res酯的相关研究较少、起步较晚,但近年来研究数量逐渐增加,尤其是定向制备不同结构的单酯、二酯和三酯已成为未来研究的方向和攻克的技术难点。传统化学法虽然技术成熟、产率高,但存在产物复杂、纯化困难和环境污染等问题;酶法虽然环保、副产物少、能耗较低,但酶价格过高且活性较难保持。由于Res的酚羟基易受芳环影响,亲核性降低,发生酯化反应比醇困难,因此酯化改性工艺亟待在以下3 个方面进行深入的研究:1)寻找绿色高效的催化剂;2)研发低成本且对环境要求低的酶制剂;3)将微波、超声等技术应用于Res的酯化改性。从分离纯化角度看,需进一步探索高速逆流色谱、超临界反溶剂萃取、分子蒸馏等现代分离技术以实现不同结构Res酯的高效纯化。在表征方面应根据不同结构Res酯的性质来选择适合的检测方法,单一的检测方法很难满足深入研究的需要,两种及以上方法的组合、联用是未来研究趋势;超高效液相色谱(ultra performance liquid chromatography,UPLC)和UPLC-四极杆-飞行时间质谱等新的结构表征方法由于分离度好、灵敏度高、分析时间短,也可用于Res酯的分析。总之,随着改性、纯化、检测技术的不断发展,越来越多的先进仪器和创新技术将会应用到Res酯的研究,以期开发出低成本、高纯度的Res酯产品,不仅能实现Res酯的高值化利用,同时还能满足市场需求。
