生命早期肠道菌群的建立和变化及对婴儿健康的影响
2022-04-01梁胜男赵丽娜陈庆学史佳鹭岳莹雪关嘉琦李柏良霍贵成
梁胜男,赵丽娜,陈庆学,赵 莉,史佳鹭,岳莹雪,关嘉琦,李柏良,霍贵成
(东北农业大学 乳品科学教育部重点实验室,黑龙江 哈尔滨 150000)
人类肠道中聚集着种类丰富、数不胜数的微生物群落,尤其是结肠中有高达1011~1012CFU/mL的微生物[1]。肠道微生物具有发酵不可消化碳水化合物、合成和降解维生素、维持氮平衡等功能[2]。另外,肠道菌群对宿主整个生命周期的健康具有重要作用,通过对肠道菌群动态变化的检测,可以侧面反映出宿主的发育轨迹。大量研究表明,婴儿肠道菌群对婴儿的发育和免疫系统的形成密切相关,生命早期肠道菌群的结构和相对丰度影响日后发生疾病的概率[3-5]。因此,探索肠道菌群在生命早期的形成和变化成为当务之急。新生儿生命的前两年,微生物种类和相对丰度处于动态变化的过程,直到2 岁时形成类似于成人的肠道菌群结构,且基本处于稳定状态[6]。那么,生命之初肠道菌群是如何建立的?生命之初肠道菌群的动态变化是由何种因素引起的?此外,不同的变化会对婴儿的发育和健康产生何种影响?本文以解答上述3 个问题为目标,详细阐述早期肠道菌群的建立过程以及影响因素,提出在生命早期可操控肠道菌群发育的策略,为从肠道菌群角度影响婴儿生长发育提出理论参考。
1 生命早期肠道菌群的定植和发展
1.1 出生前微生物的定植
过去的研究认为,婴儿在出生前所处环境是无菌的,分娩时首次接触到产道或环境中的微生物是婴儿肠道菌群定植的来源[7],但近年来的研究使这一理论受到了挑战。研究人员分别在羊水、胎盘和胎粪中检测到微生物。Collado等[8]在羊水中检测到以多样性低、丰富度低为特征的微生物结构,且主要以变形菌门(Proteobacteria)为主。变形菌门也是胎盘中的优势菌,相对丰度可超过90%[9],利用二代高通量测序技术在足月健康婴儿胎盘中还检测到乳杆菌属(Lactobacillus)、丙酸杆菌属(Propionibacterium)及肠杆菌科(Enterobacteriaceae)[10]。研究人员认为虽然肠上皮细胞可以防止微生物进入循环系统,但肠上皮细胞位移后,树突状细胞可以穿过肠屏障从肠腔中吸收微生物,随着血液的运输而被运送到全身,使胎盘获得微生物[11]。新生儿肠道菌群从母亲获得,这种垂直传播更有利于微生物群之间的互利共生,母体胎盘和婴儿胎粪的微生物种群十分相似[12],Hansen等[13]对健康足月婴儿胎粪进行检测发现,胎粪中以肠杆菌科为主,以肠杆菌、双歧杆菌(Bifidobacterium)、肠球菌(Enterococcaceae)和普雷沃氏菌属(Bacteroides-Prevotella)最为普遍。郭贺[14]对胎粪的检测也得出了类似的结果,发现了以类杆菌属(Bacteroides)、双歧杆菌属(Bifidobacterium)、梭菌属(Clostridium)、链球菌属(Streptococcus)和韦荣球菌属(Veillonella)为优势菌的菌群结构。通过粪菌移植给小鼠带有特异性标记的粪球菌(Coprococcus)菌株,可以从子代小鼠胎粪中分离出该菌株[15]。尽管越来越多的证据表明,出生前肠道菌群就可能开始定植,但目前的技术对低丰度微生物的检测仍存在限制,对“子宫内定植”这一理论还有待进一步证明。
1.2 出生后微生物群的发展
新生儿期和婴儿期是肠道菌群建立的重要时期。婴儿肠道微生物群主要以放线菌(Actinobacteria)、拟杆菌(Bacteroidetes)、厚壁菌(Firmicutes)、变形菌和疣微菌(Verrucomicrobia)5 个门组成[16]。新生儿肠道内氧气较多,主要由需氧菌和兼性厌氧菌定植,如大肠杆菌(Escherichia coli)、葡萄球菌(Staphylococcus)、链球菌(Streptococcus)等,待其耗尽肠道内氧气,肠内pH值降低,则厌氧菌(如双歧杆菌属和拟杆菌属)开始定植[17]。新生儿肠道内,首先能够检测到葡萄球菌属和肠球菌属(Enterococcus),古细菌也可以在出生后的前一个月被检测到,刚出生时噬菌体的多样性也大于出生12 个月时噬菌体的多样性[18];以后随着月龄增加,婴儿肠道内逐渐被双歧杆菌属、拟杆菌属和梭菌属占据,数量持续增加,并成为肠道内的优势菌[16]。婴儿的肠道微生物一直处于动态的、非随机的变化过程,在此期间,各微生物群之间相互影响,同时也会受到母亲、环境、分娩方式等因素影响,直到两岁形成类似于成人的、稳定的肠道菌群结构[6]。
2 影响婴儿肠道菌群的因素
2.1 孕龄
新生儿妊娠期不满37 周,则被判定为早产。早产儿会面临肠道发育不成熟、喂养不耐受[19]等问题,甚至在成年可能出现认知障碍的缺陷[20]。且早产儿一般需要接受大量的抗生素和药物治疗,甚至接受人工或胃肠外喂养,这些都会成为婴儿肠道微生物定植和发展的干扰因素。与足月儿相比,早产儿肠道微生物定植有延迟和异常现象[21],其定植模式主要是变形菌门相对丰度过高[22];另外,早产儿肠道微生物多样性低,且后续增长率显著低于足月儿[16]。除了组成的差异外,早产儿肠道微生物发育的轨迹也与足月儿有所不同,早产儿出生后的前6 周,肠道内大肠杆菌、志贺氏菌(Escherichia-Shigella)、葡萄球菌属丰度逐渐下降,而克雷伯菌属(Klebsiella)丰度却增加[23-24];因克雷伯菌属的定植易导致婴儿发生肺炎,早产儿出生一周后克雷伯菌属的丰度显著高于出生后一天,纳入调查的53 例早产儿有24.53%发生肺炎克雷伯菌感染[25]。某些受到早产影响的代谢途径还会造成早产儿各种短链脂肪酸含量的显著差异,早产儿粪便中与脂质代谢相关的基因频率较高,与能量代谢和辅因子合成相关基因频率却相对较低[26]。
2.2 分娩方式
分娩方式是导致足月儿肠道菌群差异的主要原因,母体阴道主要被链球菌(Streptococcus)、乳杆菌和念球菌(Candidaspp.)定植,医院环境和母亲及医护的皮肤表面则更多的是艰难梭菌(C. difficile),因此,不同分娩方式婴儿肠道菌群结构不同[27-28]。不同分娩方式婴儿粪便的测序结果显示,顺产婴儿粪便中双歧杆菌属、乳杆菌属、拟杆菌属和副杆菌属(Parabacillus)的相对丰度较高,而剖宫产婴儿粪便中克雷伯菌属的比例较高;测定两者代谢产物发现,顺产婴儿粪便中含有大量的DL-去甲缬氨酸、胸腺嘧啶及DL-瓜氨酸,而剖宫产婴儿粪便中则是反式脂肪酸、顺乌头酸及D-麦芽糖含量较高,据推测,上述差异受到分娩方式的影响[29]。杨莉等[30]的研究表明,顺产婴儿与剖宫产婴儿肠道优势菌组成相同,但顺产婴儿肠道内放线菌比例更高,剖宫产婴儿肠道内则是厚壁菌占优势;在科水平上,顺产婴儿以链球菌科(Staphylococcaceae)为优势菌,剖宫产婴儿以梭菌科(Clostridiaceae)为优势菌。剖宫产还会对婴儿成年期的健康造成持续的影响,主要表现在各种细胞因子浓度的降低以及免疫和代谢疾病的高风险,虽然由于分娩方式造成的婴儿肠道微生物差异会逐渐缩小,但即便成长到儿童时期,剖宫产婴儿与顺产婴儿肠道菌群始终存在差异[31]。
2.3 喂养方式
造成婴儿肠道微生物差异的另一个主要因素是喂养方式,母乳喂养婴儿肠道微生物多样性低于配方粉喂养婴儿,但双歧杆菌属的数量却显著高于配方粉喂养婴儿[32]。经检测,母乳中的细菌主要是链球菌属和葡萄球菌属,其次是肠杆菌科的细菌[33]。此外,母乳中含有的生物活性物质,如低聚糖、细胞因子、免疫球蛋白和蛋白质也会直接影响婴儿肠道菌群的定植[34]。母乳喂养可以部分缓解由剖宫产带来的婴儿肠道菌群紊乱[35]。配方粉中碳水化合物的多样性致使定植在肠道中的微生物多样性增加,配方粉喂养婴儿粪便中丙酸盐和丁酸盐含量更高,配方粉喂养婴儿肠道微生物组成和结构也会更早地向成人肠道微生物组成和结构转变[36-37]。一项在中国东北地区的调查发现,母乳喂养婴儿肠道内含有丰富的双歧杆菌和乳酸菌;混合喂养婴儿肠道内主要是韦荣球菌属和克雷伯菌属;配方粉喂养婴儿肠道内则含有较多的拟杆菌和布拉式酵母菌(Saccharomyces boulardii)[38]。
固体食物的引入以及母乳向配方粉的转变也会导致婴儿肠道菌群的变化,新的营养物质的补充导致肠道微生物α多样性增加,厚壁菌和拟杆菌取代变形菌和放线菌的位置,成为新的优势菌门,此时短链脂肪酸总量增加,丁酸盐含量显著上升[6,39-40]。固体食物的引入导致植物源多糖摄入的增加,此时双歧杆菌的组成则向能够适应植物源多糖代谢的方向转变,如长双歧杆菌(Bifidobacterium longum)和青春双歧杆菌(Bifidobacterium adolescentis);而两歧双歧杆菌(Bifidobacterium bifidum)则将对母乳低聚糖(human milk oligosaccharides,HMOs)的代谢能力转向对黏蛋白的降解[41]。蛋白质摄入量的增加造成拉克逊酵母(Laxonianyeast)丰度的增加和双歧杆菌丰度的减少,高纤维的摄入则与普雷沃氏菌属的变化有关[42]。固体食物的添加也是婴儿肠道微生物结构向成人肠道微生物结构转变的开始,微生物群更加复杂以适应成人饮食中的植物源多糖,更有利于宿主和微生物之间的互利共生,直到两岁时形成类似于成人的稳定的肠道微生物结构[6]。
2.4 母婴摄入抗生素
抗生素的摄入会造成婴儿肠道菌群的紊乱,母亲摄入抗生素也会对婴儿的肠道菌群产生一定影响。母亲分娩及哺乳期接受抗生素治疗会导致婴儿肠道菌群多样性降低,这种影响可以持续到1 岁时,抗生素的使用导致婴儿肠道内肠球菌丰度增加,双歧杆菌、拟杆菌及乳杆菌丰度降低,母亲分娩时抗生素的使用更会提高婴儿肠道内艰难梭菌定植的机率和风险[26],而妊娠期间母亲使用抗生素似乎不会对婴儿肠道菌群造成影响[32]。周彦宏[43]对健康和使用抗生素的婴儿粪便进行16S rRNA测序后发现,抗生素婴儿粪便菌群多样性低于健康婴儿,使用不同抗生素的婴儿粪便优势菌存在差异,如服用阿莫西林的婴儿肠道优势菌属为肠球菌属;服用美罗培南的婴儿肠道优势菌属则为埃希氏菌属(Escherichia),抗生素对微生物的影响似乎取决于抗生素的广谱性。对新生儿使用抗生素会减少婴儿肠道微生物多样性并降低其代谢物水平,即使短期的抗生素治疗也会对婴儿肠道菌群的进化产生影响,变形菌丰度的增加会导致在治疗后8 周内的双歧杆菌增殖受到抑制,虽然这种差异会随着母乳的喂养而逐渐减小,但不能排除抗生素会对婴儿发育健康产生深远的影响;因此,需要减少对婴儿使用不必要的抗生素[44]。
2.5 母婴补充益生菌或益生元
虽然有研究表明,母亲妊娠期补充益生菌不会对婴儿肠道菌群产生影响[16],但妊娠期补充益生菌却可以有效改善妊娠期糖尿病、妊娠期肥胖等并发症。多项研究表明,妊娠期补充益生菌可以降低孕妇妊娠期糖尿病的风险[45],降低空腹血糖并增加胰岛素敏感性[46],同时能够降低孕妇总胆固醇和低密度脂蛋白水平[47]。补充益生菌的婴儿在一周内双歧杆菌的丰度增加,并伴随着肠杆菌科丰度的减少,同时粪便中分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)的含量也显著增加[48]。王晶[49]的研究结果表明,生命早期进行益生菌干预还可有效预防湿疹,这种影响会受益生菌干预对象(母亲、婴儿或同时)、干预时间、益生菌种类及剂量等因素影响,益生菌干预时间超过6 个月还可以显著降低婴儿对食物的过敏现象。
益生元可以是饮食中到达结肠的任何功能性成分,低聚半乳糖、低聚果糖、2’-岩藻基乳糖和乳糖-N-新四糖是婴儿配方粉中常用的补充产品,且因其使用风险低、易给药和对肠道菌群的有益影响而被广泛应用[50]。在一项随机双盲试验中发现,婴儿食用添加益生元的配方粉后,肠道内双歧杆菌的比例显著升高[51]。其他研究则发现添加低聚糖的配方奶可以降低婴儿粪便中肠杆菌、拟杆菌和梭菌属的丰度[52-54]。益生元对肠道的影响机理主要包括以下3 点:1)通过竞争消化道的附着位点防止有害菌的定植;2)通过对益生菌的促进作用抑制有害菌的增殖;3)通过发酵过程中产生的短链脂肪酸降低肠道内pH值并增加肠绒毛的长度和数量[55]。
即便目前无研究表明益生元和益生菌对身体有害,但此类产品的作用仍会因个体差异而呈现不同的效果。目前并无对益生菌和益生元使用的特定安全准则,因此在使用此类产品前应对其安全性和使用剂量严格把控,不可盲目跟风。
2.6 环境因素
婴儿的肠道菌群还会受到环境因素,如生活区域、经济条件、母亲孕次等因素的影响。受不同地区生活方式和饮食差异的影响,婴儿肠道微生物的结构和数量也会产生变化。如对同样进行母乳喂养的生活在农村和城市6 月龄婴儿肠道菌群进行比较后发现,尽管农村婴儿双歧杆菌比例(70.8%)显著高于城市婴儿(46.8%),但在农村婴儿粪便中却检测不出青春双歧杆菌的存在[56]。一项涉及11 个国家的调查中发现,肯尼亚和埃塞俄比亚地区婴儿肠道微生物多样性高于加纳和美国,且埃塞俄比亚地区婴儿肠道内乳杆菌的相对丰度显著高于美国,这为探讨婴儿肠道菌群在种群间的差异提供了更多的证据[57]。Martin等[58]的研究表明,首胎婴儿被齿列芽孢杆菌(Bacillus dentium)定植的几率是非首胎婴儿的2.5 倍,而非首胎婴儿在出生后前3 个月则更易被链状芽孢杆菌(Bacillus catenulatum)定植,且双歧杆菌的增长速度也比首胎婴儿更快,这种差异可以持续到6 个月;而婴儿肠道内梭菌属、韦荣球菌属、消化链球菌(Peptostreptococcaceace)、粪球菌的过多以及双歧杆菌的不足似乎与宠物接触有关。总的来说,肠道菌群受环境因素影响复杂,具体的关联和更确切的因素还需要更多的研究证明。
2.7 宿主基因
宿主基因也会影响婴儿肠道微生物的发育,主要表现在同卵双胞胎的微生物相似性水平高于异卵双胞胎及无血缘关系成员,且同卵双胞胎之间的微生物差异并不显著[59-60]。Kurilshikov等[61]在18 340 人的全基因组基因型中发现了19 个可遗传细菌类群和31 个影响菌群特征的基因座,其中乳糖酶lct基因座与双歧杆菌属的关联最显著,并受到种族和年龄影响。Ruhlemann等[62]的研究结果表明了血型与菌群的关系,ABO血型与拟杆菌属和粪杆菌属相关,另外拟杆菌属的操作分类单位(operational taxonomic unit,OTU)也与fut2基因有关。这说明肠道菌群的类型会受宿主基因的影响。
总而言之,新生儿肠道菌群一直处于变化状态,这种变化容易受到遗传、环境、饮食等多种因素影响(图1),而肠道菌群与婴儿的健康成长密切相关,因此帮助婴儿肠道菌群向有益于健康的方向发展对婴儿的生长发育百利无一害。

图1 不同时期影响婴儿肠道菌群结构的因素Fig. 1 Factors affecting infant intestinal microbiota at different stages of life
3 肠道菌群与婴儿健康
婴儿时期是肠道微生物发育的关键时期,也是人生发育的机会窗口,肠道微生物的变化与机体健康密切相关,异常菌株的定植是造成机体健康异常的关键原因,大量研究表明患病机体肠道菌群与健康机体的差异主要表现在患病机体肠道内厚壁菌相对丰度减少,变形菌相对丰度增加。本文从肠道疾病、过敏性疾病、代谢疾病和神经系统4 个方面论述肠道菌群与机体健康的关系。总之,健康的肠道菌群能够帮助机体向有益的方向发展,而菌群的变化在某种程度上可作为机体异常的预示。
3.1 新生儿坏死性小肠结肠炎
新生儿坏死性小肠结肠炎(neonatal necrotizing enterocolitis,NEC)是新生儿常见的死亡率较高肠道疾病,多发生在早产儿和低出生体质量婴儿身上,目前NEC的发病机制尚不明确,但有研究表明其与肠道菌群有关[63]。研究人员认为,NEC发生前患儿的肠道菌群已经发生改变,异常菌株的定植是NEC发生的关键诱因[64]。主要表现在早产儿NEC发生前变形菌相对丰度增加,厚壁菌和拟杆菌相对丰度减少[65]。李思文[63]研究表明,粪便中拟杆菌属和不动杆菌属(Acinetobacter)数量持续增加的早产儿患NEC的机率更高,并且患有NEC的婴儿粪便中克雷伯菌属的丰度显著高于出生时和治疗后。Stewart等[66]的研究则表明当婴儿双歧杆菌属在菌群中占相对优势时不易患NEC。现有关于NEC与肠道菌群关系的研究大多体现在早产儿和低出生体质量婴儿上,除上述涉及的微生物外,乳杆菌属、梭菌属等也与NEC的发生密切相关(表1)。鉴于脑-肠轴理论的兴起,研究人员发现NEC的发生还伴随着神经损伤,其特征是小胶质细胞激活和白质丢失,肠道中的CD4+T细胞流入脑中,分泌的干扰素-γ诱导小胶质细胞激活和髓鞘丢失造成脑损伤,因此,及时发现治疗NEC还与神经功能的改善有关[67](图2)。除了传统的治疗方式,利用益生菌防治NEC成为了新的研究方向。目前研究认为,益生菌可以通过以下两个方面防治NEC:1)益生菌通过增强屏障黏膜完整性防止肠道细菌移位;2)益生菌通过调节免疫细胞数量,下调促炎因子的表达,减少肠道炎症损伤[68]。目前推荐使用能够有效防治NEC的益生菌制剂有:鼠李糖乳杆菌(Lactobacillus rhamnosusGG)、嗜酸乳杆菌(Lactobacillus acidophilus)、婴儿双歧杆菌(Bifidobacterium infantis)、两歧双歧杆菌等[68]。
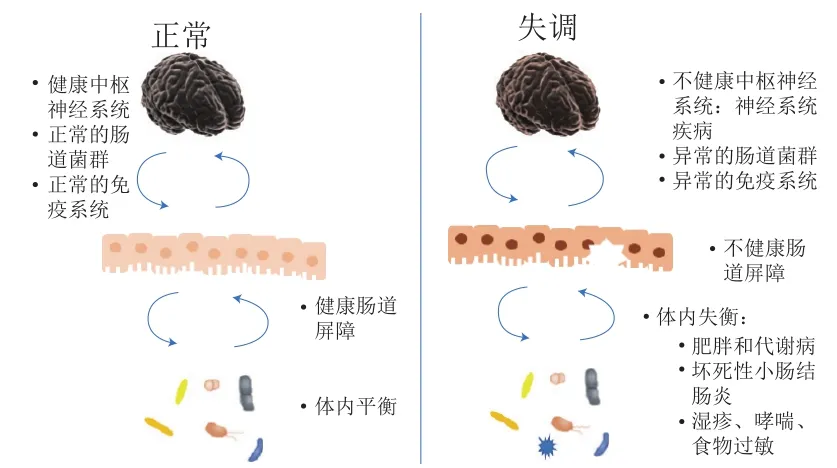
图2 肠道菌群与脑-肠轴之间的关系[83]Fig. 2 Relationship between intestinal microbiota and brain-gut axis[83]
3.2 过敏性疾病
新生儿的免疫系统是向辅助型T细胞(T helper cell,Th)2偏移的状态,此时T细胞富集不足、Th1介导的免疫反应不完全。若Th2介导的免疫反应沉默失败将会造成婴儿的过敏反应,而微生物多样性和刺激强度的降低会导致儿童期免疫系统的早熟,大龄儿童肠道菌群组成与过敏性疾病较弱的相关性更加证明了生命早期微生物对免疫系统的作用,因此在产前或产后进行适当的微生物刺激有利于平衡先天和适应性免疫系统的成熟[27,84]。本文中涉及的湿疹、牛乳蛋白过敏和哮喘都是新生儿易发生的过敏性疾病,普遍表现是双歧杆菌相对丰度的降低,患儿肠道内肠球菌、克雷伯菌属和大肠杆菌等细菌相对丰度则呈现增加的趋势(表1)。此外,从肠道菌群代谢物的角度也可说明过敏患儿的菌群结构与健康婴儿的差异,Park等[85]研究表明,患有短暂性皮炎的婴儿不仅肠道菌群与健康婴儿有差异,短链脂肪酸水平也低于健康婴儿。对于过敏性疾病,理想的治疗方式仍是使用益生菌进行防治,如鼠李糖乳杆菌的补充可有效防治湿疹、哮喘的发生[86-87],短双歧杆菌(Bifidobacterium breve)可有效缓解婴儿食物过敏症状[88]。另外,母乳中含有多种能够与婴儿免疫系统和肠道环境相互作用的免疫因子,且HMOs对婴儿肠道内有益菌具有促进作用,进一步说明母乳喂养较配方粉喂养具有独特的优势[89]。即便越来越多的证据表明肠道菌群在调节免疫系统方面发挥着重要作用,但肠道菌群与免疫系统共同进化的机制以及肠道菌群是如何影响免疫系统的还需要进行更多的研究。
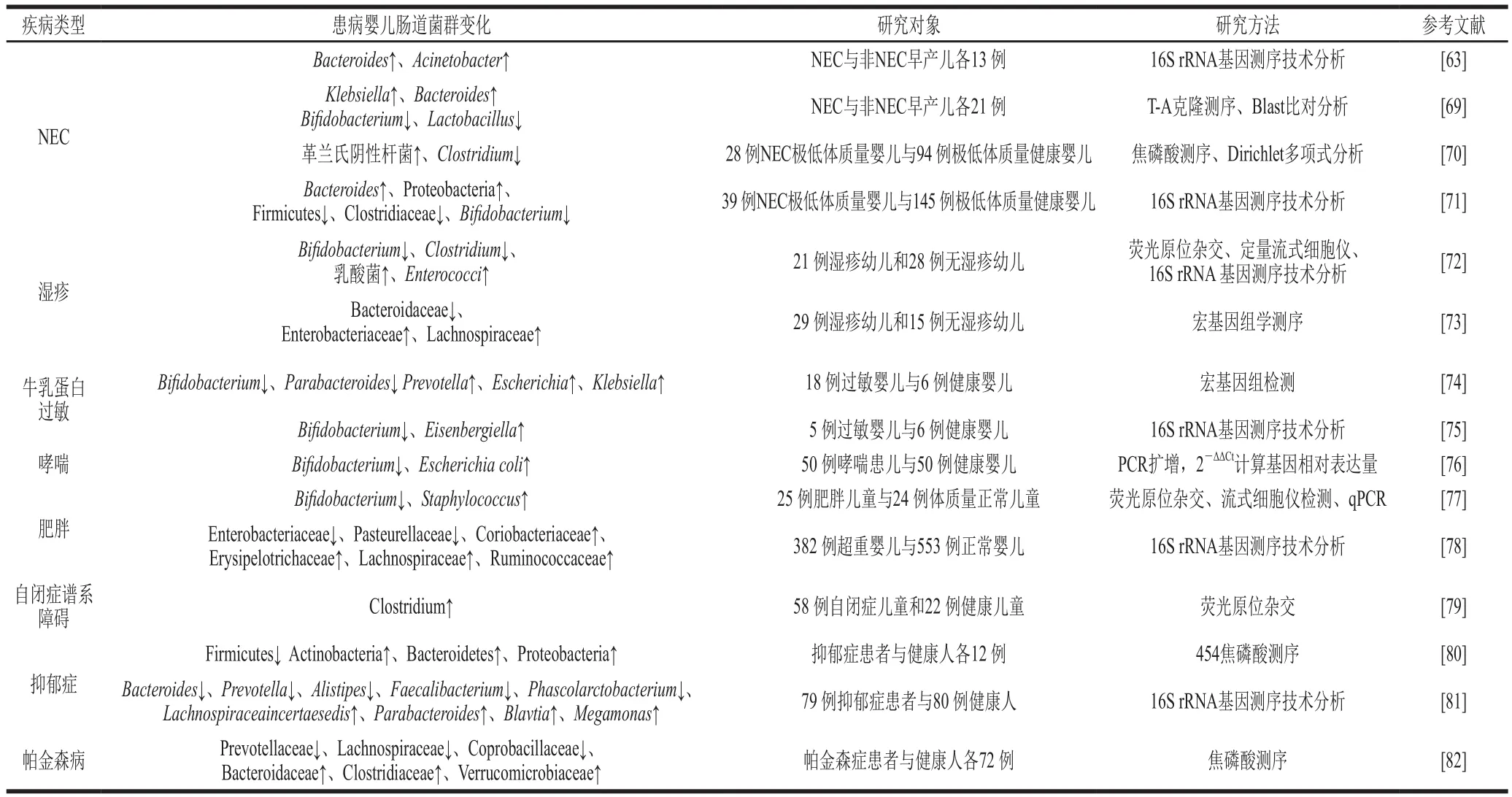
表1 肠道菌群与婴儿健康的关系Table 1 Relationship between intestinal microbiota and infant health
3.3 肥胖和相关疾病
肥胖已经成为世界范围内严重的公共健康问题,研究表明,婴儿早期肠道菌群失调是导致日后肥胖的原因之一。1 月龄婴儿肠道内拟杆菌的定植会导致生长前6 个月体质量异常增加[2],6~12 月龄时双歧杆菌丰度的减少和葡萄球菌丰度的增加与7 岁时的肥胖患病率呈正相关[77]。体质量增长异常也可能源于妊娠期,肥胖孕妇为胎儿提供过多的能量,并将肠道微生物传递给婴儿,造成不利于婴儿代谢的恶性循环[27]。研究表明孕期体质量增加异常或肥胖母亲分娩的婴儿比孕期体质量正常母亲分娩的婴儿超重的概率高3 倍,且肥胖母亲分娩的婴儿肠道内肠杆菌科和巴斯德式菌科(Pasteurellaceae)丰度较低,而放线菌和厚壁菌相对丰度较高[78]。孕期服用益生菌则可以降低母亲孕期肥胖的风险,合理的饮食结合益生菌的作用还可以改善血糖浓度和胰岛素敏感性,有效避免妊娠期糖尿病[90],而分娩前后服用鼠李糖乳杆菌可以促进双歧杆菌在新生儿肠道内的定植,还会影响母乳中的微生物群[91]。因此,婴儿的长期健康可以通过孕期平衡母亲的营养来实现。
3.4 神经精神障碍
随着对肠道菌群研究的深入,脑-肠轴的理念逐渐受到重视,肠道微生物可以通过包括代谢物、激素、免疫系统和传入神经等途径向神经中枢发出信号(图2)。肠腔和大脑通过排列在肠腔内的分泌细胞和迷走神经的直接接触形成突触,利用谷氨酸作为神经递质进行信号传递[92]。此外,微生物的代谢产物也能够对神经系统产生影响,如短链脂肪酸能够影响小胶质细胞的成熟[93];胆汁酸可以通过结合法尼醇受体和G蛋白偶联受体作为信号分子[94]。肠道菌群的差异则会成为神经性疾病的隐患,研究表明,肠道菌群的差异会造成帕金森病、自闭症谱系障碍、精神分裂症、阿尔茨海默症和抑郁症等神经性疾病(表1)。
4 婴幼儿食品开发
婴儿时期肠道菌群容易发生改变,鉴于肠道菌群对婴儿的作用,开发维持和调整婴儿肠道菌群向有利于婴儿发育方向改变的食品至关重要。HMOs对婴儿的生长发育十分重要,不仅在调节婴儿肠道微生物方面具有独特的优势(表2),对婴儿免疫功能和脑的发育等方面都具有优点[95]。Berger等[96]通过一项随机双盲实验发现,接受添加2-岩藻糖乳糖和乳糖-N-新四糖饮食的婴儿肠道菌群更接近于母乳喂养组,因此在配方粉的开发中添加HMOs十分必要。由于从母乳中分离HMOs得率低,当前母乳低聚糖的合成方法(化学合成法、体外酶法及体内细胞法)仍存在一定缺陷(产品得率低、纯度低、合成技术难度高等),生产者大多在设计时添加低聚糖(m(低聚半乳糖)∶m(低聚果糖)=1∶9)以弥补配方粉较母乳对肠道菌群影响的差异(表2),但这远比不上HMOs的优势[95],因此寻找更加经济高效的HMOs提取或合成方法,使配方奶成分更加接近于母乳的成分仍是研究者们需要努力的方向和目标。

表2 低聚糖对肠道菌群的影响Table 2 Effects of oligosaccharides on intestinal microbiota
辅食添加时期同样是婴儿肠道微生物转变的关键时期,固体食物的引入被认为是启动功能更复杂的类成人微生物群的开端,包括对不易消化的碳水化合物的利用[41]。Gehrig等[102]将设计辅食喂食给小鼠、幼猪和营养不良儿童,结果表明,其中一种配方(主要成分是鹰嘴豆、花生粉、大豆油和香蕉)能够促进营养不良儿童的生长、免疫系统的发育及骨的形成,使其接近健康婴儿的生长状态,该研究再一次为微生物群的发展和健康的关系提供了有效证明,并研发了一种通过改善营养不良儿童肠道微生物的组成而治疗营养不良的辅食。因此,在添加辅食这一关键时期,有目的地摄入有利于婴儿肠道微生物发育的食物也是帮助婴儿维持和建立健康肠道菌群的方法之一,相关从业者和研究人员有必要在设计新产品时,将肠道菌群这一因素加以考虑,更加全面地设计营养均衡的新型辅食。
5 结 语
婴儿时期是肠道微生物变化发展的关键时期,肠道微生物的组成对婴儿日后的成长至关重要。婴儿肠道菌群的定植可能开始于出生前,影响婴儿肠道微生物的因素很多,如喂养方式、分娩方式、生活环境。肠道微生物的组成会影响婴儿肠道屏障的形成、免疫系统以及神经系统的发育,与婴儿的健康密切相关。因此,在生命的前1 000 d内(妊娠期开始到2 岁)都需要对婴儿的肠道微生物格外关注,需要有方向地帮助婴儿建立健康的肠道微生物群。
