桑叶生物碱对D-半乳糖诱导小鼠肠道菌群紊乱的调节作用
2022-04-01黄先智郝麒麟丁晓雯
贺 燕,黄先智,韦 峥,郝麒麟,丁晓雯,*
(1.西南大学食品科学学院,重庆 400716;2.西南大学科技处,重庆 400716)
肠道菌群是一个复杂的微生态系统,被视为重要的代谢器官,在维持肠屏障完整性、营养物质加工、免疫调节等方面起着关键作用[1]。肠道是黏膜屏障和营养物质消化吸收的主要场所,也是机体应激反应的中心器官,因此更易受到不恰当的饮食、药物、体内毒素和代谢产物等的刺激发生氧化应激[2-3]。据报道,肠道内若发生氧化应激,过量的自由基会引起肠黏膜损伤,肠道内环境的稳态被破坏,致病菌及代谢毒素侵染,引起肠道菌群的动态失衡,表现为细菌的丰富度和多样性下降,菌群的组成及结构发生失调[4-5]。大量研究证实,在氧化应激相关的疾病如肥胖、糖尿病及阿尔茨海默病中,肠道菌群的丰度及多样性下降,核心菌群发生改变,有害菌的丰度增加,而有益菌的繁殖则受到抑制[6-9]。因此,寻找有效的抗氧化剂对恢复氧化应激导致的肠道菌群结构失衡,从而维持菌群的正常功能并预防相关疾病的发生具有重要意义。
已有大量研究证实生物碱类物质对肠道菌群具有显著的调节作用。D-荞麦碱能够抑制鼠伤寒沙门氏菌和大肠杆菌,改善肠黏膜的损伤[10]。荷叶总生物碱能够能显著促进肥胖小鼠肠道益生菌阿克曼菌属、乳杆菌和双歧杆菌的生长,抑制致病菌变形菌门和脱硫弧菌属的繁殖[11]。桑叶生物碱是从桑叶中分离纯化得到的,以1-脱氧野尻霉素(1-deoxynojirimycin,DNJ)为主的哌啶烷类生物碱是一种高效的天然抗氧化剂,可以有效清除自由基,维持机体氧化-抗氧化系统的动态平衡[12]。此外,通过体外模拟胃肠消化实验发现,桑叶生物碱经胃蛋白酶、胰蛋白酶消化后其抗氧化活性显著提高[13]。Li Yougui等[14]已证实DNJ对糖尿病小鼠肠道菌群的结构具有积极的调节作用。目前,关于桑叶总生物碱对氧化应激小鼠肠道菌群调节作用的相关研究鲜见报道,故本研究采用D-半乳糖(D-galactose,D-Gal)诱导建立氧化应激模型,通过高通量测序技术分析桑叶生物碱对实验小鼠肠道菌群的调节作用,为肠道菌群结构紊乱所致相关疾病的预防与治疗提供参考,也有助于蚕桑这一传统产业的多元化发展。
1 材料与方法
1.1 动物、材料与试剂
60 只SPF级昆明种雄性小鼠(4 周龄,体质量18~22 g)购自湖南省斯莱克重庆分公司,生产许可证号SCXK(湘)2016-0002)。
桑叶粉末 重庆市蚕业科学技术研究院;基础饲料 重庆医科大学实验动物中心;D-Gal(纯度≥99%)、还原型谷胱甘肽(glutathione,GSH)(纯度≥98%) 北京索莱宝科技有限公司;活性氧(active oxygen species,ROS)、超氧化物歧化酶(superoxide dismutase,SOD)、硫氧还蛋白-1(thioredoxin-1,Trx-1)试剂盒 上海优选生物科技有限公司;DNeasy PowerSoil Kit(100)、QIAamp 96 PowerFecal QIAcube HT kit(5)试剂盒 德国QIAGEN公司;Qubit dsDNA Assay Kit试剂盒 美国Life Technologies公司;ExTaq®酶日本Takara公司。其他试剂均为国产分析纯。
1.2 仪器与设备
DW-HL438型超低温冰箱 合肥美菱股份有限公司;F6/10型均浆机 上海弗鲁克流体机械制造有限公司;5880型冷冻离心机 德国Eppendorf公司;SymergyH1酶标仪 美国Christ公司;DUP-9082恒温培养箱 上海齐欣实验器材有限公司;聚合酶链式反应(polymerase chain reaction,PCR)仪 美国Bio-Rad公司;EPS-600电泳仪、3500凝胶成像仪 上海天能公司。
1.3 方法
1.3.1 桑叶生物碱的制备
桑叶生物碱由本实验室自制[15],经硅钨酸沉淀法[1]测得总生物碱质量分数93.57%、多糖质量分数3.21%、黄酮质量分数2.20%。
1.3.2 实验动物的分组与造模
实验方案经西南大学伦理委员会批准,并严格按照西南大学《实验动物保护和使用规则》执行。每4~5 只小鼠为一笼,在光照周期12 h、温度(22±2)℃、相对湿度50%~70%的环境下饲养。实验期间,小鼠自由饮水、饮食(基础饲料),每天同一时间段测定体质量,观察小鼠的活动情况并记录。适应性喂养7 d后,将小鼠按体质量随机分为正常组、模型组、阳性对照组、桑叶生物碱低、中、高剂量组,每组10 只。除正常组每天腹腔注射10 mL/kgmb生理盐水外,其余各组每天腹腔注射1 000 mg/kgmb的D-Gal(将1 000 mgD-Gal溶于10 mL超纯水,按照10 mL/kgmb进行腹腔注射),持续45 d后进行桑叶生物碱干预。桑叶生物碱低、中、高剂量组分别每天灌胃50、100、200 mg/kgmb(分别称取50、100、200 mg桑叶生物碱溶于10 mL超纯水,按照10 mL/kgmb灌胃),阳性对照组灌胃200 mg/kgmbGSH(称取200 mg GSH溶于10 mL超纯水,按照10 mL/kgmb灌胃),正常组和模型组灌胃10 mL/kgmb生理盐水,持续45 d。桑叶生物碱剂量根据前期预实验确定,且经过毒理学实验表明,高剂量的桑叶生物碱无毒副作用。
1.3.3 测定样本的采集与制备
灌胃结束后,各组小鼠禁食不禁水12 h,麻醉后颈椎脱臼法处死小鼠,迅速取出小肠段和盲肠段组织,小肠组织用预冷的生理盐水洗净并测定质量,于超净工作台中取出盲肠内容物,-80 ℃保存备用。
称取一定质量的小肠组织,以1∶9(m/V)的比例加入预冷生理盐水,采用匀浆机制成匀浆(匀浆时间10 s/次,间隔30 s,冰水浴条件下重复3~5 次),然后4 ℃、3 000 r/min离心15 min,取上清液于-80 ℃保存备用。
1.3.4 小肠组织中指标的测定
小肠组织中ROS、SOD、Trx-1水平分别参考对应试剂盒说明书进行测定。
1.3.5 高通量测序分析盲肠内容物菌群
1.3.5.1 基因组DNA提取、扩增与测序
采用DNA抽提试剂盒对样本(每组5 个样本,共30 个样本)的基因组DNA进行提取,通过琼脂糖凝胶电泳检测DNA的纯度和浓度,取适量的DNA样品于离心管中,使用无菌水稀释至1 ng/μL。以稀释后的基因组DNA为模板,根据测序区域的选择,使用带barcode的特异性引物、ExTaq®高保真酶进行PCR,确保扩增效率和准确性。
电泳检测PCR产物,检测后使用磁珠纯化,纯化后作为二轮PCR模板,并进行二轮PCR扩增,并再次使用电泳检测,检测后使用磁珠纯化,纯化后对PCR产物进行Qubit定量。根据PCR产物浓度进行等量混样,并进行测序。测序委托上海欧易生物医药科技有限公司完成。
1.3.5.2 生物信息学分析
对获得的fastQ格式的原始数据(raw tags)进行拼接、过滤,得到高质量数据(clean tags);同时,利用UCHIME软件检测并去除序列中的嵌合体序列。测序数据进行预处理生成优质序列之后,采用Vsearch软件,根据序列的相似性,将序列归为多个操作分类单元(operational taxonomic units,OTU)。参数为序列相似度大于或等于97%被归为1 个OTU单元。使用QIIME软件包的挑选出各个OTU的代表序列,并将所有代表序列与Greengenes数据库(https://greengenes.lbl.gov/Download/)进行比对注释。物种比对注释使用Blast软件。
1.4 数据处理与统计学分析
实验结果均以平均值±标准差表示,采用SPSS 22.0软件对结果进行单因素方差分析,通过Duncan检验进行显著性分析,以P<0.05为差异具有统计学意义。采用Origin 2018软件作图。
2 结果与分析
2.1 桑叶生物碱对小鼠小肠组织中ROS水平的影响
ROS产生与消除的动态平衡对机体稳态至关重要。一方面,ROS在信号转导、氧化还原调节中起着核心作用[17];另一方面,ROS的浓度过高不仅会破坏机体的抗氧化系统,还会诱导细胞凋亡,加剧器官组织的氧化损伤[18]。因此,常将ROS水平的变化作为指示氧化应激可能发生的指标[19]。桑叶生物碱对小肠组织中ROS水平的影响如图1所示。
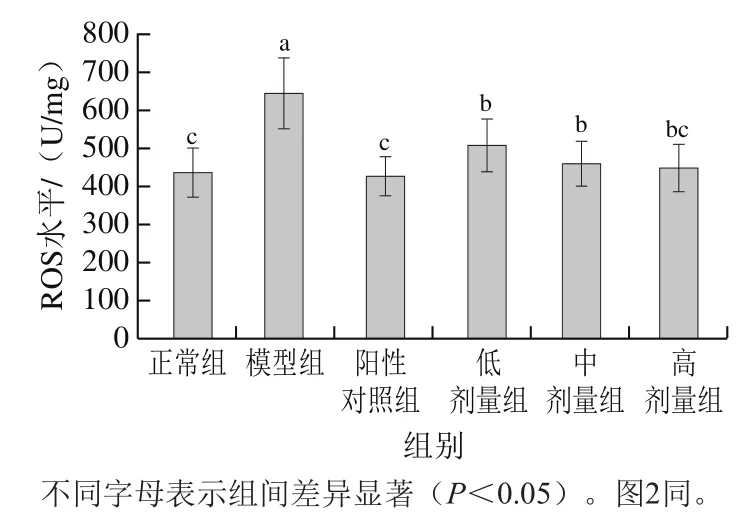
图1 桑叶生物碱对小鼠小肠组织中ROS水平的影响(n=10)Fig. 1 Effects of mulberry leaf alkaloids on ROS in small intestinal tissue of mice (n = 10)
由图1可知,与正常组相比,模型组小鼠小肠组织中ROS水平增加了47.15%(P<0.05),表明注射D-Gal可能使小鼠小肠发生了氧化应激反应。与模型组相比,阳性对照组中ROS降低了33.74%(P<0.05),与正常组无显著差异(P>0.05),表明灌胃GSH能有效降低肠道组织中ROS水平。低、中、高剂量的桑叶生物碱中ROS水平分别降低21.02%、28.64%、30.34%(P<0.05),其中高剂量组的ROS能恢复至正常组水平,表明桑叶生物碱能有效清除小鼠肠道组织中的ROS,可能减弱肠道氧化应激反应。
2.2 桑叶生物碱对小鼠小肠组织中抗氧化剂的影响
SOD是生物体内清除ROS的关键酶,被誉为ROS的清道夫。SOD在生物体内的活力高低是衡量氧化应激反应程度的直观指标[20]。在酶促抗氧化途径中,SOD是第一个将超氧阴离子转化为过氧化物的酶,然后通过其他抗氧化酶将过氧化物转化为水[21]。Trx-1由于其较强的还原性,能够中和体内过多的ROS,还能调控氧化酶如SOD的活力,增强机体对氧化应激的耐受性[22]。本研究为探讨桑叶生物碱对小肠组织中抗氧化剂的影响,对酶类及非酶类抗氧化系统中代表性抗氧化剂SOD、Trx-1水平的变化进行了测定,结果如图2所示。
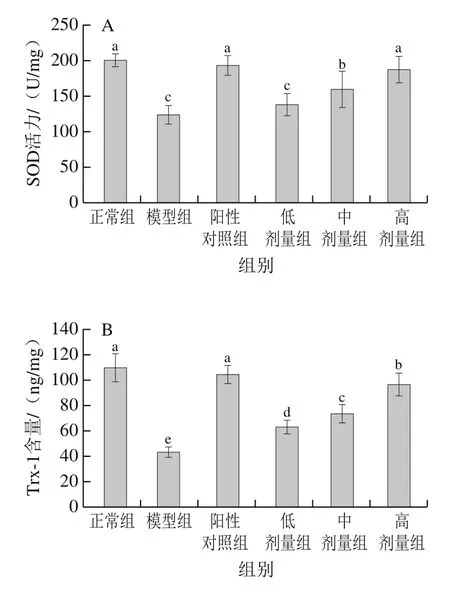
图2 桑叶生物碱对小鼠小肠组织中SOD活力(A)、Trx-1含量(B)的影响(n =10)Fig. 2 Effects of mulberry leaf alkaloids on SOD (A) and Trx-1 (B)levels in small intestinal tissue of mice (n = 10)
由图2可知,与正常组相比,模型组小鼠小肠组织中SOD活力、Trx-1含量分别下降了38.19%、60.62%(P<0.05),表明模型组小鼠小肠组织中抗氧化能力大大下降。与模型组相比,阳性对照组和桑叶生物碱高剂量组均能使SOD、Trx-1水平显著增加(P<0.05),其中阳性对照组中SOD活力、Trx-1含量分别增加了56.25%、134.27%(P<0.05);桑叶生物碱低、中、高剂量组小鼠小肠组织中SOD活力分别增加了11.88%(P>0.05)和28.87%、63.59%(P<0.05),Trx-1含量分别增加了46.02%、69.61%、123.75%(P<0.05),其中桑叶生物碱高剂量组中SOD活力与阳性对照组、正常组相比均无显著差异(P>0.05),Trx-1含量与阳性对照组和正常组相比差异显著(P<0.05)。结果表明,实验剂量范围的桑叶生物碱能显著增加SOD活力及Trx-1含量,有效增强小肠组织中的抗氧化能力,其中高剂量桑叶生物碱能使SOD活力恢复到正常水平,但在实验时间和桑叶生物碱剂量范围内还不能使Trx-1恢复至正常组水平。
2.3 桑叶生物碱对实验小鼠肠道菌群的影响
2.3.1 样本中序列长度分布统计结果
原始数据会经过质控、过滤、去嵌合体,最终得到高质量数据。通过高质量数据长度分布统计结果,可判断测序质量是否合格,结果如图3所示。
如图3所示,样本的高质量数据长度在400~450 bp,在正常范围(300~500 bp)内,表明此次样本的测序质量合格。
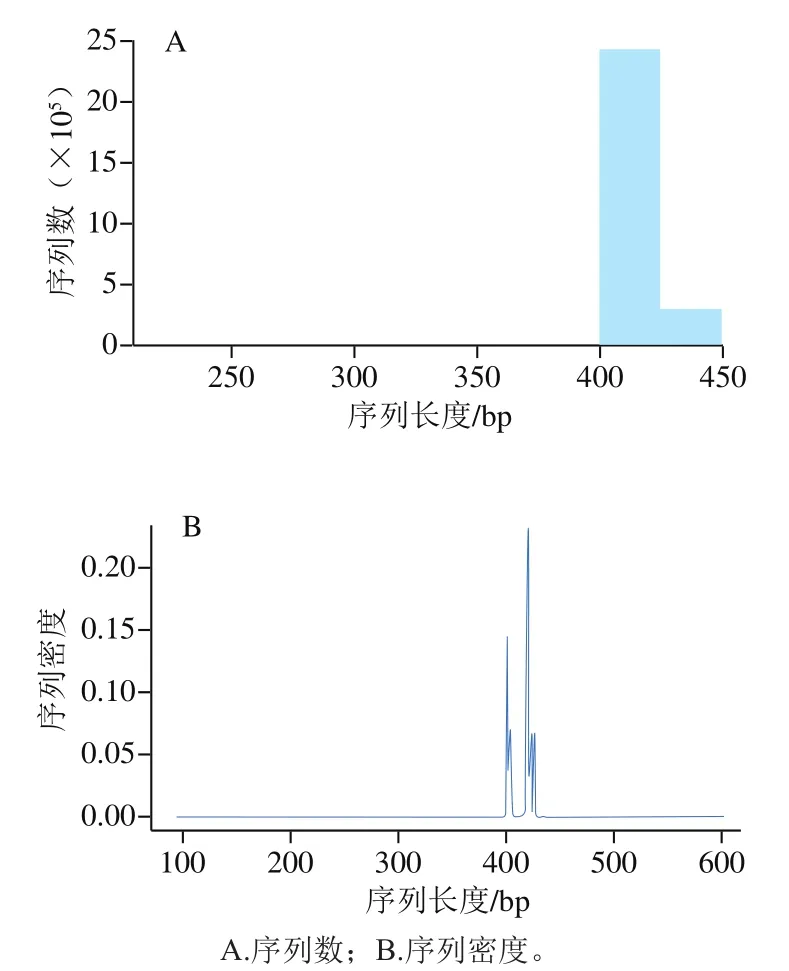
图3 样本中高质量数据长度分布统计Fig. 3 Distribution of clean tags length in samples
2.3.2 肠道菌群物种多样性稀释曲线分析
稀释曲线是用来评价测序量是否足以覆盖所有类群,并间接反映样品中物种的丰富度及多样性[23]。当曲线趋向平坦且Good’s coverage大于0.75时,表明测序数据量趋于合理,可反映样品中绝大多数微生物菌种信息。本研究通过绘制Good’s coverage稀释曲线和Shannon-Wiener曲线来验证测序数据的合理性,结果如图4所示。
Good’s coverage稀释曲线显示,随着测序深度的增加,曲线趋于平缓,且各组Good’s coverage均在0.9~1.0范围,提示测序深度已经基本能够涵盖样品中的菌种信息。Shannon-Wiener曲线是通过各样品的测序量在不同测序深度时的微生物多样性指数构建的曲线,能反映样品在不同测序数量时的微生物多样性。当曲线逐渐平坦时,说明此时的测序量足以反映样品中绝大多数的菌群信息。由图4可看出本研究中样本的测序量比较合理,可反映微生物群落中大多数物种的信息。
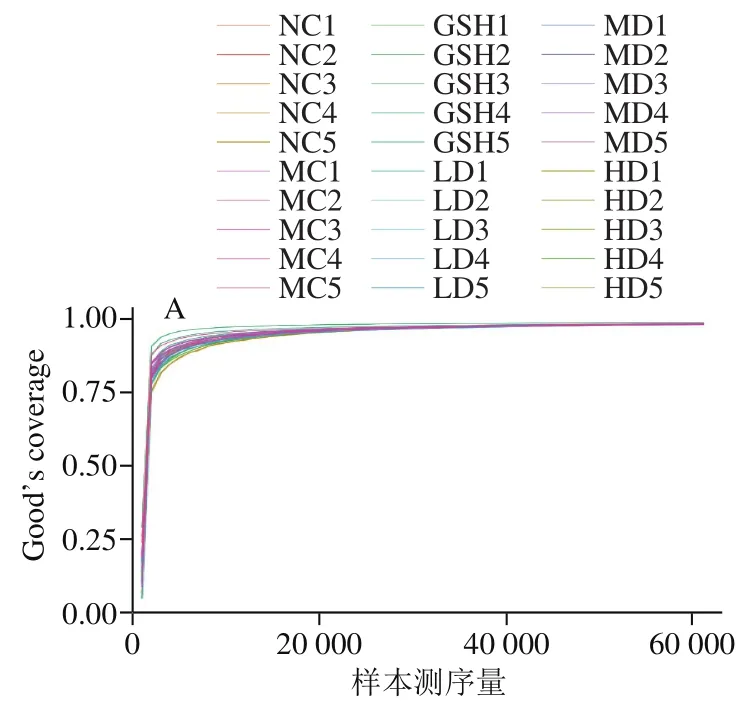
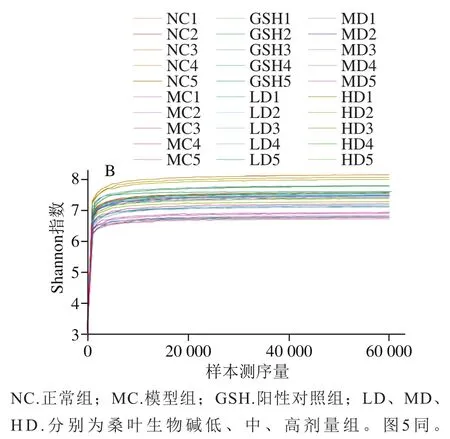
图4 不同样本的Good’s coverage稀释曲线(A)和Shannon-Wiener稀释曲线(B)(n=5)Fig. 4 Good’s coverage (A) and Shannon-Wiener (B) rarefaction curves of different samples (n = 5)
2.3.3 桑叶生物碱对实验小鼠肠道菌群α多样性的影响
α多样性通常用于评价微生物群落的丰富度和多样性,常通过Observed species、Chao1、Shannon、Simpson指数来衡量[24]。Observed species和Chao1指数常用于表示样品中含有的物种数目,数值越高表明样品物种丰富度越高;Shannon和Simpson指数主要用来估算样本中微生物的多样性,数值越高说明群落多样性越高[25]。本研究通过计算各组小鼠肠道微生物的4 种指数的变化,探究桑叶生物碱对氧化应激小鼠肠道微生物多样性的影响,结果如表1所示。
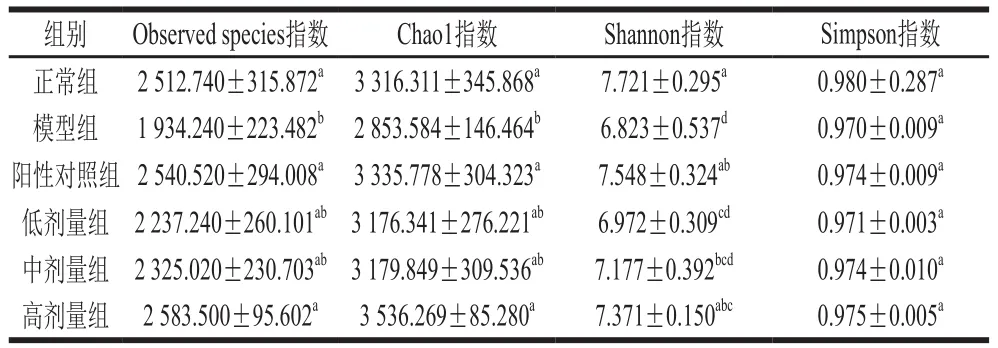
表1 不同样品的α多样性指数(n=5)Table 1 Bacterial α-diversity indexes of different samples (n = 5)
由表1可知,与正常组相比,模型组中Observed species、Chao1、Shannon指数均显著下降(P<0.05),Simpson指数虽有下降但不显著(P>0.05),表明D-Gal诱导下小鼠肠道微生物群物种数目减少,分布更加不均匀,多样性降低。与模型组相比,阳性对照组、桑叶生物碱高剂量组中Observed species、Chao1和Shannon指数均显著上升(P<0.05),且与正常组相比无显著差异(P>0.05)。Simpson指数结果显示,与模型组相比,阳性对照和桑叶生物碱各剂量组中Simpson指数均得到不同程度的提高,但差异不显著(P>0.05),其中以高剂量的桑叶生物碱作用效果最佳。结果表明,GSH和桑叶生物碱能够抑制D-Gal诱导的小鼠肠道菌群丰度及多样性的降低。其中桑叶生物碱各剂量组间差异不显著(P>0.05),且高剂量的桑叶生物碱作用效果最佳,能将Observed species、Chao1、Shannon指数均恢复至正常水平。
2.3.4 桑叶生物碱对实验小鼠肠道菌群β多样性的影响
β多样性用于描述各组小鼠肠道菌群组成的相似性或差异性。本研究通过Binary-Jaccard距离矩阵的主坐标分析(principal coordinate analysis,PCoA)和非度量多维标度(nonmetric multidimensional scaling,NMDS)分析来评估不同组小鼠肠道之间的微生物组成的差异。在PCoA和NMDS分析中,每个点都代表1 个样品中的菌群。两点之间的距离通过2 个菌群之间的序列相似度比较获得,距离越近,表明2 个样本之间的微生物群落结构相似度越高,差异越小[26]。结果如图5所示。
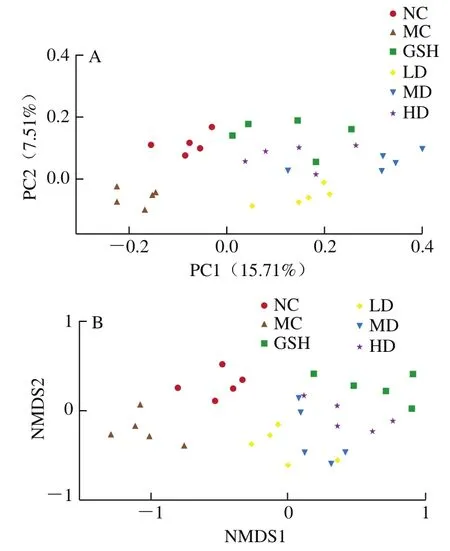
图5 基于OTUs的Binary-Jaccard 距离矩阵的PCoA(A)、NMDS(B)分析结果(n=5)Fig. 5 Principal coordinate analysis (PCoA) (A) and nonmetric multidimensional scaling (NMDS) (B) based on Binary-Jaccard distance matrix of OTUs (n = 5)
由图5可知,正常组和模型组间出现明显的分界线,表明D-Gal诱导下肠道菌群组成和结构发生了变化。阳性对照组和不同剂量的桑叶生物碱组均在一定程度上偏离模型组,向正常组靠近。说明灌胃阳性药物GSH和不同剂量的桑叶生物碱能在一定程度上改善模型小鼠盲肠内容物菌群的β多样性,以阳性对照组与桑叶生物碱高剂量组最为明显。结果表明,GSH和高剂量的桑叶生物碱能有效调整肠道菌群失衡,使之更接近于正常菌群。
2.3.5 桑叶生物碱对实验小鼠肠道菌群门水平结构的影响
为了探究桑叶生物碱对肠道菌群门水平的调节作用,对各组小鼠肠道菌群的主要门类水平进行了分析,结果如图6、表2所示。

图6 门水平上的肠道微生物组成(n=5)Fig. 6 Gut microbiota composition at the phylum level (n = 5)
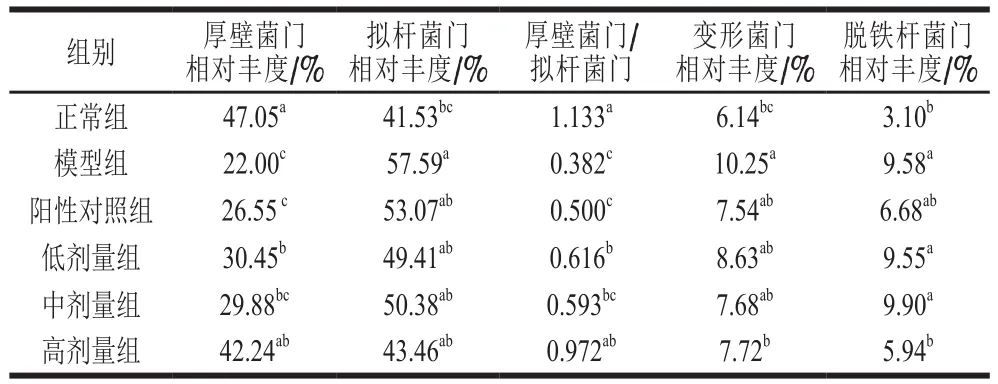
表2 桑叶生物碱对小鼠肠道菌群主要门水平的影响(n=5)Table 2 Effects of mulberry leaf alkaloids on relative abundance of main phyla in intestinal flora of mice (n = 5)
由图6、表2可知,各组小鼠的肠道菌群主要由厚壁菌门(Firmicutes)、拟杆菌门(Bacteroides)、变形菌门(Proteobacteria)、脱铁杆菌门(Deferribacteres)组成。正常组中厚壁菌门、拟杆菌门、变形菌门、脱铁杆菌门相对丰度分别占47.05%、41.53%、6.14%、3.10%,厚壁菌门与拟杆菌门相对丰度的比值为1.133。与正常相比,模型组中厚壁菌门的相对丰度下降至22.00%,拟杆菌门、变形菌门、脱铁杆菌门的相对丰度分别显著上升至57.59%、10.25%、9.58%(P<0.05),厚壁菌门与拟杆菌门相对丰度的比值下降至0.382(P<0.05)。灌胃GSH和桑叶生物碱后,这一趋势得到逆转,其中以高剂量的桑叶生物碱效果最好。与模型组相比,阳性对照组中厚壁菌门的相对丰度升至26.55%(P>0.05),拟杆菌门、变形菌门、脱铁杆菌门相对丰度分别下降至53.07%、7.54%、6.68%(P>0.05),厚壁菌门与拟杆菌门相对丰度的比值升至0.500(P>0.05);高剂量组中厚壁菌门的相对丰度显著上升至42.24%(P<0.05),拟杆菌门、变形菌门、脱铁杆菌门相对丰度分别下降至43.46%、7.72%、5.94%(P>0.05),厚壁菌门与拟杆菌门相对丰度的比值升至0.972(P<0.05)。结果表明,D-Gal诱导下,实验小鼠肠道微生物主要门类的相对丰度发生显著变化,GSH和不同剂量的桑叶生物碱能够有效调节模型鼠肠道菌群的主要门类水平,其中GSH可以使拟杆菌门、变形菌门、脱铁杆菌门的相对丰度恢复到正常组水平,高剂量的桑叶生物碱能使4 个主要门类的相对丰度恢复到正常组水平。
2.3.6 桑叶生物碱对实验小鼠肠道菌群属水平结构的影响
为了探究桑叶生物碱对肠道菌群属水平的调节作用,对各组小鼠肠道菌群的主要属水平进行了分析,结果如图7、表3所示。

图7 属水平上的肠道微生物组成(n=5)Fig. 7 Gut microbiota composition at the genus level (n = 5)
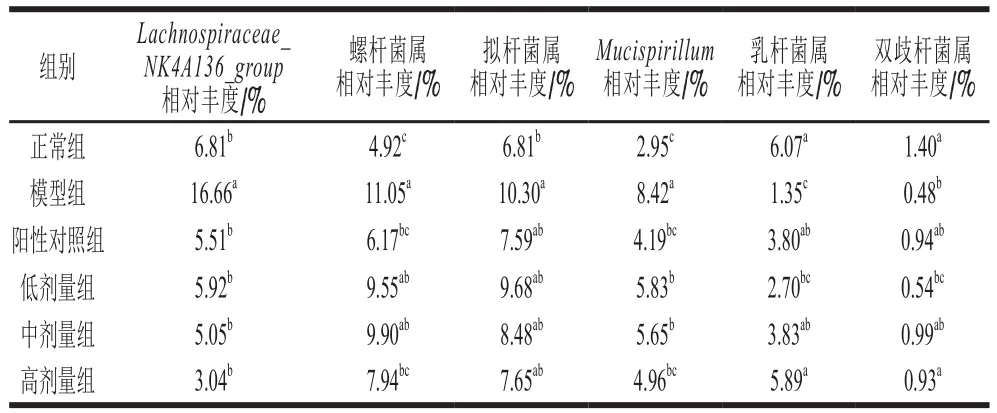
表3 桑叶生物碱对小鼠肠道菌群主要属水平的影响(n=5)Table 3 Effects of mulberry leaf alkaloids on relative abundance of main genera in intestinal flora of mice (n = 5)
由图7、表3可知,与正常组相比,模型组小鼠肠道中Lachnospiraceae_NK4A136_group、螺杆菌属(Helicobacter)、Mucispirillum、拟杆菌属(Bacteroides)的相对丰度显著升高(P<0.05),分别为16.66%、11.05%、8.42%、10.30%,乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)的相对丰度显著降低(P<0.05),分别为1.35%、0.48%,表明D-Gal诱导下,肠道中主要菌属的结构发生改变。与模型组相比,阳性对照和高剂量桑叶生物碱组中Lachnospiraceae_NK4A136_group、螺杆菌属、Mucispirillum的相对丰度分别显著降低至5.51%和3.04%、6.17%和7.94%、4.19%和4.96%(P<0.05),乳杆菌属、双歧杆菌属的相对丰度分别显著升高至3.80%和5.89%、0.94%和0.93%(P<0.05)。此外,阳性对照组和桑叶生物碱高剂量组中拟杆菌属的相对丰度较模型组升高,但差异不显著(P>0.05)。结果表明,GSH和桑叶生物碱能从属水平上有效调节肠道菌群结构,下调Lachnospiraceae_NK4A136_group、螺杆菌属的相对丰度,上调乳杆菌属和双歧杆菌鼠的相对丰度,其中GSH和高剂量的桑叶生物碱可以使Lachnospiraceae_NK4A136_group、螺杆菌属、Mucispirillum、拟杆菌属、双歧杆菌属的相对丰度调节至正常水平。
3 讨 论
实验动物外源性注射D-Gal是目前公认的氧化应激模型的造模方法[27]。D-Gal主要来源于动物的乳汁,是一种还原糖,在正常浓度下会代谢为葡萄糖,但浓度过高时会在半乳糖氧化酶的催化下,转化为醛糖和氢过氧化物,产生大量超氧阴离子和氧衍生自由基[28]。此外,D-Gal易与蛋白质和肽中的游离氨基酸反应,形成晚期糖基化终产物,促进ROS的产生,降低线粒体呼吸链复合物的活性并引起氧化应激损伤[29]。本研究中,模型组小鼠小肠组织中ROS水平较正常组显著升高,SOD活力、Trx-1含量较正常组显著下降,表明D-Gal的连续注射下,小鼠小肠组织中产生了大量的ROS,进一步引起氧化-抗氧化系统发生失衡,可能诱发氧化应激反应。灌胃桑叶生物碱后,这一趋势得到有效逆转,表现为各剂量组中ROS水平显著下降,SOD活力及Trx-1含量显著增加,其中高剂量的桑叶生物碱可将三者恢复至正常组水平,表明桑叶生物碱可有效清除自由基,具有显著的抗氧化活性,能增加小肠的抗氧化能力,这与杨忠敏[13]、郝麒麟[30]等研究得出的结论一致。
本实验通过16S rRNA高通量测序分析各组小鼠肠道菌群组成的变化。研究发现,模型组小鼠肠道内菌群α多样性指数(Observed species、Chao1、Shannon和Simpson)较正常组显著下降,表明D-Gal诱导下,菌群的相对丰度及多样性降低。有报道称,肠道发生氧化应激时,肠道中耐受高氧环境的有害菌如大肠杆菌(Escherichia coli)的相对丰度增加,而耐受力较差的有益菌如乳杆菌属的相对丰度减少,正常菌群的繁殖受到抑制,从而使菌群多样性降低[31]。灌胃桑叶生物碱后可以显著提高肠道菌群的丰度及多样性,有效调整肠道菌群结构,这可能归因于桑叶生物碱显著的抗氧化活性。在Zheng Junping等[32]的研究中也发现DNJ可以显著增强高脂饮食小鼠肠道菌群的丰度及多样性,重塑肠道菌群失衡的结构。
厚壁菌门和拟杆菌门作为肠道菌群的两大优势菌门,其平衡可能在宿主生理活动中起着至关重要的作用[33]。本研究发现,与正常组相比,模型组中厚壁菌门的相对丰度显著下降,而拟杆菌门的相对丰度显著上升,菌群之间的平衡被打破。在老年人[34]及某些氧化损伤相关疾病人群中也观察到厚壁菌门相对丰度的减少及拟杆菌门相对丰度的增加,如阿尔茨海默病等[35]、帕金森症[36]等。桑叶生物碱干预可调节两大菌门的比例,显著上调厚壁菌门的相对丰度并下调拟杆菌门的相对丰度,与小檗碱的调节作用一致[37]。据报道,厚壁菌门的代表性有益作用是产生丁酸盐,属于该门类的球形梭菌和柔嫩梭菌亚群中,大多数细菌是丁酸盐产生菌[38-39]。研究表明,丁酸盐可通过抑制核因子(nuclear factor,NF)-κB活化而降低促炎细胞因子的表达缓解肠道炎症反应[40],以及刺激黏液蛋白、抗菌肽的产生保护肠道上皮屏障的完整性[41]。此外,桑叶生物碱能有效降低模型组中富集的变形菌门、脱铁杆菌门的相对丰度,其中以高剂量的桑叶生物碱作用效果最佳。据报道,变形菌门、脱铁杆菌门是肠道稳态失调的标志物之一,其相对丰度升高会产生大量内毒素,加剧肠上皮紧密连接的结构破坏,引发氧化应激反应及宿主代谢紊乱[42-43]。
在属水平上,桑叶生物碱可以显著降低模型小鼠肠道中Lachnospiraceae_NK4A136_group、螺杆菌属、Mucispirillum的相对丰度,增加双歧杆菌属及乳杆菌属的相对丰度。Lachnospiraceae_NK4A136_group、螺杆菌属是肠道内的有害菌属,其增殖会产生大量内毒素,是胃肠道疾病的标志物[44-45]。Mucispirillum是在肠道黏液层定植的致病菌,宿主发生氧化应激及炎症时其相对丰度显著增加[46]。据报道拟杆菌属与肠道炎症高度相关[47]。本研究显示模型组小鼠肠道中拟杆菌属相对丰度较正常组显著升高,桑叶生物碱干预后可以有效降低其相对丰度,但在Li Meng等[48]的研究中指出小檗碱使高脂血症大鼠体内拟杆菌属的相对丰度增加,这可能与造模方式及实验用鼠品种不同有关。乳杆菌属和双歧杆菌属是肠道中的主要有益菌属,乳杆菌属具有很强的抗氧化活性,能够降低ROS积累的风险[49];还可通过竞争性排斥作用抑制肠道中病原菌的定植,并促进紧密连接蛋白-1(tight junction protein-1,ZO-1)和闭合蛋白(Occludin)的表达,改善肠屏障功能并减轻炎症反应[50]。双歧杆菌属能够增强肠上皮屏障功能,可抑制其他病原微生物的定植[51]。
4 结 论
本研究结果表明桑叶生物碱可以显著提高小鼠肠道菌群的丰度和多样性,促进潜在有益菌的生长,从而抑制潜在有害菌的增殖,从门、属水平上有效调节D-Gal诱导的小鼠肠道菌群结构的紊乱,其中以高剂量的桑叶生物碱作用效果最佳。桑叶生物碱对模型鼠肠道菌群的调节作用可能与其能够有效清除ROS、增加相关抗氧化物质的含量有关,具体机制有待深入研究。
