鱼露中组胺降解菌的分离筛选及耐受性
2022-03-30朱翠翠王海英赵玉莹汪东风
朱翠翠, 王海英, 赵玉莹, 徐 莹, 汪东风
(中国海洋大学 食品科学与工程学院,山东 青岛266003)
生物胺是一类含氮的低相对分子质量且具有生物活性的脂肪族或杂环族有机化合物,在生物体内产生,在某些食品尤其是发酵产品中普遍存在[1]。生物胺主要由氨基酸脱羧酶作用于相应的游离氨基酸产生,精胺和亚精胺由腐胺利用亚精胺酶和精胺酶作用产生[2-3]。 一定量的生物胺对动植物和微生物有积极作用。 然而,人体摄入过量的外源性生物胺,会打乱体内生物胺的平衡[4-6]。 一般摄入超过100 mg/kg 的生物胺, 就会使人体的排毒系统受阻从而导致中毒,危害人体神经和心血管系统,甚至严重到危害生命[7]。 常见的生物胺有组胺、酪胺、尸胺、腐胺、色胺、苯乙胺、章鱼胺、精胺和亚精胺等,其中组胺毒性最强,其次是酪胺[8]。 组胺中毒表现为过敏原型反应,其特征是呼吸困难、皮疹、呕吐、发烧和高血压等[9]。 组胺中毒事件在全世界范围内均有发生。 比如,Velut 报道了一起发生于法国巴黎的黄鳍金枪鱼中毒事件, 发现煮熟的黄鳍金枪鱼中,组胺含量过高是导致人体食物中毒的主要原因[10]。李秋月等对桐乡市某公司员工中毒事件进行调查,发现熟鲐鱼肉中组胺为46.4 mg/hg, 其中进食鲐鱼者发病率为31.3%[11]。 此外,一些发酵食品中组胺含量也较高,根据已有研究,意大利半干干酪中组胺为390~400 mg/kg; 泰国549 个市售鱼露产品中组胺质量浓度为200~600 mg/L[12]。
这些食品中生物胺带来的安全性问题,已引起国际上的关注,虽然国际上对食品中的生物胺还没有统一限量标准,但部分国家根据不同食品特性给出了组胺限量标准:美国食品药品监督管理局对金枪鱼及相关鱼类中组胺的限量标准为50 mg/kg[13];2015 年我国发布的《鲜、冻动物性水产品卫生标准》中规定高组胺鱼类组胺低于40 mg/hg,其他海水鱼类低于 20 mg/hg[14];欧盟委员会第2073/2005号法规要求新鲜鱼和鱼加工产品中的组胺分别低于200 mg/kg 和 400 mg/kg[15]。
为此, 应尽可能降低相关食品中生物胺的含量,尤其是组胺的含量。 在食品生产过程中降低生物胺含量的方法主要有3 种:1)降低前体物氨基酸水平;2)抑制产胺菌(具有氨基酸脱羧酶活性)的生长;3)降低氨基酸脱羧酶活性[16]。 近年来,筛选具有降解生物胺能力的微生物,成为控制食品中生物胺的研究热点,尤其是对组胺含量的控制。 目前已筛选得到多株具有组胺降解活性的菌株,Zaman 从鱼露中筛选得到的Staphylococcus carnosus FS19 菌株能降解鱼露中质量分数29.1%的组胺[17]。 Niu 等筛选出一株Lactobacillus plantarum CAU 3823,可降解质量分数45%的组胺[18]。邓红梅等从香肠中分离得到一株Staphylococcus epidermidis PZ2,其对组胺最大减少量为65.011 μg/mL[19]。目前所筛选到的菌株,存在生物胺降解率较低,环境适应性差等问题,总体而言, 微生物降解生物胺方面的研究还比较薄弱。因此, 作者从鱼露中筛选具有高效降解组胺的菌株,对于开展生物胺降解菌株的实际应用研究以及提高发酵食品的安全性都具有重要意义。
1 材料与方法
1.1 材料与试剂
实验所用鱼露样品来自山东省威海市荣成日鑫水产有限公司。
组胺盐酸盐、尸胺二盐酸盐、腐胺二盐酸盐、色胺盐酸盐、酪胺盐酸盐、精胺盐酸盐、亚精胺盐酸盐、苯乙胺盐酸盐、章鱼胺盐酸盐:美国 Sigma 公司产品;DNS-Cl: 中国上海 aladdin 试剂公司产品;乙腈、甲醇(色谱级):德国 Merck 公司产品;盐酸二甲基对苯二胺:天津博迪化工有限公司产品;α-萘酚:上海麦克林生化科技有限公司产品;正庚烷、丙酮等所有分离用有机溶剂均为分析纯:国药集团化学试剂有限公司产品。
1.2 主要仪器与设备
Agilent 1100 型高效液相色谱仪: 安捷伦科技有限公司产品;YGC-12 型氮吹仪:郑州宝晶电子科技有限公司产品;QYC 211 型恒温振荡培养箱:上海福玛实验设备有限公司产品;SW-CJ-2F 型超净台: 苏净集团安泰公司产品;LDZX-50KBS 型立式压力蒸汽灭菌器: 上海申安医疗器械厂产品;UV-2102 PC 型紫外可见分光光度计: 上海洪福仪器仪表有限公司产品。
1.3 实验方法
1.3.1 培养基配制 MRS 培养基: 蛋白胨10 g/L、酵母粉4 g/L、葡萄糖20 g/L、牛肉浸粉8 g/L、吐温1 g/L、(三水)磷酸氢二钾 2 g/L、(三水)乙酸钠 5 g/L、柠檬酸氢二铵2 g/L、硫酸镁0.2 g/L、硫酸锰0.05 g/L。 若为固体培养基,需加入琼脂 20 g/L,121 ℃高压灭菌20 min。
LB 培养基: 胰蛋白胨 10 g/L、 酵母膏 5 g/L、NaCl 10 g/L。 若为固体培养基,需加入琼脂20 g/L,121 ℃高压灭菌20 min。
YPD 培养基:蛋白胨 20 g/L、酵母膏 10 g/L、葡萄糖20 g/L。 若为固体培养基,需加入琼脂20 g/L,121 ℃高压灭菌20 min。
用于生物胺鉴别的双层显色培养基[20]:1)下层培养基, 分别在MRS、LB 或YPD 固体培养基上加入0.05 g/L 的磷酸吡哆醛以及混合氨基酸(色氨酸、苯丙氨酸、组氨酸、赖氨酸、酪氨酸、精氨酸、鸟氨酸各 5 g/L),pH 5.2, 分别命名为 MRSA、LBA、YPDA;2)上层培养基,溴甲酚紫 0.06 g/L、琼脂 20 g/L,pH 5.2,121 ℃高压灭菌 20 min, 冷却至室温倒平板。
加生物胺液体培养基: 在 MRS、YPD 和 LB 液体培养基上加入9 种生物胺各50 mg/L。 分别命名为 MRSB、YPDB、LBB。 若为固体培养基,需加入琼脂 20 g/L,121 ℃高压灭菌 20 min。
1.3.2 生物胺降解菌的初筛 样品处理:将鱼露样品置于无菌装置器中, 保持低温并运回实验室,在无菌操作环境下将鱼露样品进行分装。
取5 g 鱼露样品于100 mL 无菌生理盐水中,摇床振荡 30 min, 取 1 mL 液体分别加到 MRS、LB 和YPD 液体培养基中,培养24 h。 取出1 mL 培养液,用无菌水按照 1×103、1×104、1×105、1×106、1×107、1×108倍稀释富集的微生物, 然后每个样品取200 μL 稀释液分别涂布于MRSA、LBA 下层培养基上,37 ℃培养,同时涂布于YPDA 下层培养基上,28 ℃培养48 h 后取出,再将上层培养基(50 ℃左右)倒入上述下层培养基(MRSA、LBA 和 YPDA),继续培养,观察并记录实验结果,菌株显紫色的为阳性(即产生物胺菌),不变色或显黄色为阴性菌(不产生物胺菌)[20-21]。 挑取阴性菌落并分离纯化3 次,保存在斜面培养基上,4 ℃保藏备用。
对获得的阴性菌进行氧化酶实验,检测其是否具有氧化酶活性,实验步骤为:取单菌落于无菌白色滤纸, 加入20 μL 质量分数1%的盐酸二甲基对苯二胺溶液,呈现粉红色,则为阳性,再加入适量质量分数1%的α-萘酚乙醇溶液,于30 s 内呈现蓝色并逐渐加深,视为阳性,阴性则不变色,结果呈阳性的为所需菌株[22]。
1.3.3 生物胺降解菌的复筛 将1.3.2 获取的阴性菌株,接种于MRS、LB 和YPD 斜面培养基上,分别在37 ℃和 28 ℃下培养 24 h 后, 进行2 次斜面活化,备用。
种子液制备:从活化好的斜面培养基中,挑取单菌落,接种于MRS、LB 和YPD 液体培养基中,分别在37 ℃和28 ℃下,以 180 r/min 振荡培养24 h。
用生理盐水 (含生物胺50 mg/L) 调整菌液浓度, 取 1 mL 菌液接种到 MRSB、YPDB、LBB 培养基中,72 h 后,在 4 ℃下以 3 500 r/min 离心 10 min,取上清液备用, 对照组为不加菌液的含胺液体培养基。采用DNS-Cl 进行衍生,利用HPLC 法测定样品中生物胺含量,经计算得降胺率,从中筛选降胺效果较好的菌株,并进行保藏。
1.3.4 生物胺降解率的测定 准确称取1.00 g 鱼露样品于10 mL 容量瓶中, 加入0.1 mol/L 的 HCl定容至 10 mL, 超声 2 min,4 ℃下以3 500 r/min离心10 min,取上清液,即为生物胺提取液。
参考文献[23-24]中生物胺的衍生方法并略微修改。 称取样品 0.5 mL,加入 100 μL 2 mol/L NaOH和150 μL 的饱和碳酸氢钠溶液与之混合,再加入1 mL 10 mg/mL 的 DNS-Cl(用丙酮溶解),在 40 ℃以200 r/min 振荡培养, 水浴反应45 min。 再加入50 μL 体积分数25%的氨水,25 ℃下静置30 min,加入3 mL 正庚烷萃取,振荡混匀后,静置分层,取上层有机相于10 mL 离心管中,40 ℃下用氮气吹干, 取1 mL 乙腈使残留物完全溶解, 用0.22 μm 的有机膜过滤后加入进样小瓶,测定后计算降解率。
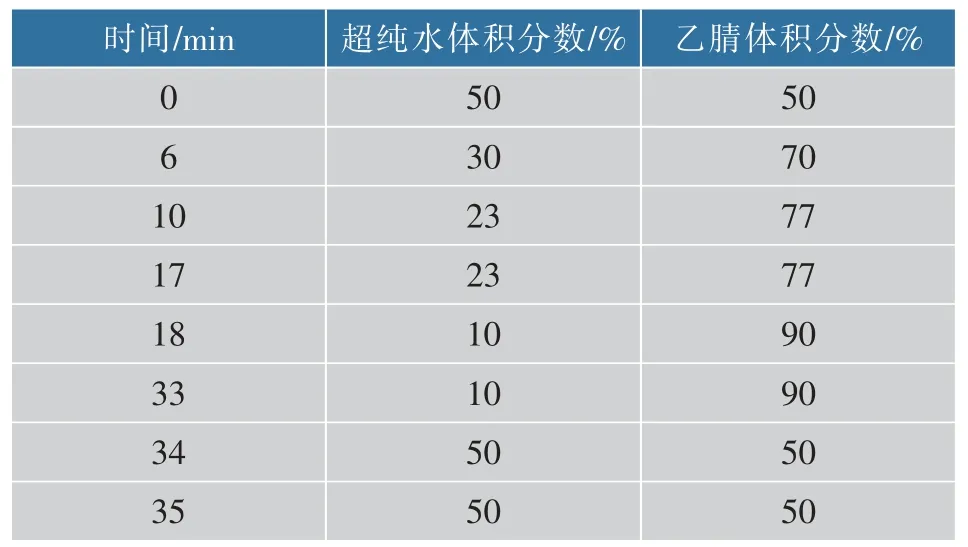
表1 HPLC 测定生物胺梯度洗脱程序Table 1 Determination of biogenic amines gradient elution procedure by HPLC
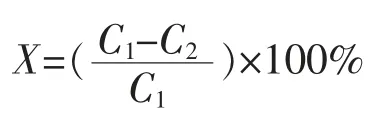
式中:X 为生物胺降解率,%;C1为不含菌株的空白样品生物胺质量浓度,mg/L;C2为接种菌株的样品生物胺质量浓度,mg/L。
1.3.5 生物胺降解菌株的菌种鉴定 将菌株接种于液体MRS 培养基中,37 ℃下以180 r/min 振荡培养 24 h, 取 1 mL 菌液于 1.5 mL 无菌离心管中,12 000 r/min 离心 2 min 收集菌体,100 ℃水浴 2 min 后液氮速冻, 重复上述步骤 5 次, 备用。 使用ITS-1(5′-TCCGTAGGTGAACCTGCGG-3′)和 ITS-4(5′-TCCTCCGCTTATTGATATGC-3′)引物进行菌落PCR 扩增, 扩增体系为 50 μL:45 μL 金牌 Mix(green)、2 μL ITS1、2 μL ITS4、1 μL 模板 DNA。 扩增程序如下:98 ℃预变性5 min 后进入循环,98 ℃变性 30 s,55 ℃退火 30 s,72 ℃延伸 45 s, 循环 30次,72 ℃修复延伸 10 min,4 ℃终止反应。将 PCR 产物送往青岛擎科公司进行测序,登录NCBI,将所得序列与数据库已知序列进行相似性比对。
1.3.6 环境因素对降胺菌生长及降胺能力的影响对 1.3.3 保藏的 P. kudriavzevii-MZ5 菌株, 在 MRS液体培养基中进行活化培养,4 ℃下以3 500 r/min离心10 min,收集菌体,使用无菌生理盐水将菌液制备成 1.0×108CFU/mL 的菌悬液。 取 1 mL 菌液接种到50 mL MRS 液体培养基中,其中,组胺质量浓度梯度设为 10、30、50、70、100、200 mg/L;pH 梯度设为 3、4、5、6、7、8、9, 组胺质量浓度均为 50 mg/L;NaCl 溶液质量浓度梯度设为 2、4、6、8、10、12、14、16、18、20 g/dL,组胺质量浓度均为 50 mg/L;乙醇体积分数梯度为 2.5%、5%、7.5%、10%、15%、20%、25%,组胺质量浓度均为50 mg/L。 对照组为对应不加组胺的MRS 液体培养基,37 ℃以180 r/min 振荡培养72 h 后取样, 按照1.3.4 检测培养液中剩余组胺质量浓度。
2 结果与分析
2.1 生物胺降解菌的初筛
双层显色板法是根据平板的颜色变化,甄别并挑选出能利用生物胺且不产生物胺的微生物。 如图1 所示,阳性样本经过双层显色板法培养后,由于生物胺的产生,导致培养基pH 升高,使得上层培养基中的溴甲酚紫(变色范围:pH 5.2~6.8,由黄色变为紫色)出现颜色反应[21],即显紫色,而不变色或显黄色的为阴性菌株, 并对阴性菌株进行胺氧化酶实验。 初步分离出25 株阴性菌株 (如图1 中圈出菌落),可能是潜在的降胺菌株,胺氧化酶实验结果见图2,结果表明阴性菌株具有较强的胺氧化酶活性,故将其作为后续研究对象。
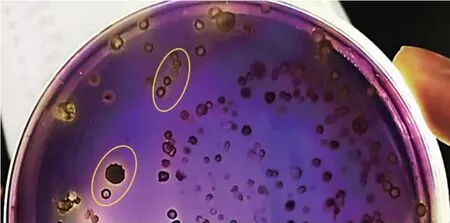
图1 双层显色板法对生物胺降胺菌的分离筛选Fig. 1 Separation and screening of bioamine-lowering strains by double-layer chromogenic board method

图2 胺氧化酶实验结果Fig. 2 Results of amine oxidase experiment
2.2 生物胺降解菌的复筛
当 25 株阴性菌株分别在 MRSB、YPDB、LBB 中培养24 h,生物胺降解率见表2,以组胺降解率大于10%为初筛选对象, 筛选到的菌株有 MZ1、MZ5、YR1、YM3。 将上述 4 株菌株培养 72 h,生物胺降解效果见表3。 4 株菌株组胺降解率均在78%以上,具有较强的组胺降解活性。其中MZ5 的组胺降解率最高,能达到91.97%,同时也发现,该菌株对其他生物胺降解率也优于另外3 株。 所以,经复筛得到的菌株,尤其是MZ5 能够在营养丰富的环境下利用生物胺,也能够适应更为复杂的发酵环境,故将其作为后续研究对象。
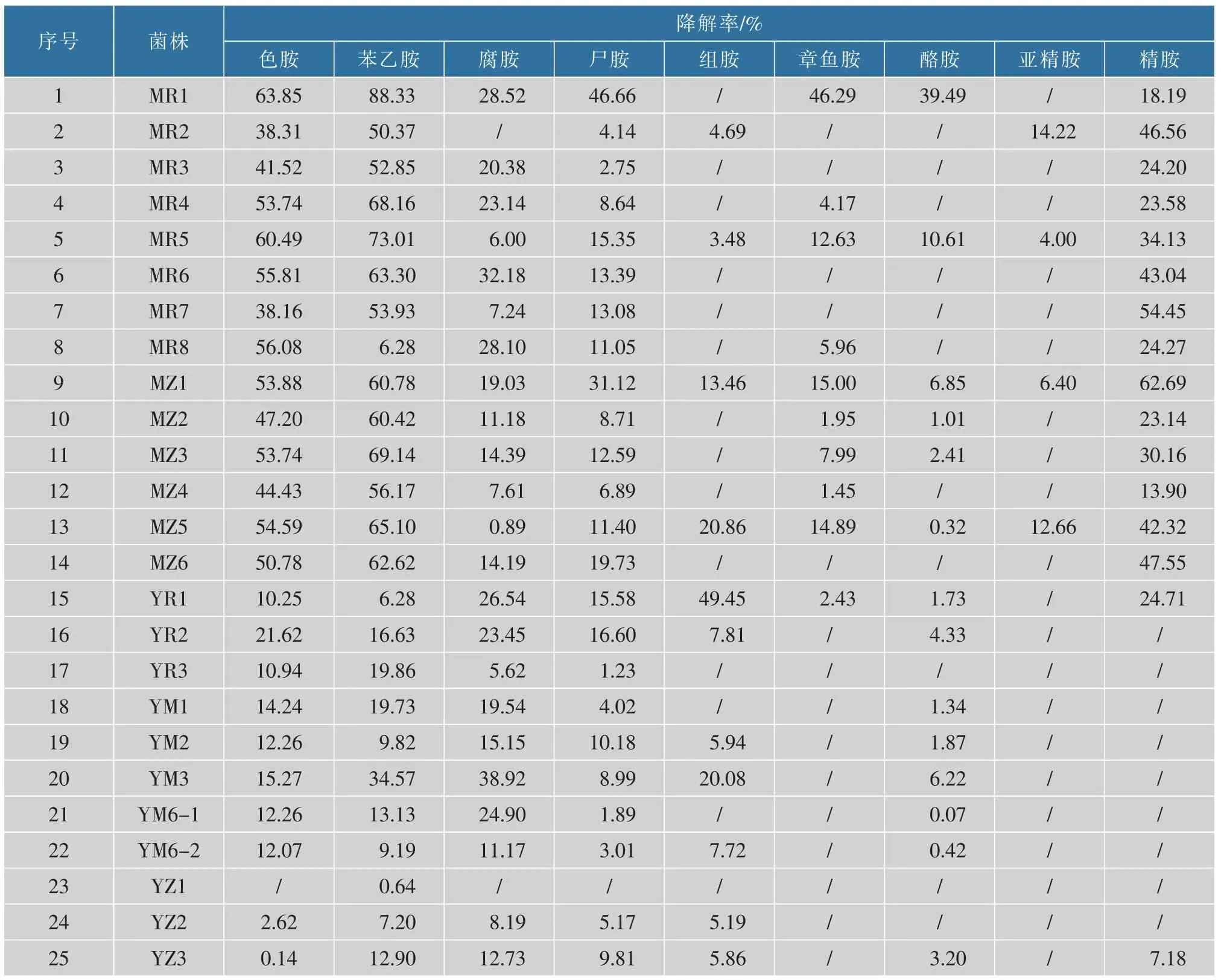
表2 25 株潜在降胺菌培养24 h 后的复筛降胺效果Table 2 Secondary screening effect of 25 potential amine-lowering strains cultured for 24 h
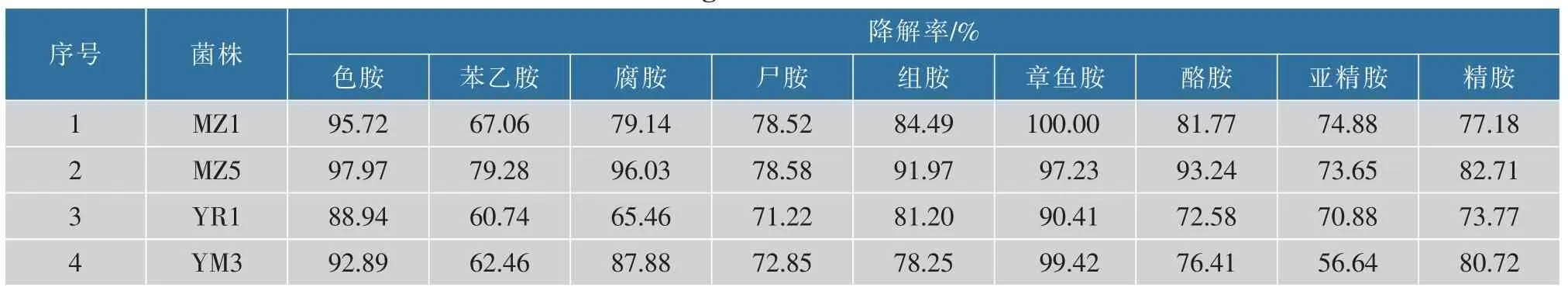
表3 4 株菌株培养72 h 后的降胺效果Table 3 Amine-lowering effects of 4 strains cultured for 72 h
2.3 MZ5 的菌种鉴定结果
通过青岛擎科公司进行ITS rRNA 基因测序,测序结果经NCBI 上的BLAST 对比,结果发现MZ5菌株与库德毕赤酵母的相似度达到99.72%,则认定该菌株为库德毕赤酵母 (Pichia kudriavzevii,GenBank accession number:MW642244), 且 MZ1、YR1 和YM3 的NCBI 比对结果也均为库德毕赤酵母。 库德毕赤酵母是发酵食品(牛奶乳清[25])中的常见菌,在多种其他食品中也有存在[26]。此前没有文献报道该菌具有降解生物胺的能力。 另外,对比已报道的生物胺降解菌, 如张楠筛选的 3 株菌株Lactobacillus plantarum 、Pediococcus pentosaceus 、Weissella cibaria, 混合接种于川辣香肠中, 可降低30.27%的组胺[27];Lee 等筛选的多粘芽孢杆菌D05-1应用于咸鱼中, 可降低34.00%的组胺和30.00%的总 生 物 胺 ( 均 为 质 量 分 数 )[28]。 该 菌 株 (P.kudriavzevii-MZ5) 可以降解组胺等9 种生物胺,组胺降解率更高,后续将开展将其用于具体发酵食品降解组胺的研究。
2.4 P. kudriavzevii-MZ5 菌株耐受性
2.4.1 P. kudriavzevii-MZ5 菌株的生长曲线 在 MRS、MRSB 培养基中 P. kudriavzevii-MZ5 培养72 h 的生长曲线见图3。 可知该菌株在0~3 h 内处于迟滞期,在3 h 后生长迅速,在24 h 时OD600已经由 3 h 时的 0.1 增加到 0.8, 表明从 3 h 开始,P. kudriavzevii-MZ5 菌株进入对数生长期, 大约到24 h 时生长趋于稳定。 此外,生物胺的存在并没有对菌株的生物量造成影响, 表明P. kudriavzevii-MZ5 菌株对生物胺的耐受能力较强,但也未表现出生物胺对生长的促进效应。
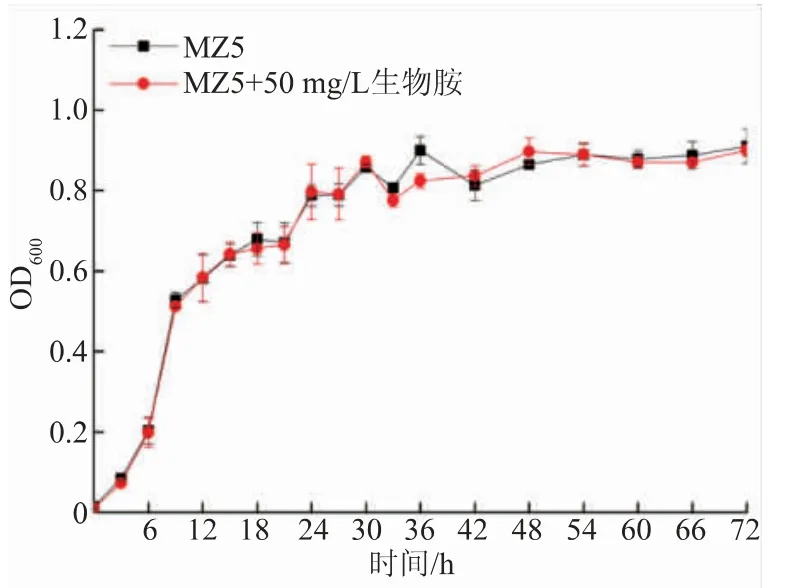
图3 P. kudriavzevii-MZ5 在无生物胺和含生物胺培养基中的生长曲线Fig. 3 Growth curves of P. kudriavzevii-MZ5 in biogenic amine-free and biogenic amine-containing media
2.4.2 初始组胺质量浓度的影响 研究结果表明,该菌株在3 h 时开始进入对数生长期,将MZ5 接种到含不同初始组胺质量浓度的培养基中培养72 h后,分析其组胺降解率,结果见图4。P. kudriavzevii-MZ5 菌株在组胺质量浓度为10~200 mg/L 的降解率可达52.34%以上,其中质量浓度为50 mg/L 时降解率最高,为82.61%。 组胺质量浓度对其生长无影响,但对组胺降解率有影响,这可能是由于适量的组胺质量浓度(0~50 mg/L)存在底物诱导效应,随着组胺质量浓度的增加,组胺降解率增加;高质量浓度(50~200 mg/L)组胺对其生长没有影响,但随着组胺质量浓度升高组胺降解率下降,说明培养基中初始组胺质量浓度高时,P. kudriavzevii-MZ5 对组胺的有效降解能力受到抑制。 可能是环境中高质量浓度的组胺未被转运到菌体内,而胺氧化酶等生物胺降解酶都是胞内酶,酶与底物的空间距离阻碍最终导致生物胺降解能力下降;也可能是胞内高质量浓度组胺降低了组胺降解酶的活性或者表达量。
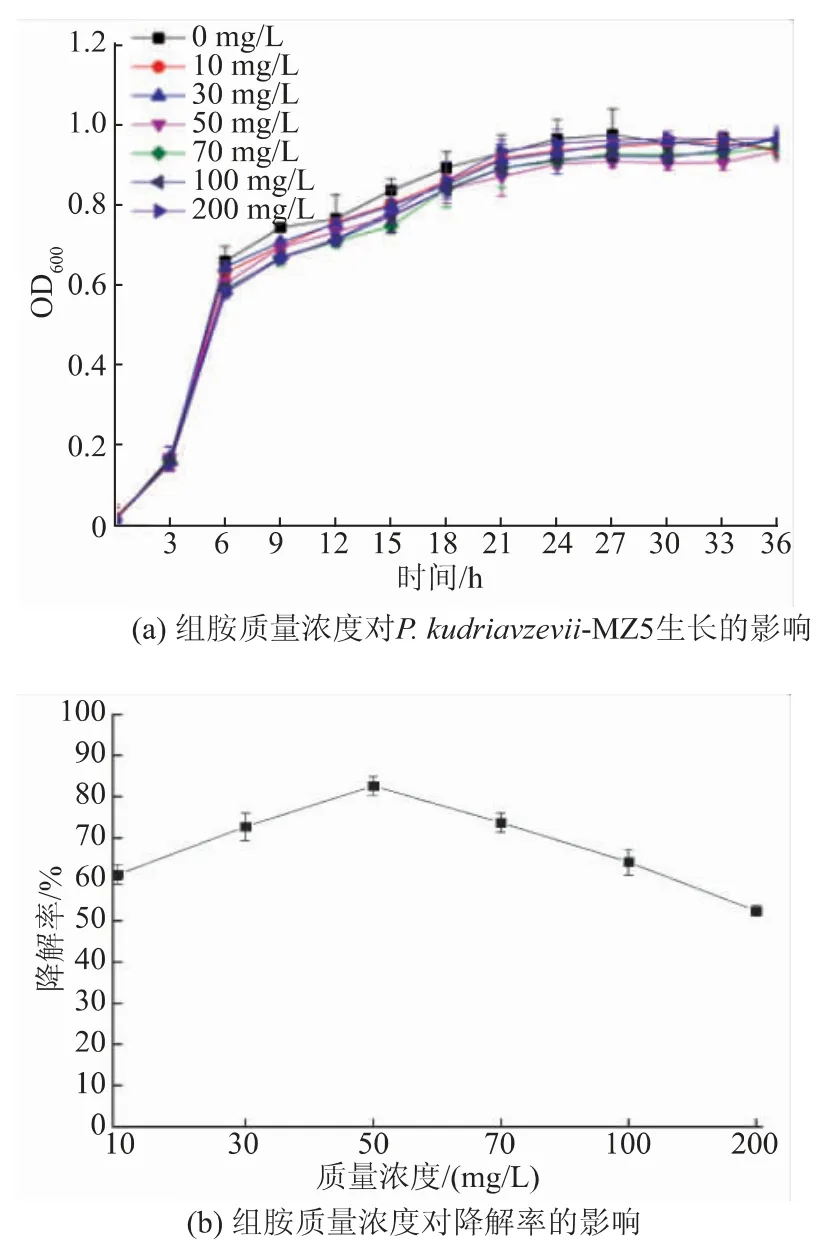
图4 组胺质量浓度的影响Fig. 4 Effects of histamine mass concentrations
2.4.3 乙醇的影响 从图5 可以看出,随着乙醇体积分数的增加, 菌液的 OD600逐渐下降,即P. kudriavzevii-MZ5 的生长曲线呈现下降趋势,在乙醇体积分数 10%~25%时, 对应的 OD600低于0.026,菌株生长受到抑制。 乙醇体积分数为5%时,对应的组胺降解率最高,可达73.01%;乙醇体积分数大于5%时,组胺降解率下降;当乙醇体积分数为10%时,对应的组胺降解率为1.02%。 这可能是高含量乙醇抑制了微生物生长,进而组胺降解代谢活动也受到影响。
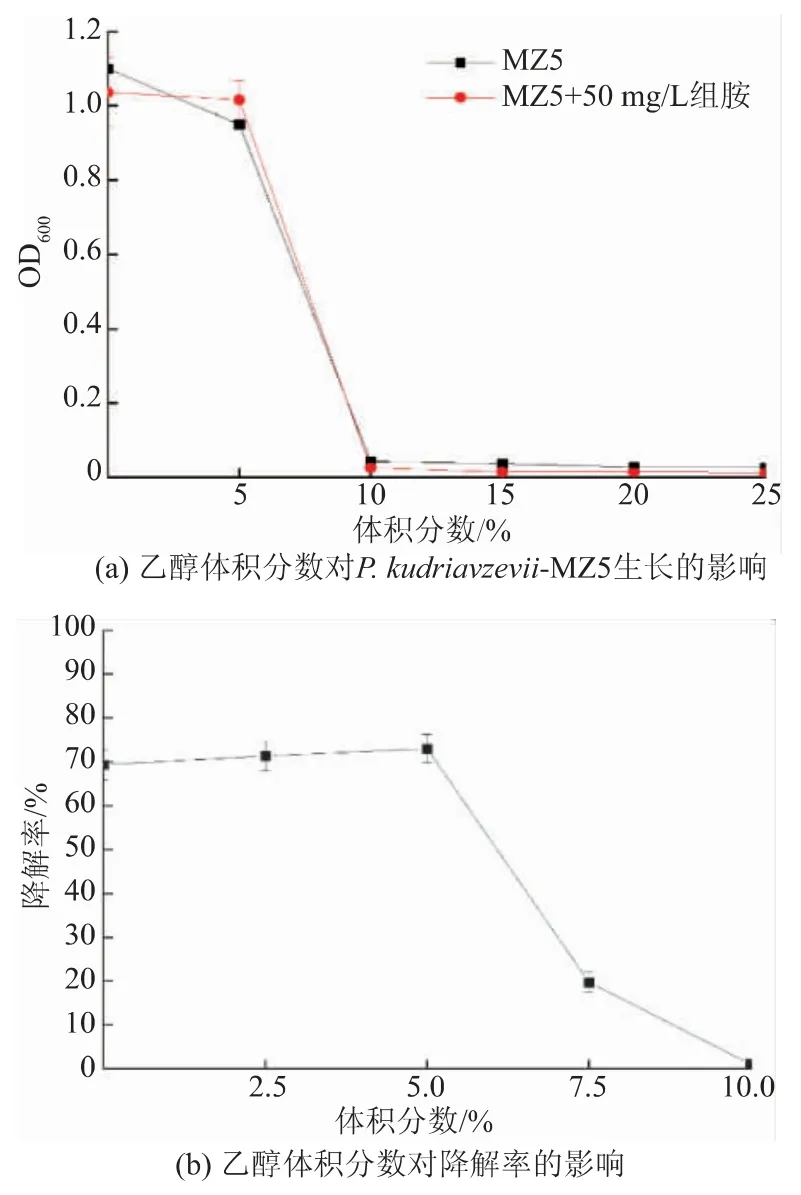
图5 乙醇体积分数的影响Fig. 5 Effect of ethanol volume fraction
2.4.4 pH 的影响 随着pH 的增加,环境中组胺对P. kudriavzevii-MZ5 的生长并无显著影响。 从图6可知,MZ5 菌株可在pH 3~9 的环境下生长。 在pH 3~5 时,该菌株的生物胺降解率和生物量随着pH 升高而增加,这可能由于低pH 环境下,菌株的生长较为缓慢,导致生物量不高,或者在该环境中的胺氧化酶活性较低[29];当pH 大于7 时,该菌株生物胺降解率随pH 升高而降低,这可能是因为pH 对酶活性造成了影响,其中在pH 为7 时,组胺降解率最高可达98.61%。
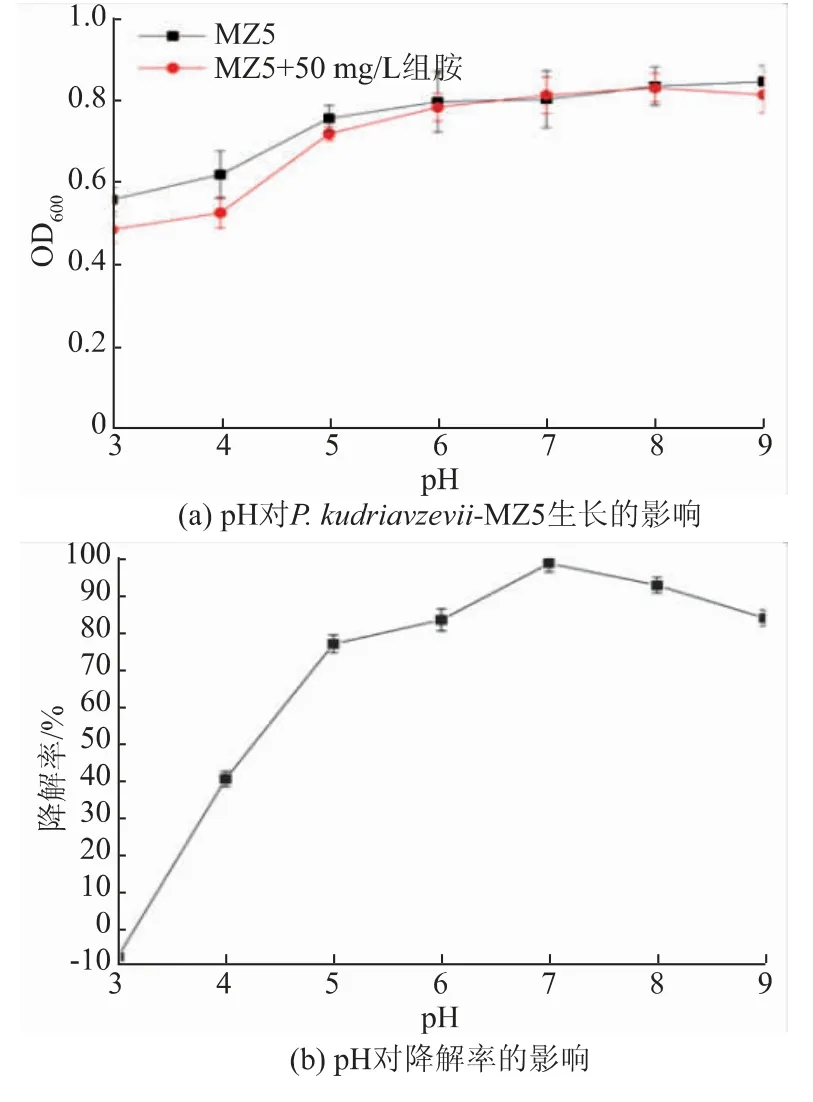
图6 pH 对菌株生长及生物胺降解率的影响Fig. 6 Effects of pH on the growth of strains and the degradation rate of biogenic amine
2.4.5 盐度的影响 在NaCl 质量浓度低于12 g/dL时,P. kudriavzevii-MZ5 的生物量在有组胺的培养基中高于无组胺的培养基, 当NaCl 质量浓度高于12 g/dL 时,MZ5 的生长受到限制 (见图 7)。 随着NaCl 质量浓度增加, 该菌株的降组胺效果逐渐降低,质量浓度0~2 g/dL 以内可维持75.79%~86.84%的组胺降解率,质量浓度在4~8 g/dL,组胺降解率为35.19%~42.15%,NaCl 质量浓度高于 10 g/dL 时该菌基本无组胺降解能力(低于1%)。 这可能是因为高质量浓度的盐抑制了菌株的生长,也可能是因为高质量浓度的盐抑制了菌株氧化酶的活性[30]。 还可能是高盐导致酵母菌细胞壁增厚,细胞膜渗透性受到影响,进而影响了胞外组胺进入胞内的速度和数量。
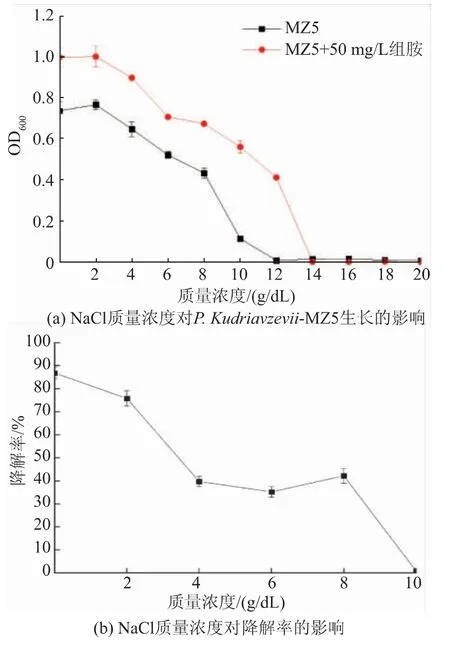
图7 NaCl 质量浓度对菌株生长及组胺降解率的影响Fig. 7 Effects of NaCl mass concentrations on the growth of strains and the degradation rate of biogenic amine
3 结 语
从传统发酵鱼露中筛选出25 株潜在降胺菌,通过生物胺降解能力和组胺降解率的检测,从MRS培养基中选出一株降解组胺能力最高的菌株MZ5。经鉴定该菌株为Pichia kudriavzeii。 P. kudriavzevii的生物量不受组胺初始质量浓度的影响,但其生长和降解组胺的能力均受到乙醇、pH 和盐等因素不同程度的影响,更多影响因素和机理还需要继续开展研究。 该菌株可作为发酵制剂应用于发酵食品中降低组胺含量,为发酵制品的工业化生产和安全性提供良好的理论依据。
