代谢工程改造大肠杆菌利用脂肪酸合成己二酸
2022-03-30闫亚楠赵春雷刘立明陈修来
李 洋 , 闫亚楠 , 赵春雷 , 郭 亮 ,3, 高 聪 ,3, 刘立明 ,3, 陈修来 *,3
(1. 食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2. 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;3. 江南大学 食品安全国际合作联合实验室,江苏 无锡 214122)
己二酸作为一种重要的脂肪族二元酸, 在食品、医药、塑料和化学等领域具有广泛的应用[1-4]。2004 年, 己二酸被美国能源部认定为12 种能利用可再生生物质原料生产的高附加值化学品之一,年产量达285 万吨,增长率为4.1%[3-5]。目前,己二酸的生产主要依赖于化学法,该过程不仅产生大量的温室气体,同时也有较多的副产物,导致己二酸产率较低。 因此,基于细胞工厂的生物合成法受到越来越多的关注,即:利用可再生生物质原料高效、持续地合成己二酸[6-8]。
近年来,关于己二酸的生物合成主要集中在两个方面:1)间接发酵法:将可再生生物质原料首先转化为合成己二酸的前体物质 (顺, 顺-粘糠酸或D-葡糖二酸),随后经化学法生成己二酸[3]。 已有研究表明烯醇还原酶可以催化顺, 顺-粘糠酸生成己二酸,例如,通过构建大肠杆菌(Escherichia coli)共培养系统,葡萄糖经莽草酸路径转化为顺,顺-粘糠酸, 随后利用透明颤菌的血红蛋白降低溶氧量,最终在烯醇还原酶的作用下生成27.6 mg/L 己二酸[9]。但是该酶仅在厌氧条件下才能发挥最大催化效率,难以满足工业化生产的需求[9]。 2)直接合成法:乙酰CoA 和琥珀酰 CoA 在 β-酮基己二酰 CoA 硫解酶(PaaJ)、5-羟基脂酰 CoA 还原酶(PaaH1)、烯酰 CoA水化酶(Ech)、反式-烯酰 CoA 还原酶(Ter)、丁酰激酶(Buk1)和磷酸式丁酰转移酶(Ptb)的共同作用下转化为己二酸[10]。例如,通过构建己二酸合成路径并阻断乙酸、 乳酸等副产物生成, 工程菌株E. coli MB263(ΔsucD)能够产生 2.5 g/L 己二酸,但是产率仅达到了理论产率的9.6%[10]。 另外,将源于褐色嗜热裂孢菌 (Thermobifida fusca) 的逆己二酸降解路径,在E. coli BL21 中进行重构与优化,最终工程菌株E. coli Mad123146 产生68.0 g/L 己二酸,这是目前所报道的最高产量(见表1)。然而,由于碳原子损失,己二酸产率仅有0.378 g/g(以甘油质量计)[5]。

表1 代谢工程改造微生物生产己二酸Table 1 Production of adipic acid in the metabolically engineered microorganisms
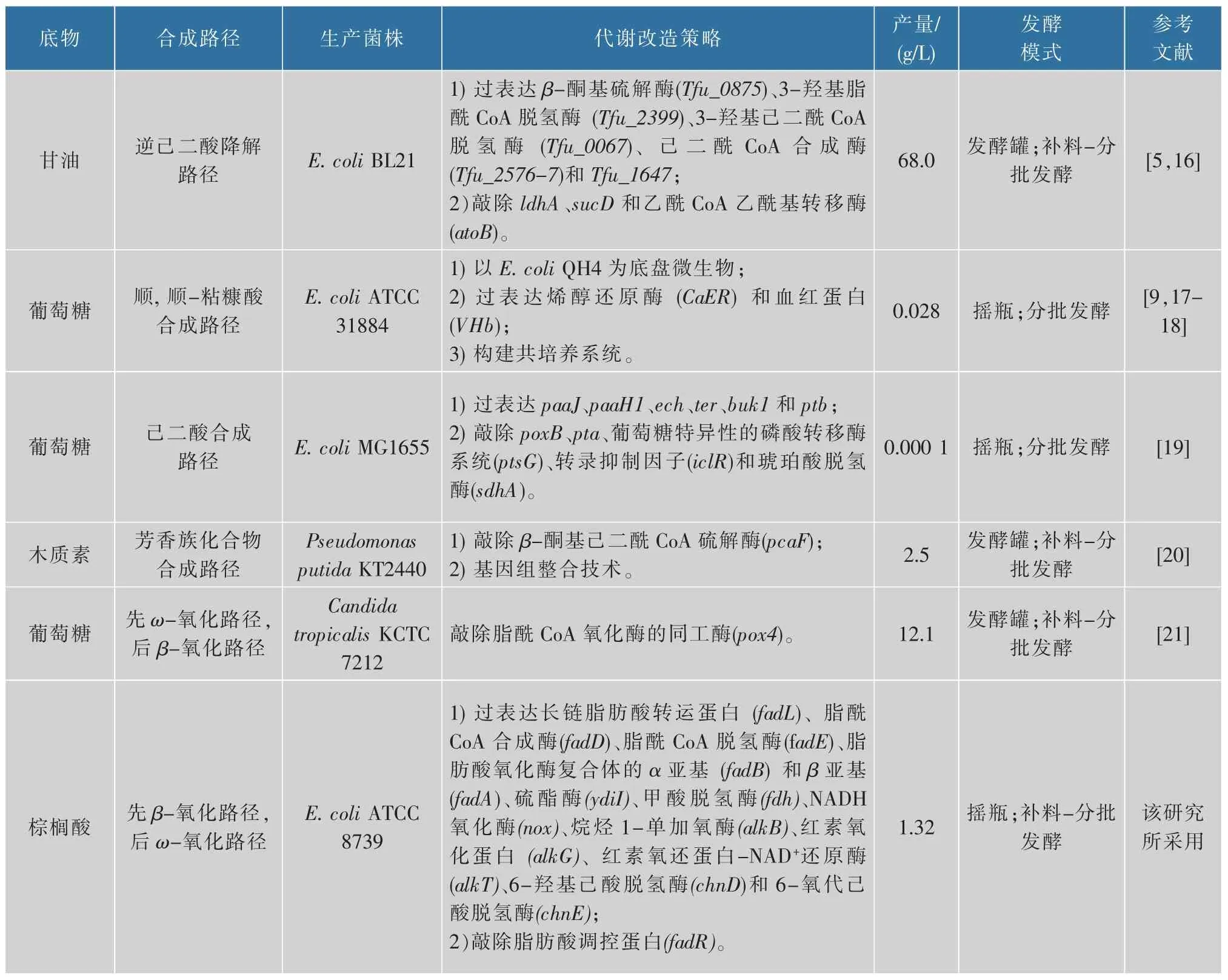
续表1
为了进一步提高生物法合成己二酸在工业化生产上的竞争力,开发高效合成己二酸的微生物细胞工厂受到越来越多的关注。 脂肪酸,作为自然界中广泛存在的可再生原料,具有高效生产高价值化学品的潜力:一方面,脂肪酸的使用避免了与可食用粮食作物的竞争,降低了生产成本;另一方面,经脂肪酸分解代谢可实现碳回收率100%, 理论上具有最高的产品产率[11-12]。 例如,通过强化脂肪酸代谢路径,获得了一株能够高效利用棕榈酸的工程菌株E. coli HP08,3-羟基丙酸的得率达到了1.56 g/g(以棕榈酸质量计),远高于其他原料[12]。然而,利用脂肪酸生产己二酸的研究较少,主要原因在于缺乏特异性催化中链脂肪酸的细胞色素P450 还原酶, 代谢辅因子不平衡,底物或产物抑制严重等[13-14]。 因此,构建一种能够高效利用脂肪酸生产己二酸的微生物细胞工厂,有助于实现经济和环境的双收益。
为了开发能够利用脂肪酸合成己二酸的细胞工厂,作者首先结合β-氧化路径和ω-氧化路径,设计并构建了一条新型的己二酸合成路径; 其次,采用融合蛋白、RBS 组合优化、 基因敲除等策略优化了己二酸合成路径;最终,通过发酵条件优化,提高了己二酸的积累量,为利用脂肪酸生产其他高价值化学品奠定了良好的基础。
1 材料与方法
1.1 实验材料
1.1.1 菌种和质粒 作者使用的大肠杆菌E. coli JM109 和E. coli ATCC 8739 分别用于表达载体的构建和生产菌株,其中所使用的基因工程菌和重组质粒分别见表2 和表3。
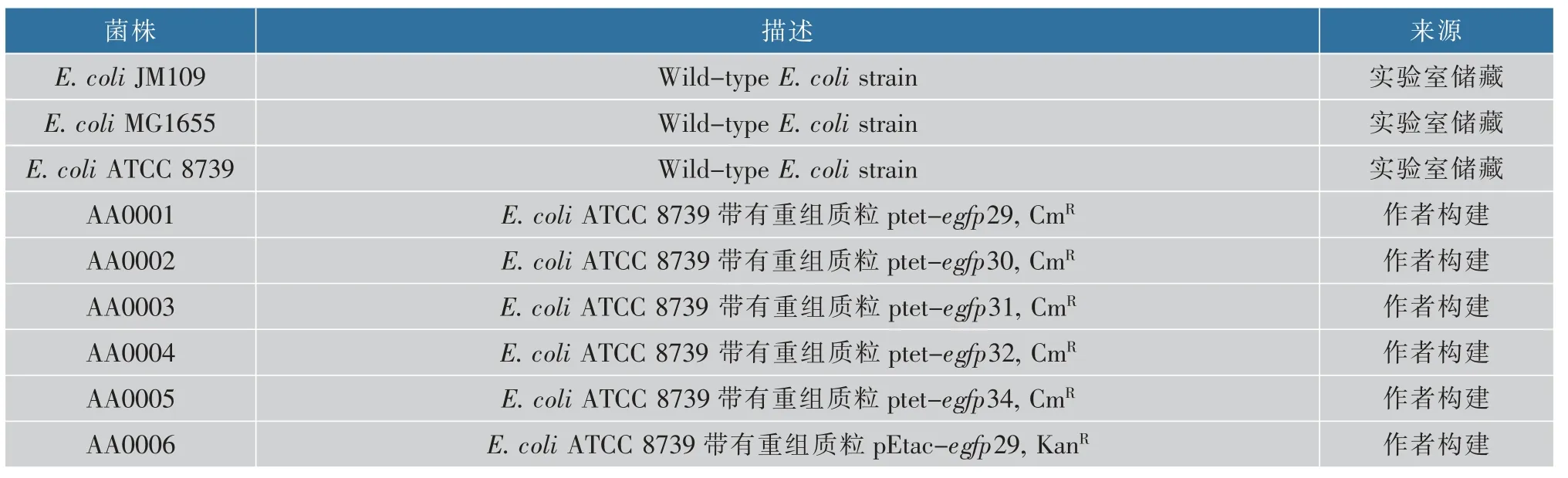
表2 研究所使用的菌种Table 2 Strains used in this study

表3 研究所使用的重组质粒Table 3 Plasmids used in this study

续表3
1.1.2 主要仪器和试剂 PCR 扩增仪、全自动凝胶成像系统、电穿孔仪、核酸电泳仪:美国Bio-rad 公司产品;恒温培养箱:上海跃进医疗器械厂产品;紫外可见分光光度计: 日本岛津公司产品;SBA 生物传感器:山东科学院生物研究所产品;精密pH 计:瑞士METTLER 公司产品;XD-650D 超声破碎仪:南京先欧仪器制造有限公司产品;Invitrogen iBright智能成像系统: 赛默飞世尔科技有限公司产品;5804R 型高速离心机: 德国Eppendorf 公司产品;CHB-202 恒温金属浴: 日本 Bioer Technology 公司产品;气相色谱仪:日本岛津公司产品。
限制性内切酶、Prime Star 高保真酶、Taq DNA聚合酶、T4 DNA 连接酶、DNA marker:购自 TaKaRa(大连)有限公司;一步同源重组酶:购自南京诺唯赞生物科技有限公司;质粒提取试剂盒、胶回收试剂盒、产物纯化试剂盒、氨苄青霉素、硫酸卡那霉素、氯霉素、盐酸大观霉素、阿拉伯糖、异丙基硫代半乳糖苷(IPTG):购自生工生物工程(上海)公司;细菌基因组提取试剂盒:购自天根公司;棕榈酸、正己酸、己二酸、Brij 58、N,O-双(三甲基硅烷基)三氟乙酰胺和三甲基氯硅烷:购自上海阿拉丁生化科技股份有限公司;PCR 引物由苏州金唯智生物科技有限公司合成;其他试剂购自国药集团化学试剂有限公司。
1.1.3 培养基 大肠杆菌的前培养在LB 培养基中进行,TB 培养基用于培养细胞进行全细胞转化生产正己酸和己二酸, 而己二酸的发酵生产在M9 无机盐培养基中进行。
LB 培养基:酵母粉 5 g/L、蛋白胨 10 g/L、NaCl 10 g/L。 LB 固体培养基额外添加20 g/L 的琼脂粉。
TB 培养基:酵母粉 24 g/L、胰蛋白胨 12 g/L、甘油 4 g/L、K2HPO42.31 g/L、KH2PO4·3H2O 16.42 g/L。
M9 无机盐培养基:Na2HPO4·12H2O 15.11 g/L、KH2PO43 g/L、NH4Cl 1 g/L、NaCl 0.5 g/L、MgSO4·7H2O 0.25 g/L、 微量元素液1 mL/L 和10 g/L 葡萄糖或棕榈酸。
微量元素液:FeCl3·12H2O 2.4 g/L、CoCl2·6H2O 0.3 g/L、CuCl20.15 g/L、ZnCl2·4H2O 0.15 g/L、NaMnO40.3 g/L、H3BO30.075 g/L、MnCl2·4H2O 0.5 g/L, 溶于0.1 mol/L HCl。
以上培养基均在121 ℃条件下灭菌15 min。
1.2 实验方法
1.2.1 重组质粒的构建 所有表达质粒的构建均通过标准分子克隆操作和吉布森组装法,其中一步同源重组法是根据目的片段与表达载体之间具有相同序列连接的方法。 采用的 fadL、fadD、fadE、fadB、fadA 基因来源于 E. coli MG1655,而来自恶臭假单胞菌 (Pseudomonas putida) 的 alkB、alkG、alkT基因和不动杆菌属(Acinetobacter sp. SE19)的chnD和chnE 基因在苏州金唯智生物科技有限公司进行密码子优化和合成。 此外,辅因子再生系统中来源于博伊假丝酵母(Candida boidinill)的fdh 基因和大肠杆菌本源的nox 基因也进行密码子优化和合成。所有引物在苏州金唯智生物科技有限公司合成(见表4),同时重组质粒的Sanger 测序在天霖生物科技无锡有限公司进行。

表4 研究所使用的引物Table 4 Primers used in this study

续表4
以E. coli MG1655 基因组为模板, 用引物对fadLEc-S/A 和 ydiIEc-S/A 分 别扩增 fadL 和 ydiI 基因, 经同源重组连接至载体ptet 的EcoR I/Hind III位点产生质粒ptet-YL1。 随后,用引物对fdhBc-S/A和noxEc-S/A 分别扩增目的片段fdh 和nox 并连接至质粒ptet-YL1 的Bgl II/Hind III 位点, 得到表达载体ptet-YL2。
以E. coli MG1655 基因组为模板, 用引物对fadDEc-S/A 扩增 fadD 片段并连接至质粒 pEM 的BamH I/Sac I 位点。 与此同时,经引物对fadAEc-S/A和fadBEc-S/A 扩增得到的目的片段fadA 和fadB 连接至pEM 得到pEM-fadB-fadA,随后酶切连接产生pEM-fadD-fadB-fadA。 最后, 把引物对 fadEEc-S/A扩增的fadE 片段连接至pEM-fadD-fadB-fadA 的Spe I/Pst I 位点, 产生表达载体 pEM-YL1。 除此之外, 含有片段FadA 和FadB 的融合蛋白通过“GGT GGT GGT TCT”形成的Linker 连接,得到载体pEMYL2 和 pEM-YL3。
以质粒 pET28a-YL1 和 pET28a-YL2 为模板,分别用引物对alkBPpu-S/A 和alkGPpu-S/A 扩增片段alkB 和 alkG 并连接至质粒 pEtac 的 EcoR I/Sal I 位点。 随后,chnD 和 chnE 基因连接至 pEtac-alkB-alkG 的 Sal I/Hind III 位点形成 pEtac-alkB-alkG-chnD-chnE。最后,把引物对alkTPpu-S/A 扩增的alkT基因连接至pEtac-alkB-alkG-chnD-chnE 的Spe I/Sal I 位点,获得表达载体 pEtac-YL1。 另外,表达载体pEtac-YL2/3/4/5 采用相同的方法构建。
E. coli ATCC 8739 的转化采用电击转化的方式,随后涂布于含有相应抗性的筛选平板,挑选转化子并提取质粒进行PCR 验证,产生一系列工程菌株生产正己酸和己二酸。 除此之外,从基因组上敲除fadR 基因采用CRISPR-Cas9 系统, 具体方法参照 Zhao 等的研究[5]。
1.2.2 全细胞转化法生产己二酸 将前培养的培养液转接至150 mL TB 培养基培养, 当 OD600达0.6~0.8 时加入 0.43 mol/L IPTG 或 400 ng/mL 无水四环素诱导路径酶的表达,并将温度调至30 ℃培养12 h。随后,培养液于4 ℃下以6 000 r/min 离心10 min,收集菌体并保存至-40 ℃冰箱作为生物催化剂。
对于棕榈酸降解生成正己酸, 转化体系包括39.1 mmol/L 棕榈酸、10.0 mmol/L ATP、10.0 mmol/L FAD、10.0 mmol/L NAD+、10.0 mmol/L CoA-SH、39.1 mmol/L MgSO4·7H2O, 用 Na2HPO4-柠檬酸缓冲液(pH 7.0)定容至 10 mL,菌体量为 30 g/L,反应条件为30 ℃下3 d。 发酵液用于气质测定。
对于正己酸转化生产己二酸, 转化体系包括86.0 mmol/L 正己酸、10.0 mmol/L NAD+、8.6 mmol/L FeSO4·7H2O,用 Na2HPO4-柠檬酸缓冲液(pH 7.0)定容至10 mL,菌体量为30 g/L,反应条件为30 ℃下3 d。 发酵液用于气质测定。
1.2.3 摇瓶发酵生产己二酸 摇瓶发酵生产己二酸的方法包括发酵法和转化法:1)发酵法:工程菌株培养于含有葡萄糖的M9 培养基中, 当葡萄糖消耗完后添加10 g/L 棕榈酸,同时每24 h 补加10 g/L葡萄糖促进细胞生长。 2)转化法:将前培养的培养液转接至50 mL M9 培养基中, 当10 g/L 葡萄糖消耗完后,在4 ℃下以4 000 r/min 离心5 min 收集菌体,并用20 mL PBS 缓冲液洗涤细胞两次并转接至含有10 g/L 棕榈酸的50 mL 发酵培养基中。整个发酵过程添加碳酸钙调节发酵液的pH。
1.3 分析方法
细胞密度通过测定600 nm 处的OD 值来表示,葡萄糖的测定通过生物传感分析仪,而棕榈酸和己二酸用气质联用检测。
葡萄糖的测定: 利用SBA-40E 生物传感分析仪测定,发酵液稀释10 倍后直接进样,根据葡萄糖标准曲线计算得到发酵液中的葡萄糖含量。
棕榈酸、正己酸和己二酸的测定:利用气相色谱仪测定, 取2 mL 发酵液于12 000 r/min 离心10 min, 将上清液转移至干净的试管中, 随后用2 mL乙酸乙酯萃取, 取1 mL 有机相转移至试管并用氮气吹干。 对于正己酸的测定:向试管中加入5 mL 含甲醇、硫酸、三氯甲烷(体积比 30∶3∶1)的混合液,70℃反应1 h,冷却后加入1 mL 超纯水,随后用1 mL正己烷萃取进行检测。 对于棕榈酸和己二酸的测定:向试管中加入200 μL 吡啶溶解残留物后,加入200 μL N,O-双(三甲基硅烷基)三氟乙酰胺和三甲基氯硅烷混合液 (体积比 99∶1),65 ℃反应 30 min。反应液用氮气吹干后加入1 mL 正己烷进行气质测定。 气相检测条件:初始温度50 ℃,保持1 min;以8 ℃/min 速度升高至 180 ℃;以 10 ℃/min 速度升高至 240 ℃,保持 5 min。 载气为氦气,流量 1 mL/min,进样量 1 μL。
2 结果与分析
2.1 己二酸合成路径的设计
为了构建高效的己二酸生产菌株,以棕榈酸为底物设计了一条新型的己二酸合成路径,该路径主要包括两个模块,1)上游模块:棕榈酸经β-氧化路径降解为正己酸, 该路径主要包括6 个关键酶,分别是长链脂肪酸转运蛋白(FadL)、脂酰-CoA 合成酶(FadD)、脂酰-CoA 脱氢酶(FadE)、脂肪酸氧化酶复合体α 亚基(FadB)、脂肪酸氧化酶复合体β 亚基(FadA)和硫酯酶(YdiI);2)下游模块:正己酸经 ω-氧化路径生成己二酸, 该路径主要包括5 个关键酶,分别是恶臭假单胞菌(P. putida)的烷烃-1-单加氧酶(AlkB)、红素氧还蛋白(AlkG)、红素氧化蛋白-NAD+还原酶(AlkT)、不动杆菌属(Acinetobacter sp.SE19)的6-羟基己酸脱氢酶(ChnD)和6-氧代己酸脱氢酶(ChnE)(见图 1)。 理论上,该路径可实现 1 mol 棕榈酸到1 mol 己二酸的转化,不存在碳损失,回收率达100%。
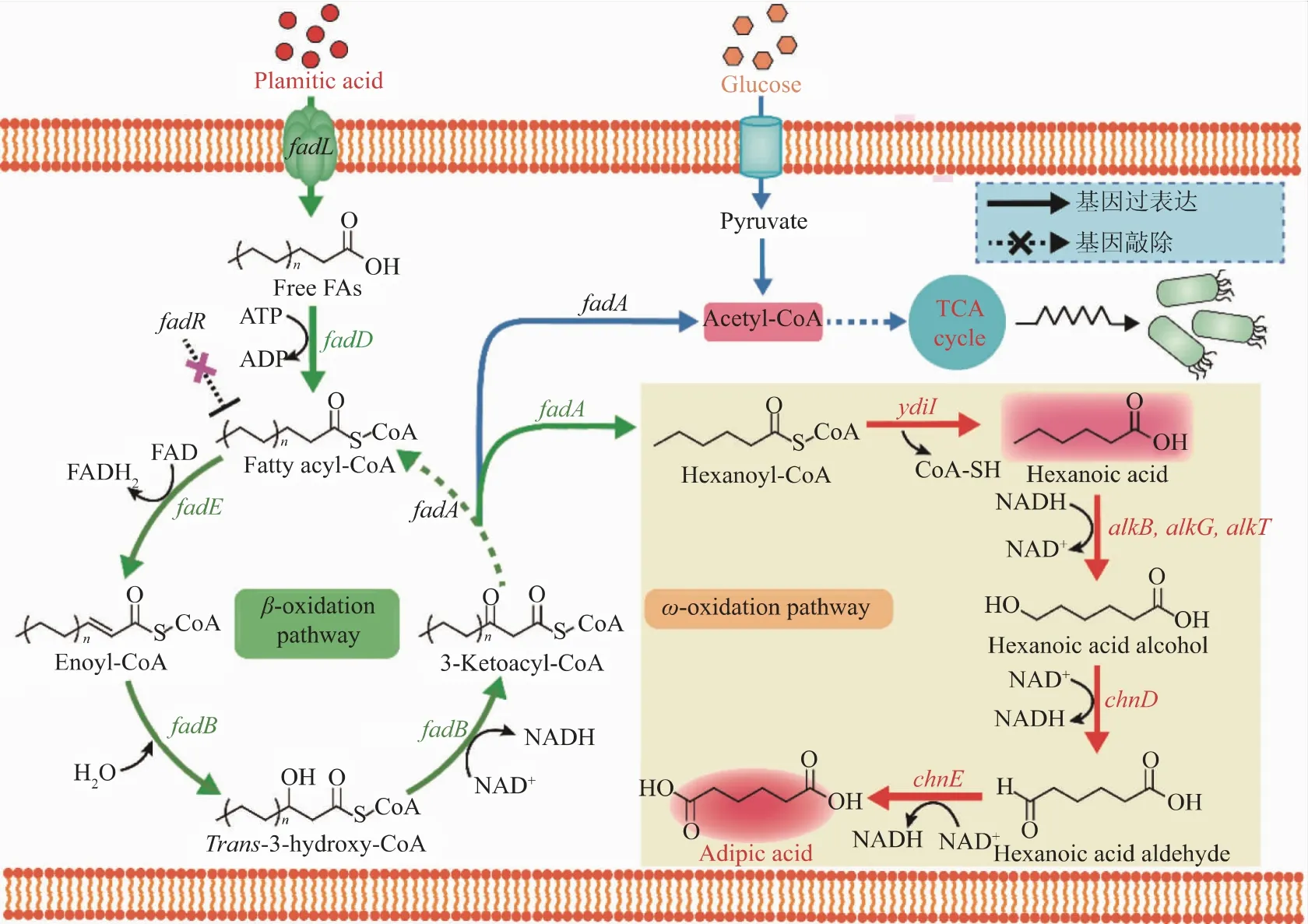
图1 重构大肠杆菌脂肪酸代谢合成己二酸Fig. 1 Establishing the adipic acid production platform by rewiring fatty acids catabolism in E. coli
2.2 己二酸上游合成路径的构建与强化
首先,通过对β-氧化路径进行改造,提高棕榈酸到正己酸的转化速率(见图2(a))。代谢改造策略主要包括:1)将fadL 和ydiI 基因连接至低拷贝数表达载体 ptet;2)将 fadD、fadE、fadB 和 fadA 基因连接至中拷贝数表达载体pEM;3) 将编码脂酰-CoA 脱氢酶基因的起始密码子“TTG”替换为“ATG”。 SDSPAGE 验证表明,上述所有蛋白质均已成功表达。以棕榈酸为底物,借助全细胞转化,获得了0.67 g/L 正己酸, 而对照菌株并不能转化棕榈酸生产正己酸(见图 2(b))。 上述结果表明,强化 β-氧化路径可促进棕榈酸转化为正己酸。
其次,由于β-氧化路径涉及多种辅因子,测试了不同浓度FAD 对正己酸产量的影响。随着辅因子FAD 浓度的减少,正己酸产量也随之降低。 上述结果表明, 胞内辅因子FAD 的浓度是影响β-氧化降解路径的关键因素之一。 为了进一步提高正己酸产量,构建了辅因子循环再生系统[22],在该系统中FADH2经甲酸脱氢酶转化为FAD, 与此同时NADH 被NADH 氧化酶转化生成NAD+。 经全细胞转化表明,菌株 AA0107 可以产生 0.77 g/L 正己酸, 与菌株AA0106 相比提高了 14.93 %(见图 2(c))。 综上所述,提高胞内的辅因子含量可以促进正己酸的合成。
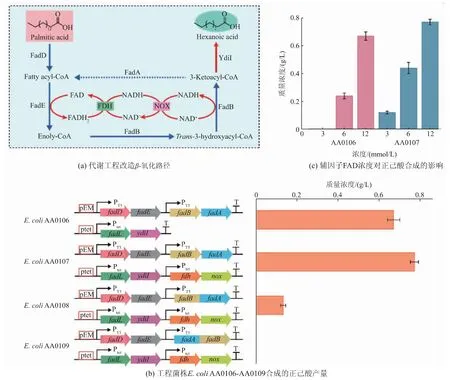
图2 强化β-氧化路径提高正己酸的合成Fig. 2 Enhancement of β-oxidation degradation pathway for improving the yield of hexanoic acid
另外,由于FadB 和FadA 分别属于脂肪酸氧化酶复合体的两个亚基,通过构建FadB 和FadA 的融合蛋白,可以提高底物的传输效率,进而改善正己酸产量。 基于此,构建了两种融合蛋白FadB-FadA和 FadA-FadB,获得菌株 AA0108 和 AA0109。 经全细胞转化表明, 工程菌株AA0108 可以产生0.13 g/L正己酸,与菌株AA0107 相比降低了80.60%。 另外,工程菌株AA0109 没有检测到正己酸产生。 上述结果表明,构建融合蛋白并不能有效促进正己酸的生成,可能是由于融合蛋白影响了单个蛋白质的结构或功能[23]。
2.3 己二酸下游合成路径的重构与优化
首先,通过异源构建ω-氧化路径,促进正己酸转化为己二酸。 alkB、alkG、alkT、chnD 和 chnE 基因连接至中拷贝数载体pEtac, 经SDS-PAGE 验证所有基因均已成功表达。 通过全细胞转化表明,10 g/L正己酸能被转化生成0.61 g/L 己二酸(见图3(e))。上述结果表明, 异源引入ω-氧化路径可以氧化正己酸形成己二酸。 但是,己二酸的合成效率还需要进一步提高,主要原因可能在于异源基因表达不平衡,导致中间代谢物大量积累,从而影响细胞的生产性能。
基于上述分析,模块化优化了ω-氧化路径。 首先, 将ω-氧化路径分为羟化模块 (包括alkB、alkG和 alkT 基因) 和氧化模块 (包括 chnD 和 chnE 基因)。 其次,以绿色荧光蛋白(GFP)为报告蛋白,将RBS30、RBS34 和RBS32 强度分别作为高、中和低3种水平。 再次,借助不同强度的RBS,构建5 种基因表达水平的羟化模块和氧化模块组合(见图3(a)~图 3(d))。 最后,全细胞转化结果表明,下调羟化模块降低了己二酸的产量,仅有0.56 g/L;上调羟化模块提高己二酸的产量至0.69 g/L, 与菌株AA0201相比提高了13.11%。 另外,下调氧化模块提高了己二酸的产量,达到0.76 g/L,与菌株AA0201 相比提高了24.59%;上调氧化模块降低了己二酸产量(见图3(e))。上述结果表明,通过上调羟化模块和下调氧化模块,优化了ω-氧化路径,有效促进了己二酸的合成。
2.4 己二酸合成路径的组装与应用
为了实现棕榈酸到己二酸的转化,将上述构建的最适上游模块和下游模块进行组装,获得工程菌株 AA0301。 全细胞转化结果表明, 工程菌株AA0301 能够转化棕榈酸产生57.0 mg/L 己二酸(见图4(a))。为了增强细胞对脂肪酸的利用能力,敲除了编码脂肪酸代谢调控蛋白的fadR 基因,获得工程菌株AA0303。 同时,将最优的上游模块和下游模块导入菌株AA0303 中,获得工程菌株AA0304。随后,采用两种发酵策略进一步提高己二酸产量,1)发酵法:首先将工程菌株AA0304 培养在M9 培养基中,培养至一定时间后直接加入棕榈酸,在发酵过程中添加葡萄糖用于细胞生长;2)转化法:首先将工程菌株AA0304 培养在以葡萄糖为碳源的M9 培养基中,当培养至一定时间后收集菌体,转接至以棕榈酸为底物的发酵培养基中。 研究发现,采用转化法更有利于己二酸积累,产量达到了110.2 mg/L,与发酵法相比提高了 93.33%(见图 4(b)~图 4(c))。上述结果表明,通过结合β-氧化路径和ω-氧化路径,棕榈酸能够有效转化为己二酸。
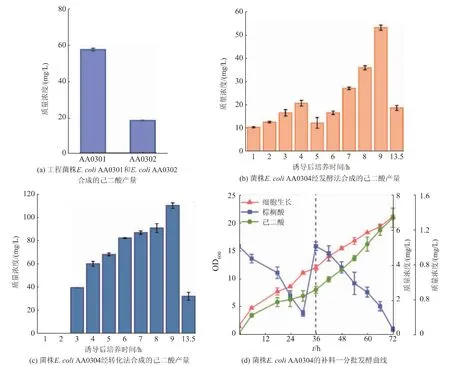
图4 利用棕榈酸发酵生产己二酸Fig. 4 Production of adipic acid by palmitic acid fermentation
由于高质量浓度的棕榈酸会附着在细胞膜表面,降低细胞呼吸速率[24],因此进一步分析了分批添加棕榈酸对己二酸产量的影响。 研究发现,棕榈酸的分批添加,使得己二酸产量提高到了1.32 g/L,与直接添加棕榈酸相比提高了11.98 倍。 上述结果表明,分批添加棕榈酸,降低了其对细胞的毒性作用,改善了细胞生长状态,从而促进了己二酸生产。
3 讨 论
己二酸合成新路径有助于实现更高的己二酸得率。 目前,己二酸的合成路径主要包括:顺,顺-粘糠酸路径、D-葡糖二酸路径、逆己二酸降解路径、逆β-氧化路径和 ω-氧化路径等[4,25-28]。 上述路径获得的己二酸产量较低, 原因主要包括以下3 个方面:1)丙酮酸转化为乙酰CoA 会释放二氧化碳,降低己二酸产率;2)己二酸的合成路径较长,导致了副产物积累;3)细胞生长与己二酸合成之间竞争代谢流。 然而,作者构建的己二酸合成路径具有更多的优势,一方面,脂肪酸不仅能通过分解代谢路径生产目标化学品,而且释放的乙酰CoA 可以促进细胞生长,从而避免了细胞生长与产物合成之间的代谢流竞争;另一方面,作者设计的己二酸合成路径能够实现更高的理论得率。 以往所报道的己二酸合成路径均以葡萄糖或甘油为底物,己二酸理论得率为33%~67%。 该研究中己二酸合成路径却能够实现100%的理论得率,远高于其他合成路径[1,5,26]。 因此,以脂肪酸为基础的合成路径具有较高的产品得率和较低的原料成本,是一种潜在的可替代传统化学法合成己二酸的方法。
脂肪酸利用型菌株的开发不仅拓展了微生物的底物谱,而且有助于促进循环经济的发展。 近年来,随着代谢工程、合成生物学的快速发展,越来越多的研究已经转向廉价原料的利用, 例如蔗糖、果糖、木质纤维素、粗甘油、废弃食用油等[14,29-33]。目前,关于己二酸的生物法合成,主要以葡萄糖或甘油为原料,产量相对比较低。 脂肪酸作为自然界中广泛存在的廉价原料,具有高效生产高附加值化学品的潜力,主要原因在于:1)利用脂肪酸具有较高的碳原子经济价值,有利于提高己二酸得率;2)利用脂肪酸可避免与可食用农作物的竞争,有利于降低生产成本;3)利用脂肪酸可解决食品废弃物和环境污染的问题。因此,作者以脂肪酸为原料,通过结合β-氧化路径和ω-氧化路径设计、 构建和优化己二酸合成路径,促使棕榈酸转化生成己二酸,为回收和再利用食品废弃物提供了可能。 另外,利用廉价原料合成己二酸,为实现低成本和可持续的工业化生产开辟了新的道路。
4 结 语
结合β-氧化路径和ω-氧化路径, 设计并构建了一条以脂肪酸为底物合成己二酸的新路径。 在此基础上,借助系统代谢工程策略,优化了己二酸合成路径。 此外,通过发酵条件优化,提高了己二酸的产量。最终,工程菌株E. coli AA0304 能够产生己二酸1.32 g/L。 为利用脂肪酸合成其他高价值化学品奠定了良好的基础。
