糖尿病合并MAFLD患者外周血Chemerin与 糖脂代谢、内脏脂肪、氧化应激及炎症指标的关系
2022-03-30李海玲董陆玲杨秀红张贵山
李海玲,董陆玲,杨秀红,张贵山
(河北省张家口市第一医院内分泌科,河北 张家口 075000)
代谢相关脂肪性肝病(metabolic associated fatty liver disease,MAFLD)以肝组织内脂肪过度沉积为主要特征,糖尿病(diabetes mellitus,DM)、肥胖、高脂血症等为其主要病因[1]。临床资料显示,DM患者中MAFLD发生率高达57%~80%,发生后不仅可直接导致失代偿期肝硬化及干细胞癌,而且可参与2型DM发病过程,影响患者预后[2]。故提高DM合并MAFLD的防治效果至关重要。研究指出,肝脏及脂肪组织分泌的Chemerin因子与内脏脂肪可能存在相关性;且其可结合受体Chemerin趋化巨噬细胞、淋巴细胞等参与机体炎症反应[3-4]。另据文献报道,Chemerin脂肪因子可对脂肪细胞分泌瘦素进行调控,影响机体能量代谢,参与DM合并MAFLD致病过程[5]。但临床关于Chemerin与DM合并MAFLD患者糖脂代谢、内脏脂肪、氧化应激及炎症指标的关系研究尚少。基于此,本研究探讨DM合并MAFLD患者外周血Chemerin与糖脂代谢、内脏脂肪、氧化应激及炎症指标的关系,并分析其的临床预测价值,以期为临床防治提供参考。结果报告如下。
1 资 料 与 方 法
1.1一般资料 选取2017年10月-2020年10月我院诊治的DM患者(DM组)84例,DM合并MAFLD患者(DM合并MAFLD组)124例。病例纳入标准:①DM及DM合并MAFLD分别符合《2010年美国糖尿病协会糖尿病治疗指南》[6]、《非酒精性脂肪性肝病诊疗指南》[7]诊断标准;②年龄≤78岁;③临床资料完整。排除标准:①严重心、肝、肾等功能不全者;②DM急慢性并发症;③心律失常者;④恶性肿瘤者;⑤免疫系统疾病;⑥血液系统疾病;⑦无饮酒史或饮酒量男性<140 g/周、女性<70 g/周者;⑧毒性肝炎、药物及毒性引起的肝炎。DM合并MAFLD组男性68例,女性56例;年龄56~75岁,平均(64.27±6.68)岁;体重指数(body mass index,BMI)19~28,平均23.45±3.23。DM组男性45例,女性39例;年龄58~76岁,平均(64.98±6.85)岁;BMI 18~29,平均23.19±3.36。另选取同期体检健康者(健康对照组)62例,男性35例,女性27例;年龄55~78岁,平均(63.57±6.79)岁;BMI 18~29,平均23.61±3.52。3组一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2方法
1.2.1Chemerin与糖脂代谢、氧化应激及炎症指标检测 采集受试者空腹肘静脉血6 mL,3 000 r/min离心10 min,分离血清,取上层血清-80 ℃保存备测。外周血Chemerin、肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、白细胞介素6(interleukin-6,IL-6)、丙二醛(malonaldehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽(glutathione,CSH)均采用酶联免疫吸附测定法检测(试剂供自武汉博士德生物工程公司);高敏C反应蛋白(high-sensitive C-reactive protein,hs-CRP)采用散射比浊法检测(试剂);总胆固醇(total cholesterol,TC)、三酰甘油(triacylglycerol,TG)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-level level of lipoprotein cholesterol,HDL-C)均采用比色法测定;空腹血糖(fasting plasma glucose,FPG)、餐后2 h血糖(2 h plasma glucose,2 hPG)、空腹血清胰岛素浓度(fasting insulin,FINS)采用化学发光法检测; 糖化血红蛋白(glucated haemoglobin A1c,HbA1c)采用高效液相色谱法检测;胰岛素抵抗指数(homeostasis model assessment for insulin resistance,HOMA-IR)=FPG×FINS/22.5。上述操作均遵循试剂说明严格进行。
1.2.2内脏脂肪面积(visceral fat area,VFA)测定 所有受试者空腹下使用螺旋CT行腹部扫描,扫描中受试者行仰卧位,扫描水平为平脐平面(L4~5节段),将重建薄层数据传输至工作站进行分析,选取脂肪组织CT值范围-250~-50 Hu。由计算机自动计算出VFA。
1.3统计学方法 应用SPSS22.0统计软件处理数据。计数资料比较采用χ2检验;计量资料比较采用单因素方差分析和LSD-t检验;相关性采用Pearson相关分析,影响因素确定采用多重线性回归分析。P<0.05为差异有统计学意义。
2 结 果
2.13组糖脂代谢水平比较 3组HbA1c、FPG、2 hPG、FINS、HOMA-IR、TC、TG、HDL-C及LDL-C差异有统计学意义(P<0.05)。DM合并MAFLD组HbA1c、FPG、2 hPG、FINS、HOMA-IR、TC、TG水平高于对照组和DM组,HDL-C、LDL-C水平低于对照组和DM组,DM组HbA1c、FPG、2 hPG、FINS、HOMA-IR、TC、TG水平高于对照组,HDL-C、LDL-C水平低于对照组,差异有统计学意义(P<0.05)。见表1。

表1 3组糖脂代谢水平比较Table 1 Comparison of glucolipid metabolism levels in three groups
2.23组Chemerin与炎症指标比较 3组外周血Chemerin、hs-CRP、TNF-α及IL-6差异均有统计学意义(P<0.05)。DM合并MAFLD组外周血Chemerin、hs-CRP、TNF-α及IL-6水平高于对照组DM组,DM组外周血Chemerin、hs-CRP、TNF-α及IL-6水平高于对照组,差异有统计学意义(P<0.05)。见表2。
2.33组VFA及氧化应激指标比较 3组VFA、MDA、SOD及CSH差异均有统计学意义(P<0.05)。DM合并MAFLD组VFA、MDA水平高于对照组和DM组,SOD及CSH水平低于对照组和DM组,DM组VFA、MDA水平高于对照组,SOD及CSH水平低于对照组,差异有统计学意义(P<0.05)。见表3。

表2 3组Chemerin与炎症指标比较Table 2 Comparison of Chemerin and inflammatory indicators in three groups

表3 3组VFA及氧化应激指标比较Table 3 Comparison of VFA and oxidative stress indexes in three groups
2.4外周血Chemerin与糖脂代谢、内脏脂肪、氧化应激及炎症指标的相关性 相关性分析显示,外周血Chemerin与TC、hs-CRP、IL-6、MDA、TG、TNF-α及VFA均呈显著正相关(P<0.01),与HDL-C、CSH、LDL-C、SOD呈显著负相关(P<0.01)。见表4。
2.5多元逐步回归分析 以DM合并MAFLD患者Chemerin(连续型变量)为因变量,TC(连续型变量)、TG(连续型变量)、HDL(连续型变量)、LDL(连续型变量)、hs-CRP(连续型变量)、TNF-α(连续型变量)、IL-6(连续型变量)、VFA(连续型变量)、MDA(连续型变量)、SOD(连续型变量)、CSH(连续型变量)均为自变量进行多元逐步回归分析,结果表明,TC、TG、IL-6、VFA及SOD是DM合并MAFLD患者Chemerin的影响因素。见表5。
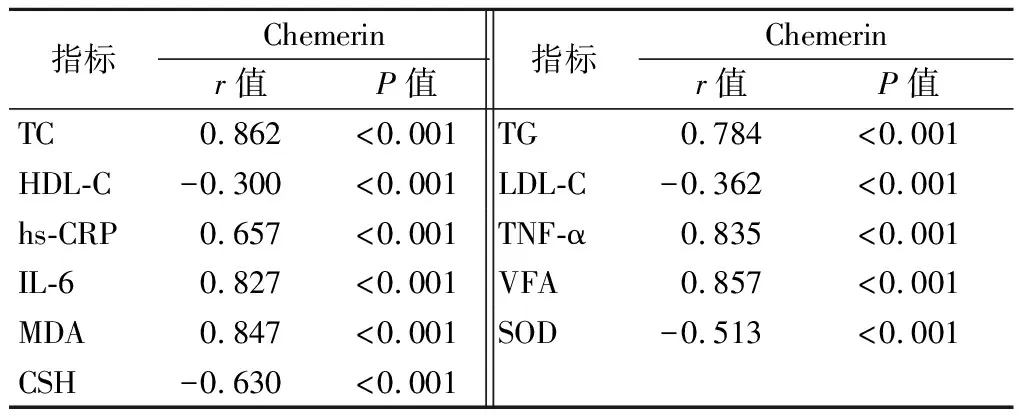
表4 外周血Chemerin与糖脂代谢、内脏脂肪、 氧化应激及炎症指标的相关性Table 4 Correlation between peripheral blood Chemerin and glucolipid metabolism, visceral fat, oxidative stress and inflammatory indexes
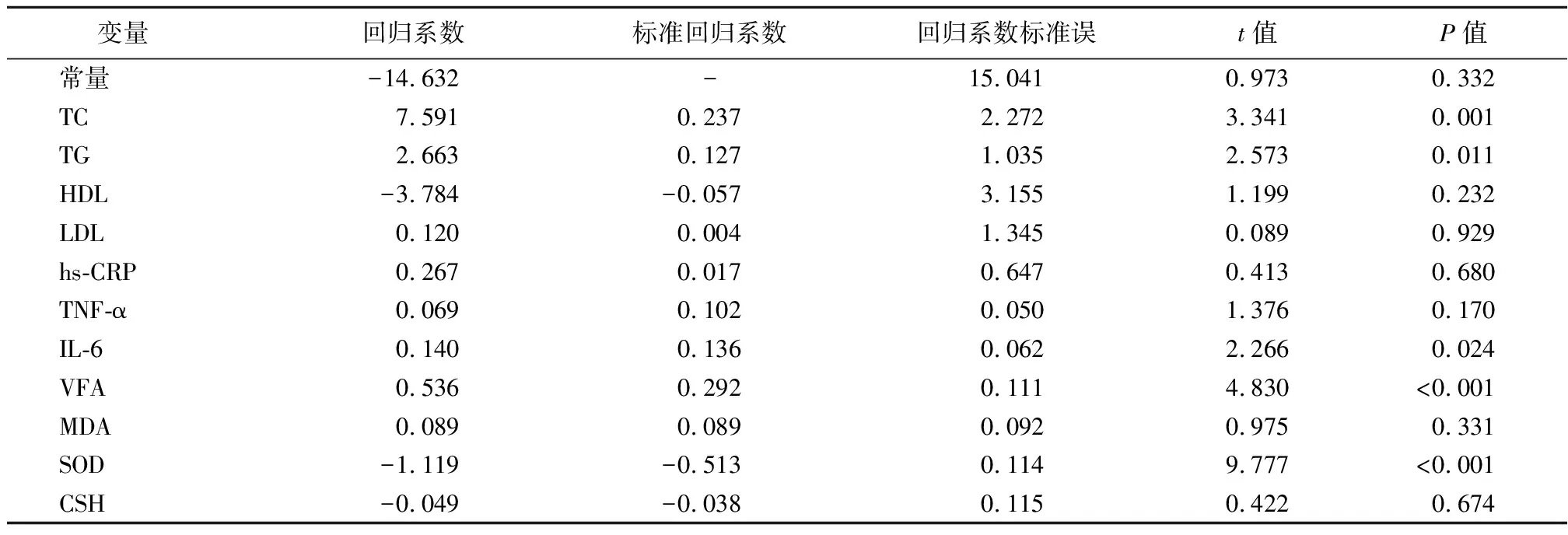
表5 多元逐步回归分析Table 5 Multiple stepwise regression analysis
3 讨 论
DM患者中MAFLD发生率较高,DM、肥胖及代谢综合征与之密切相关。研究显示,DM患者胰岛素抵抗可造成糖代谢障碍,增加血液中游离脂肪酸含量,且高胰岛素血症可加快肝脏对脂肪酸的合成,使脂肪酸大量积聚于肝脏中,超过肝脏负荷,最终导致MAFLD发生[8]。Chemerin是与肥胖及代谢综合征相关的脂肪细胞因子,其在机体炎症、脂肪细胞及代谢综合征等中均具有重要作用。卢建文等[9]研究显示,炎症早期多形核白细胞(polymorphonuclear leukocytes,PMNs)在炎症组织中的浸润早于抗原提呈细胞,且PMNs释放的蛋白酶活化Chemerin前体,提示Chemerin在炎症早期产生,可作为机体炎症反应标志物。另DM患者中脂肪及肝脏组织可分泌大量炎性因子(hs-CRP、TNF-α、IL-6),造成DM患者胰岛素抵抗,进而增加脂肪肝发生风险,参与MAFLD的发生及发展过程[10]。同时,Chemerin具有趋化旁分泌途径作用,促使巨噬细胞向肝脏细胞聚集,进而促使大量炎症因子释放,增强肝脏炎性反应,并进一步加重胰岛素抵抗。本研究结果显示,DM合并MAFLD组患者Chemerin、hs-CRP、TNF-α及IL-6水平高于对照组和DM组,相关性分析显示,hs-CRP、TNF-α及IL-6均与血浆Chemerin呈正相关,且IL-6是血浆Chemerin水平的影响因素。提示,DM患者炎症的发生与MAFLD的发展过程相关,而血浆Chemerin在此过程中起重要作用,可进一步介导DM患者MAFLD发生。
活性氧及氧化应激损伤是造成DM患者发生的另一重要原因[11]。而Chemerin除可调节脂类和葡萄糖代谢外,还可调节机体免疫反应,促进前脂肪细胞分化为成熟脂肪细胞,影响机体能量代谢。因此明确DM合并MAFLD发病过程中氧化应激状态与Chemerin的关系具有重要意义。SOD及GSH均具有维持机体氧化还原稳态平衡的作用,而MDA过度表达可造成肝脏细胞DNA损伤。已有研究指出,SOD及GSH水平降低可造成机体氧化-还原状态失衡,加重氧化损伤[12]。本研究结果显示,DM合并MAFLD组患者SOD及GSH水平均低于对照组和DM组,MDA水平高于对照组和DM组,Chemerin与SOD、GSH呈负相关,与MDA呈正相关。提示,DM引起的氧化损伤及脂肪因子代谢异常与肝脏脂肪病变关系密切。原因可能为:脂肪病变过程中,活性氧损伤可引起下游脂质代谢紊乱及Chemerin水平升高,释放炎症因子,导致肝脏损伤。
DM患者糖脂代谢异常发生后,其脂质毒性可同时对肝脏及胰岛细胞造成严重损害,打破机体代谢免疫平衡,降低胰岛素与组织中受体结合,促使胰岛素敏感性下降,削弱其对血糖的调节作用[13]。另腹型肥胖可增加DM发生风险,且VFA含量越高,DM风险越大。已有研究指出,腹型肥胖患者VFA含量高,可分泌更多TNF-α、Chemerin等脂肪细胞因子,干扰胰岛素传导信号通路并对其正常生物学效应产生影响[14]。同时VFA堆积可导致内脏脂肪中β肾上腺素能受体表达高于皮下脂肪,促进脂肪分解,产生更多脂质代谢产物,进而脂代谢异常,促进胰岛素抵抗。且VFA除脂代谢影响外,还可分泌多种脂肪因子[15]。而Chemerin为新型脂肪细胞因子,具有炎症调节、免疫调节等多种作用。本研究结果显示,DM合并MAFLD组患者HOMA-IR、TC、TG、VFA水平高于对照组和DM组,多元回归分析显示,VFA是血浆Chemerin水平的影响因素。提示DM合并MAFLD患者内脏脂肪与Chemerin相关,且可对MAFLD的发生发展产生影响。
综上所述,Chemerin与IL-6、VFA及SOD关系密切,参与DM合并MAFLD的病理生理过程。本研究的不足为样本量偏小,仍有待进一步行大样本研究检验。
