二十二碳六烯酸对斑马鱼肝脏细胞蛋白代谢、脂代谢和能量代谢的影响
2020-06-08侯宜颖刘成栋周慧慧麦康森何艮
侯宜颖 刘成栋 周慧慧 麦康森 何艮


摘要:选取斑马鱼肝脏细胞作为体外研究模型通过蛋白质印记分析和实时荧光定量PCR实验技术测定了DHA(docosahexaenoic acid二十二碳六烯酸)对细胞内蛋白质合成关键通路以及糖脂代谢关键酶基因的表达主要阐明了DHA对鱼类细胞蛋白质代谢关键通路、糖代谢和脂代谢过程关键酶基因水平的影响。
关键词:DHA;蛋白质;代谢;Akt/mTOR;糖脂
饲料占水产养殖总生产成本的一半以上而蛋白质是影响鱼类生长性能和饲料成本的最重要也是最昂贵的营养素[1]肉食性鱼类倾向于把蛋白质作为供能物质而不是脂质和碳水化合物。因此为了满足鱼类的营养需求并节约成本必须要提高饲料中蛋白质的利用效率[2]。有研究表明饲料中蛋白质的利用效率与蛋白质水平和非蛋白质水平(糖和脂质等)的可用性有关。使用非蛋白质能源可以减少蛋白质对生产力的需求并增加蛋白质对生长的利用具有节约蛋白质的作用。
本研究中选择斑马鱼肝脏细胞作为实验模型希望通过实验能更好更深入地了解DHA对于鱼类的影响和相关机制。
1材料方法
1.1斑马鱼肝脏细胞的培养
斑马鱼肝脏细胞系购买于中国典型培养物保藏中心培养基基底配方:50% L-1535% Eagle培养基15% Ham's F-12。另外添加:10% 胎牛血清0.15 g/L 碳酸氢钠15 mM HEPES0.01 mg/mL Insulin50 ng/mL bFGF2 mM GlutaMAX28 ℃无二氧化碳无菌培养。
1.2细胞处理
细胞处理液的配制方法在已发表的文章的基础上进行了修改[6-7]在无血清培养基中加入1 μM BSA和500 μM DHA(Sigma#D2534)摇匀等分保存在-80 ℃下。通过无血清培养基(含有1 μM BSA)将DHA储备液稀释至0、2、5、10、20、40 μM即为处理液。在六孔板中培养细胞达到90%覆盖率将细胞用24 ℃预热后的DPBS润洗两次并用无血清培养基饥饿12 h。饥饿后将细胞用处理液孵育4 h即可检测所需指标。
1.3蛋白质印记分析
将处理好的细胞用DPBS洗涤两次并用RIPA缓冲液裂解该缓冲液包含50 mM Tris150 mM NaCl0.5%NP-400.1%SDS1 mM EDTA蛋白酶和磷酸酶抑制剂混合物(Roche #4693132001#4906837001)。将裂解物在4 ℃下以12 000 g离心15 min。接下来用BCA蛋白质检测试剂盒(Beyotime#P0011)收集上清以测量蛋白质浓度。蛋白质变性后通过SDS-PAGE分离并转移至0.45 m聚偏二氟乙烯膜(polyvinylidene di uoride membranePVDF;Millipore#IPVH00010)。转移后将膜用5%牛奶封闭并在一抗中于4 ℃孵育8 h以上。然后将膜用二抗孵育并用ECL试剂(Beyotime#P1008)显影。使用的一抗如下:S6K1(CST#9202)phospho-S6K1(Thr389;CST#9205)Akt(CST#9272)phospho-Akt(Ser473;CST#9271)phospho-Akt(Thr308;CST#9275)S6(CST#2217)phospho-S6(Ser235 / 236;CST#4856)4EBP1 (CST,# 9644)phospho-4EBP1 (Thr37/46;CST,# 2855)AMPKα (CST,# 5831)phospho-AMPKα (Thr172;CST,# 50081)。
1.4实时荧光定量PCR
处理后的细胞加1 mL Trizol使其充分裂解。12 000 g4 ℃离心10 min取上清。加入1 mL氯仿冰上放置3 min。12 000 g4 ℃離心15 min取上清。加入1 mL异丙醇冰上放置10 min。4 ℃12 000 g离心10 min弃上清RNA即沉于管底。按1 mL 75%乙醇悬浮沉淀。4 ℃12 000 g离心10 min弃上清。打开离心管的盖子在冰上晾5~10 min干燥RNA样品。干燥完成后加入30~60 uL DEPC水在冰上溶解RNA样品。取2 uL样品用核酸蛋白检测仪(NANODROP 2000ThermoUSA)检测RNA浓度及其O.D值。按2 μL 6×buffer + 1 μL样品加样并吹打混匀。在配好的琼脂糖凝胶中点样并在TAE buffer中电泳电泳槽设置180 V10 min得到三条清晰的条带。
按照说明使用PrimeScriptRT Reagent Kit With gDNA Eraser(Perfect Real Time;TAKALAJapan)进行反转录。反转录结束后使用SYBR Primix Ex TaqTM(Perfect Real Time;TAKALAJapan)试剂盒进行荧光定量反应定量仪器为Mastercycler ep realplex实时定量PCR仪(EppendorfGermany)。用于实时定量PCR的引物序列如表1。在确定实验处理对内参基因的表达没有影响后计算各处理组相对于目的基因的表达量。
1.5数据处理
所有试验数据均用平均值±标准误(Mean ± SEM)表示使用SPSS 19.0对数据进行分析和统计首先通过ANOVA (one-way analysis of variance)进行方差分析若差异显著再用Turkeys作多重比较。当P<0.05时差异显著。
2结果
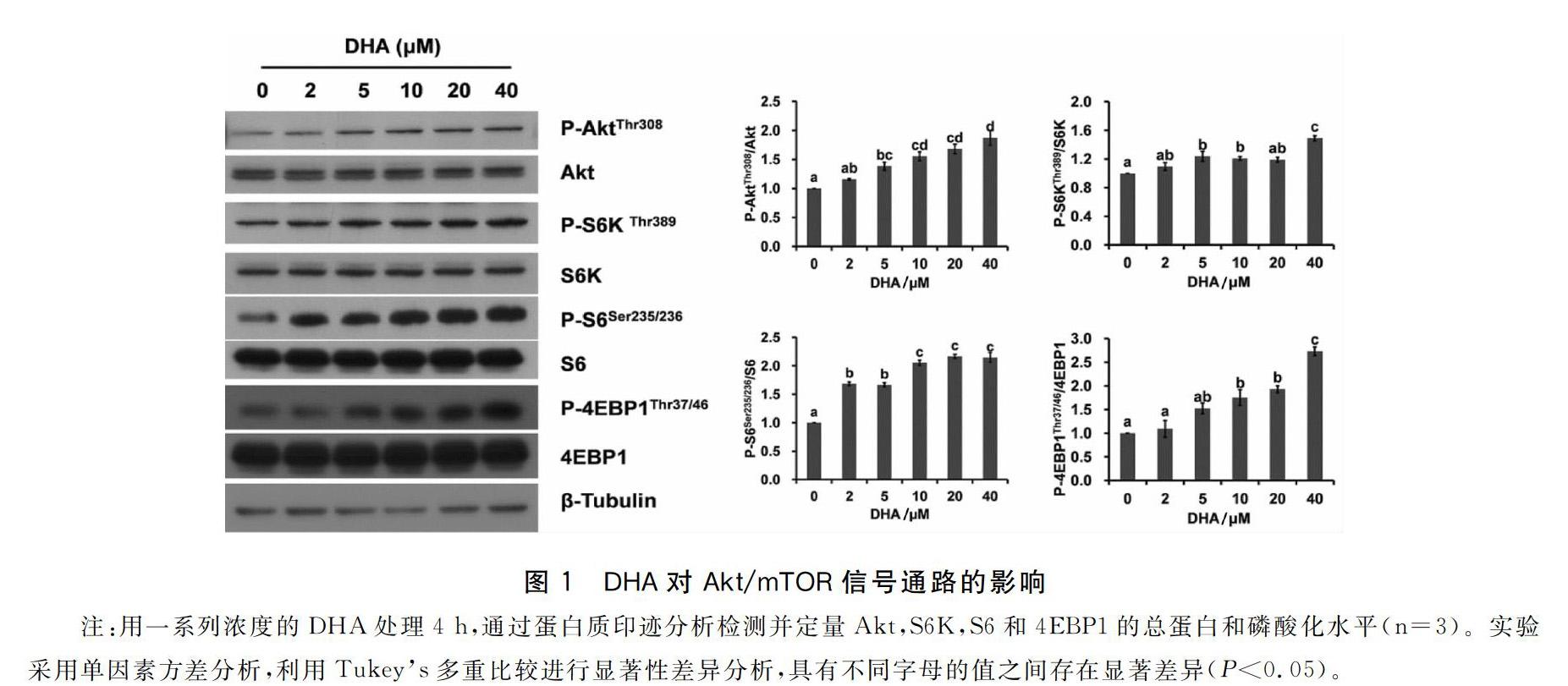
2.1DHA激活斑马鱼肝脏细胞Akt/mTOR通路
本研究检测了蛋白质合成有关的信号通路中几个关键激酶的活性。Akt/mTOR途径是调节蛋白质合成的重要通路之一[8]。我们首先检测了mTOR(target of rapamycin雷帕霉素靶蛋白)的上游激酶Akt(PKB;protein kinase B蛋白激酶B)的磷酸化水平结果表明DHA增加了phospho-AktThr308的水平。另外作为mTOR的下游靶标phospho-4EBP1Thr37/46phospho-S6KThr389和phospho-S6Ser235/236的水平也随着DHA浓度的增加而增加。已知4EBP1和S6磷酸化水平的增加会促进细胞内蛋白质翻译及肽链的延长这些结果表明DHA可能通过Akt/mTOR通路促进蛋白质代谢(图1;P<0.05)。
2.2DHA对斑马鱼肝脏细胞脂质代谢的影响
本研究检测了参与脂质代谢的几个关键酶基因结果如图2所示DHA下调了脂质合成过程中的关键酶基因包括HMGCS(hydroxy-3-methylglutaryl-CoA synthase3-羟基-3-甲基戊二酰辅酶A合成酶)SCD(stearoyl-CoA desaturase硬脂酰辅酶A去饱和酶)SREBP-1(sterol regulatory element binding protein1固醇调控元件结合蛋白1)和FAS(fatty acid synthetase脂肪酸合成酶)(图2A;P<0.05)。参与脂质分解代谢的关键酶基因CPT1α(carnitine palmitoyltransferase 1肉碱脂酰转移酶I)和ACOX(acyl CoA oxidase酰基辅酶A氧化酶)的水平下调(图2B;P<0.05)。这些结果表明DHA处理不仅抑制斑马鱼肝脏细胞脂质的合成还抑制脂质的分解总的来说是抑制肝脏细胞内的脂质代谢过程。
2.3DHA对斑马鱼肝脏细胞能量代谢的影响
蛋白质印记分析结果显示DHA上调了AMPK(5AMP-activated protein kinase腺苷酸激活蛋白激酶)的磷酸化水平激活了AMPK(图3A)。我们还检测了斑马鱼肝脏细胞内的糖代谢基因和TCA循环过程中的关键酶基因的表达。结果显示DHA不仅抑制了糖酵解相关酶GCK(glucokinase葡萄糖激酶)的mRNA表达水平(图3B;P<0.05)还抑制了参与能量代谢的关键酶的表达水平包括CS(citrate synthesis柠檬酸盐合成酶)和IDH1(isocitrate dehydrogenase1异柠檬酸脱氢酶1)(图3C;P<0.05)。结果表明DHA处理可能影响斑马鱼肝脏细胞能量代谢降低细胞内能量水平。
3讨论
我们的研究结果表明DHA能激活斑马鱼肝脏细胞内调控蛋白质代谢的关键通路—Akt/mTOR信号通路。mTOR感知营养信号并通过提高其底物S6K和4EBP1的磷酸化水平促进蛋白质的翻译过程[9]。phospho-S6KThr389phospho-S6Ser235/236和phospho-4EBP1Thr37/46的水平随着DHA添加水平的提高而提高说明DHA对mTOR通路具有激活作用。这与一些临床研究结果一致例如补充omega-3脂肪酸可以改善老年人的肌肉蛋白质量并预防肌肉减少症并且激活一些信號转导途径关键酶的磷酸化水平例如phospho-mTORSer2448和phospho-p70S6KThr389。Akt被认为是细胞生长不可或缺的控制节点当被生长因子和营养状态变化激活时Akt会上调mTOR信号传导[10]。我们的研究结果显示DHA上调了phospho-AktThr308水平。但是另有研究结果证明DHA处理会抑制人乳腺癌细胞系MDA-MB-453的Akt磷酸化水平认为这些多不饱和脂肪酸暂时干扰了细胞膜的双层结构从而暂时破坏了细胞质Akt向质膜的募集或Akt与磷酸肌醇依赖激酶1(PDK1)之间的相遇[11]。然而也有研究认为DHA作为神经元细胞膜中含量较多的一种n-3 PUFA它通过增加细胞膜中磷脂酰丝氨酸的含量增强Akt的膜易位/活化[12]。不同的研究结果可能是由于实验材料的不同和处理时间的差异而引起的。所以关于Akt是否是DHA对mTOR作用的上游激活分子仍需进一步研究证实。
本研究检测了斑马鱼肝脏细胞经过DHA处理后参与脂质代谢、糖代谢和能量代谢基因的表达水平。结果显示DHA处理后主要的脂质合成基因HMGCS、SCD、SREBP-1、FAS和分解基因CPT1α、ACOX的水平都被下调。结果说明DHA处理可能抑制斑马鱼肝脏细胞的脂质代谢。糖酵解不仅为细胞代谢过程提供能量还为细胞代谢提供各种代谢中间体。我们的结果显示糖酵解基因GCK和参与能量代谢的关键酶(包括CS和IDH1)的水平随着DHA浓度的增加而降低。结果证明DHA处理可能影响斑马鱼肝脏细胞内的糖代谢和能量代谢。蛋白质印记分析结果显示phospho-AMPKThr172水平的上调也证明了这一定量结果AMPK对机体的能量平衡具有重要作用能感知机体的营养状态和激素水平是细胞水平的能量感受器和调节器。一旦AMPK被激活就会降低细胞内多种消耗ATP的合成作用促进多种合成ATP的分解作用以此平衡机体ATP平衡维持机体正常代谢所需要的能量[13]。
综上本研究发现DHA处理激活斑马鱼肝脏细胞生长和蛋白合成相关通路抑制斑马鱼肝脏细胞的脂质合成和分解过程以及能量代谢总体来说DHA处理可能通过改变细胞蛋白质代谢通路活性和糖代谢、脂代谢过程关键酶表达来影响细胞的整体代谢水平这一发现有助于阐明脂肪酸与氨基酸协同作用对鱼类营养感知的影响机制从而为鱼类科学高效养殖提供营养学理论基础。
参考文献:
[1]Kim L O,Lee S M.Effects of the dietary protein and lipid levels on growth and body composition of bagrid catfish,Pseudobagrus fulvidraco[J].Aquaculture,2005,243(1-4):323-329.
[2] Walton M ,Cowey C .Aspects of intermediary metabolism in salmonid fish[J].Comparative Biochemistry & Physiology Part B Biochemistry & Molecular Biology,1982,73(1):59-79.
[3] Rahimnejad S,Bang I C,Park J Y,et al.Effects of dietary protein and lipid levels on growth performance,feed utilization and body composition of juvenile hybrid grouper,Epinephelus fuscoguttatus× E.lanceolatus[J].Aquaculture,2015,446:283-289.
[4] Li X,Liu W,Jiang Y,et al.Effects of dietary protein and lipid levels in practical diets on growth performance and body composition of blunt snout bream (Megalobrama amblycephala) fingerlings[J].Aquaculture,2010,303(1-4):65-70.
[5] Rantao Zuo,Qinghui Ai,Kangsen Mai,et al.Effects of dietary n-3 highly unsaturated fatty acids on growth,nonspecific immunity,expression of some immune related genes and disease resistance of large yellow croaker (Larmichthys crocea) following natural infestation of parasites (Cryptocaryon irritans)[J].fish & shellfish immunology,2012,32(2):0-258.
[6] Kamolrat T,Gray S R.The effect of eicosapentaenoic and docosahexaenoic acid on protein synthesis and breakdown in murine C2C12 myotubes[J].Biochemical and Biophysical Research Communications,2013,432(4):593-598.
[7] Rescigno T,Capasso A,Tecce M F,et al.Effect of docosahexaenoic acid on cell cycle pathways in breast cell lines with different transformation degree[J].Journal of Cellular Physiology,2016,231(6):1226-1236.
[8] Egerman M A ,Glass D J .Signaling pathways controlling skeletal muscle mass[J].Critical Reviews in Biochemistry & Molecular Biology,2014,49(1):59-68.
[9] Kim J,Guan K L.Amino acid signaling in TOR activation[J].Annual review of biochemistry,2011,80(1):1001-1032.
[10] Bodine S C,Stitt T N,Gonzalez M,et al.Akt/mTOR pathway is a crucial regulator of skeletal muscle hypertrophy and can prevent muscle atrophy in vivo[J].Nature cell biology,2001,3(11):1014-1019.
[11] Sato S B,Park J,Kawamoto J,et al.Inhibition of constitutive Akt (PKB) phosphorylation by docosahexaenoic acid in the human breast cancer cell line MDA-MB-453[J].Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids,2013,1831(2):306-313.
[12] Akbar M,Calderon F,Wen Z,et al.Docosahexaenoic acid:a positive modulator of Akt signaling in neuronal survival[J].Proceedings of the National Academy of Sciences,2005,102(31):10858-10863.
[13] Fuentes E N,Safian D,Einarsdottir I E,et al.Nutritional status modulates plasma leptin,AMPK and TOR activation,and mitochondrial biogenesis:Implications for cell metabolism and growth in skeletal muscle of the fine flounder[J].General and Comparative Endocrinology,2013:172-180.
(收稿日期:2020-04-23)
