葡萄籽原花青素柔质体凝胶剂的制备工艺研究
2022-03-30窦晨潘蕊赵声兰程欣云南中医药大学中药学院昆明650500云南中医药大学云南省高校外用给药系统与制剂技术研究重点实验室昆明650500云南中医药大学云南省傣医药与彝医药重点实验室昆明650500
窦晨,潘蕊,赵声兰*,程欣,3* (1. 云南中医药大学 中药学院,昆明 650500;2. 云南中医药大学 云南省高校外用给药系统与制剂技术研究重点实验室,昆明 650500;3. 云南中医药大学 云南省傣医药与彝医药重点实验室,昆明650500)
葡萄籽原花青素(grape seed proanthocyanidins,GSP)是从葡萄籽中提取出来的一种黄酮类多酚化合物。据研究报道,原花青素具有抗氧化[1]、清除自由基[2]、抗癌[3]、抗菌[4]、抑制酪氨酸酶[5]等药理学活性,可作为一种生态可持续和低成本的天然抗氧化剂来源,具有重要的经济效益和社会效益。但其分子结构中的酸性酚羟基和不饱和键使其缺乏长期储存稳定性,容易降解、氧化、聚合等[6]。
将药物包载于柔质体中可增强药物在皮肤中的渗透性[7],改善水溶性和增加药物稳定性,并控制生物活性剂的释放[8-9]。但作为缓释载体,其物理性质不稳定,磷脂双分子层渗透性的增加会导致生物活性分子的泄漏失活、储存周期缩短以及易于聚集、融合或沉淀,并且由于脂质体的流动性使其不宜长时间停留在皮肤上,均限制了柔质体的广泛应用。凝胶剂作为广泛使用的药物剂型,系指药物与适宜基质制成具有凝胶特性的半固体或稠厚液体制剂[10]。将脂质体分散在凝胶基质中制备成脂质体凝胶剂,形成多贮库型系统,能够有效解决流动性问题[11],有效提高药物皮肤滞留时间、稳定性及缓释性的优点[12]。本文将包载原花青素的柔质体嵌入水凝胶中,探究药物的释放规律,为GSP的进一步开发利用提供依据。
1 材料
1.1 试药
原花青素对照品(批号:1024K021SX,纯度≥95%,北京索莱宝科技有限公司),GSP(天津市尖峰天然产物研究开发有限公司,批号:002200604028,纯度≥95%),大豆卵磷脂(Solarbio公司,批号:1112J021),胆固醇(BIOSHARP生物公司,批号:624J033),脱氧胆酸钠(BIOSHARP生物公司,批号:909P021,纯度>99%),卡波姆940(上海麦克林生化科技有限公司,批号:C12058025),甘油(广东光华科技股份有限公司,批号:20200113),PEG-400(批号:C1925030)、三乙醇胺(批号:C2127395)(上海阿拉丁生化科技股份有限公司)。
1.2 仪器
超声波处理器(德国elma公司,型号:P180H);旋转蒸发仪(倍捷科技,型号:OSB-2100);纳米激光粒度仪(美国布鲁克海文公司,型号:90Plus型);安捷伦高效液相色谱仪(安捷伦,型号:1260infin);氮吹仪(天津市恒奥科技发展公司,型号:HSC-12A)。
1.3 实验动物
SPF级KM小鼠,雄性,体质量(20±2)g[湖南斯莱克景达实验动物有限公司,许可证号:SCXK(湘)k2017-0005]。
2 方法与结果
2.1 GSP含量测定的方法学建立
2.1.1 色谱条件 色谱条件1:色谱柱:ZORBAX SB-C18(4.6 mm×250 mm,5.0 μm);溶剂为20%乙醇-生理盐水时,流动相为乙腈∶水=18∶82,流速 1.0 mL·min-1,检测波长 280 nm,进样量10 μL,柱温 30℃。
色谱条件2:溶剂为甲醇时,流动相为甲醇∶水=32∶68,进样量10 μL,柱温25℃,流速1 mL·min-1,检测波长280 nm。
2.1.2 专属性考察 取空白柔质体(BFL)、葡萄籽原花青素柔质体(GSP-FL)、空白脂质体(BL)、葡萄籽原花青素脂质体(GSP-L)的透皮接收液以及GSP对照品溶液按色谱条件1进样分析。取甲醇溶液、原花青素甲醇溶液、原花青素对照品甲醇溶液,按色谱条件2进样分析。由于GSP的出峰时间较早,伴有溶剂峰的干扰,因此在计算时需扣除溶剂峰峰面积。
2.1.3 线性关系考察 精密称取适量的原花青素对照品,加20%乙醇-生理盐水和甲醇溶解,分别配成系列对照品溶液,按照色谱条件1和2进样分析,计算得到的线性回归方程分别为y1=2391.5x-4.943,R2=0.9991,结果表明原花青素在0.0181~0.2896 mg·mL-1与峰面积线性关系良好;y2=1486.8x-159.67,R2=0.9997,结果表明原花青素在0.1252~0.4382 mg·mL-1与峰面积线性关系良好。
2.1.4 精密度实验 配制GSP对照品溶液,按色谱条件1连续进样8次,结果对照品溶液中原花青素峰面积的RSD值为1.1%,表明仪器精密度良好。
2.1.5 重复性实验 取GSP-FL体外经皮渗透样品6份进行重复性考察,按色谱条件1进样分析,结果样品中原花青素峰面积的RSD值为1.8%,表明方法重复性良好。
2.1.6 稳定性实验 精密量取GSP-FL体外经皮渗透液 1.0 mL,0.22 μm微孔滤膜过滤,放置0、2、4、6、8、12 h后,按色谱条件1进样分析,结果显示原花青素峰面积的RSD值为2.4%,表明样品在12 h内稳定性较好。
2.1.7 加样回收实验 取GSP-FL体外经皮渗透接收液样品0.5 mL(含原花青素0.1318 mg)9份,分别加入低、中、高质量浓度的对照品溶液各2份,按色谱条件1进样分析,结果低、中、高质量浓度的平均加样回收率分别为100.82%、102.78%、104.62%,RSD值 分 别1.3%、0.37%、1.7%。精密称定GSP样品粉末9份加入甲醇溶解,分别加入低、中、高质量浓度的对照品溶液各3份,按色谱条件2进样分析,结果低、中、高质量浓度的平均加样回收率分别为97.8%、100.3%、102.7%,RSD值 分别为1.2%、0.33%、0.23%。符合方法学要求。
2.2 GSP-FL与GSP-L的制备
根据前期实验研究得到的最佳制备工艺,采用薄膜分散-超声法制备GSP-FL。精密称定一定量的卵磷脂、胆固醇溶于15 mL氯仿中,将脱氧胆酸钠溶于5 mL甲醇中超声溶解后置于圆底烧瓶中混合均匀,在40℃水浴条件下,减压旋转蒸发除去有机溶剂,直至在烧瓶内壁上形成干燥透明的均匀薄膜。精密称取处方量的GSP溶于6 mL水中,将水相加到圆底烧瓶中,在40℃水浴条件下继续旋转水合30 min后,所得混合液于超声波处理器冰浴超声混匀(150~180 W,5 min),0.22 μm微孔滤膜过滤后得到GSP-FL。同法制备得到不加膜软化剂脱氧胆酸钠的GSP-L,于冰箱4℃密封保存待用。采用超速离心法测定GSP-FL包封率为(70.79± 0.02)%,载药量为(1.16±0.01)%,粒径为(156.47±7.03)nm,PDI为0.26±0.01,Zeta电位为(-42.35±4.00)mV(n=5)。
2.3 GSP-FL凝胶剂(GSP-FLG)的制备
精密称取一定量的凝胶基质,加入适量的纯水过夜,使其充分溶胀,加入适量保湿剂、促渗剂,滴加三乙醇胺调整pH值后,再加入适量GSP-FL混悬液后,加入纯水至50 g,搅拌均匀即得。同法制备不加药物的空白凝胶。
2.3.1 凝胶基质的筛选 分别精密称定确定质量的凝胶基质卡波姆940、卡波姆934、羧甲基纤维素钠、明胶、西黄著胶各0.5 g,加入适量纯水溶胀过夜,用研钵研磨直至细腻,加入甘油2 g,用三乙醇胺调节pH至6.5,用纯水补充至50 g。结果表明,卡波姆940能够形成凝胶,黏度适宜、易于涂布,因此使用卡波姆940作为凝胶剂的基质。
2.3.2 凝胶剂的评价指标 根据《中国药典》2020年版对凝胶剂的规定,一般应检查pH值,胶粒应分散均匀,不应下沉结块,凝胶剂应均匀、细腻、在常温时保持胶状、不干涸或液化等。因此,本文主要考察凝胶剂的失水率、成型性、pH值、均匀度、光泽度、稳定性等因素。
① pH值。将制备好的凝胶剂置于100 mL烧杯中,按照1∶50(W/W)加入超纯水,超声30 min,充分搅拌使其溶解,室温条件下用pH计测定其pH值。
② 稳定性实验。离心实验:精密称取1 g凝胶剂于离心管中,3500 r·min-1离心30 min,观察样品是否分层;低温实验:精密称取1 g凝胶剂于离心管中,密封保存于-20℃冰箱中,观察样品是否分层;热恒温实验:精密称取1 g凝胶剂于离心管中,60℃放置6 h,观察是否分层。
③ 涂展性实验。在一块干净的玻璃板上画一个直径为1 cm的圆,取1 g凝胶剂涂在圆内,并覆盖一块干净的玻璃板,取1 kg重物压在玻璃板上,5 min后量取凝胶剂延展后的直径。
④ 失水率实验。精密称定5 g凝胶剂放入干燥至恒重的玻璃器皿内,将其质量记为Wa,置于55℃的烘箱中干燥,每隔1 h后取出,放冷之后,称定总质量记为Wb,继续干燥至质量不再损失时为终点,计算每个时刻的失水率(S)。
S=(Wa-Wb)/5×100%
2.3.3 卡波姆940用量的考察 精密称定0.05、0.25、0.50、0.75、1.00 g [即分别为0.1%、0.5%、1%、1.5%、2%(W/W)]的卡波姆940均匀洒于纯水表面,充分溶胀,用研钵研磨直至细腻,加入甘油2 g,丙二醇2 g,用三乙醇胺调节pH至6.5,用纯水补充至50 g。主要以外观,成型性,黏稠性,涂展性来考察卡波姆940的用量。结果显示,当卡波姆940用量超过1%时,凝胶剂随着卡波姆940用量的增加,黏度逐渐增大。因此卡波姆940的用量应控制在1%以内。
2.3.4 保湿剂的选择 精密称定卡波姆940约0.5 g,均匀洒于纯水表面,充分溶胀,不加保湿剂或以甘油2 g、PEG-400 2 g、甘油∶PEG-400(1∶1)为保湿剂,再加入丙二醇2 g,用三乙醇胺调节pH至6.5,用纯水补充至50 g。以失水率为指标,考察最适保湿剂的种类。结果显示,在1~6 h内甘油具有较小的平均失水率,因此选择甘油为保湿剂。
2.3.5 保湿剂用量的选择 精密称定卡波姆940 0.5 g,均匀洒于纯水表面,使其充分溶胀,分别加入1、2、3、4、5 g甘油,再加入丙二醇2 g,充分搅匀,用三乙醇胺调节pH至6.5,用纯水补充至50 g。以失水率为指标,考察保湿剂的最适用量,结果显示,当甘油用量为3 g时,凝胶剂具有较小的失水率。
2.3.6 三乙醇胺用量的考察 精密称定卡波姆940 0.5 g,均匀洒于纯水表面,充分溶胀,加入3 g甘油,2 g丙二醇,分别加入0.1、0.5、1、2、3 g三乙醇胺,充分搅匀,用纯水补充至50 g。以外观、涂展性、黏度、pH值为指标,考察三乙醇胺的用量。结果显示,当凝胶剂的pH>8时,状态较稀,不易涂布。因此,三乙醇胺的用量采用0.1、0.5、1 g这三个水平作为影响因素。
2.3.7 正交实验设计与优化选择 根据单因素实验结果,选择卡波姆、甘油和三乙醇胺用量作为影响凝胶剂的主要因素进行考察,综合评分标准见表1,采用L9(34)正交设计表进行基质筛选,优化处方(见表2)。

表1 综合评分标准(20分)Tab 1 Comprehensive scoring criteria (20 points)
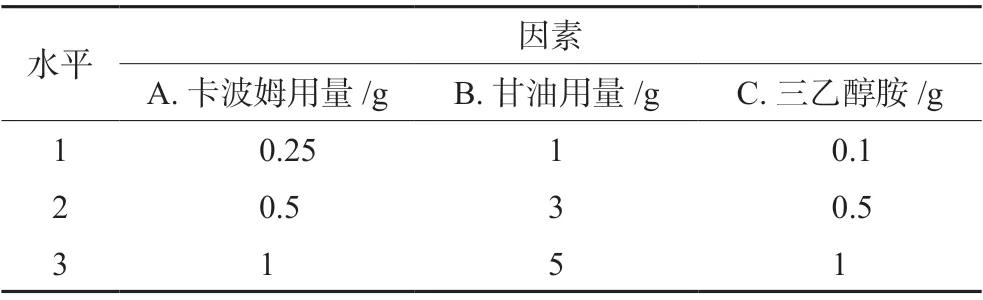
表2 正交实验因素与水平Tab 2 Orthogonal experimental factor and level
2.3.8 正交实验结果 以综合评分为评价指标,各因素对综合评分的影响分别为A>C>B,因素A和C对综合评分具有显著影响(P<0.05),因此考虑GSP-FLG凝胶基质的最佳制备工艺条件为A1B3C2,即每50 g凝胶中含有卡波姆940 0.5%,甘油10%及三乙醇胺1%(见表3、表4)。

表4 方差分析结果Tab 4 Variance analysis
2.3.9 验证实验 按优选的处方工艺制备4批GSP-FLG,对其进行考察,其6 h的平均失水率分别为23.26%、24.33%、22.22%、30.36%,凝胶质地光滑有光泽、涂展性、稳定性良好,综合评分分别为16.5、16.9、17.0、16.2,平均值为16.65,RSD为2.2%,结果表明制备工艺合理,稳定可行且结果可靠。
2.4 GSP-FL、GSP-FLG的体外经皮渗透实验
2.4.1 离体小鼠皮肤的制备 将昆明种小鼠脱颈椎处死后,固定于木板上,小心剔除腹部毛发,立即剪下其腹部皮肤,剥离皮下组织及脂肪,将其浸泡于生理盐水,选用表皮完整无破损皮肤于-80℃冷冻保存,备用。
2.4.2 经皮渗透实验 采用Franz透皮扩散池法,分别以游离GSP为对照进行GSP-FL及GSP-L的体外经皮渗透实验,以葡萄籽原花青素凝胶(GSP-G)为对照进行GSP-FLG的体外经皮渗透实验。将预处理好的鼠皮固定于透皮杯上,使角质层面向样品供给池,真皮层面向接收池,用夹子夹紧。向样品池中加入等量的GSP、GSP-FL及GSP-L样品溶液(含GSP 9.30 mg)或1 g凝胶剂(含GSP 13.12 mg)并均匀铺展开,再向接收池加入20%乙醇-生理盐水作为接收介质,于水浴温度(32±0.5)℃,转速300 r·min-1的条件下进行实验。分别于第0.5、1、2、4、6、8、12、24、48、72 h取样,同时补加等量同温度的接收介质。接收液用0.22 μm的微孔滤膜滤过后,按色谱条件1进样分析,计算GSP在不同时间点的单位面积累积透过量Qt(mg·cm-2),以时间t(h)为横坐标,以Qt为纵坐标作图,结果如图1所示。对曲线中的直线部分进行线性回归,直线的斜率即为稳态透皮速率[Js,mg/(cm2·h)]。

图1 GSP-FL、GSP-L、GSP、GSP-G、GSP-FLG单位面积累积透过量曲线( ±s,n=4)Fig 1 Cumulative transmittance curve of GSP-FL,GSP-L,GSP,GSP-G,and GSP-FLG drugs per unit area( ±s,n=4)
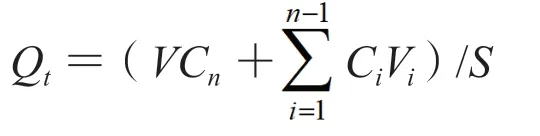
S为有效扩散面积,V为接收液总体积,Cn为第n次取样时接收液中药物的质量浓度,Ci为第i次取样时接收液中药物的质量浓度,Vi为取样体积。
结果如表5所示,GSP组表现出明显的突释现象,GSP-FL组(含GSP 9.30 mg)24 h的单位面积累积透过量显著高于GSP-L组(P<0.05),稳态透皮速率也高于GSP-L组,猜测柔质体的可形变性使其比脂质体更易透过皮肤。GSP-FLG组(含GSP 13.12 mg)72 h的单位面积累积透过量显著低于GSP-G组(P<0.01),稳态透皮速率也低于GSP-G组,因此GSP-FLG表现为明显的缓释效果。通过药物释放动力学方程对体外经皮渗透结果进行拟合,结果显示 GSP-FL、GSP-L、GSP-G及GSP-FLG组均以Weibull 方程进行拟合时具有较好的拟合度;而GSP 组以一级动力学方程拟合度较高。拟合结果如表6所示。
表5 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG累积释放动力学参数( ±s,n=4)Tab 5 Cumulative release kinetics parameters of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ±s,n=4)
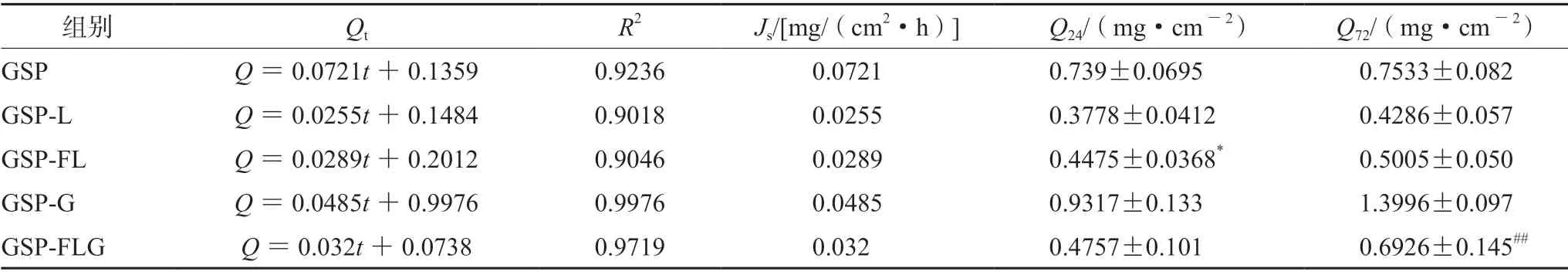
表5 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG累积释放动力学参数( ±s,n=4)Tab 5 Cumulative release kinetics parameters of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ±s,n=4)
注(Note):与GSP-L组相比,*P<0.01;与 GSP-G组相比,##P<0.01(Compared with the GSP-L group,*P<0.01; compared with the GSP-G group,##P<0.01)。
组别 Qt R2 Js/[mg/(cm2·h)] Q24/(mg·cm-2) Q72/(mg·cm-2)GSP Q=0.0721t+0.1359 0.9236 0.0721 0.739±0.0695 0.7533±0.082 GSP-L Q=0.0255t+0.1484 0.9018 0.0255 0.3778±0.0412 0.4286±0.057 GSP-FL Q=0.0289t+0.2012 0.9046 0.0289 0.4475±0.0368* 0.5005±0.050 GSP-G Q=0.0485t+0.9976 0.9976 0.0485 0.9317±0.133 1.3996±0.097 GSP-FLG Q=0.032t+0.0738 0.9719 0.032 0.4757±0.101 0.6926±0.145##
表6 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG药物单位面积累积透过量曲线方程拟合( ±s,n=4)Tab 6 Equation fitting of cumulative transmittance curve per unit area of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ± s,n=4)

表6 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG药物单位面积累积透过量曲线方程拟合( ±s,n=4)Tab 6 Equation fitting of cumulative transmittance curve per unit area of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ± s,n=4)
拟合方式 组别 方程 R2零级释放动力学方程GSP Q=0.0061t+0.4404 0.2862 GSP-L Q=0.0031t+0.2512 0.5010 GSP-FL Q=0.0032t+0.3176 0.4572 GSP-G Q=0.0185t+0.2593 0.8977 GSP-FLGQ=0.008t+0.2103 0.8386一级释放动力学方程GSP Q=0.7371(1-e-0.2844t) 0.9973 GSP-L Q=0.3686(1-e-0.4641t) 0.8451 GSP-FL Q=0.4342(1-e-0.6198t) 0.8282 GSP-G Q=1.4657(1-e-0.0434t) 0.991 GSP-FLGQ=0.6625(1-e-0.0762t) 0.9513 Higuchi方程GSP Q=0.0727t1/2+0.2983 0.5366 GSP-L Q=0.0339t1/2+0.1891 0.7374 GSP-FL Q=0.0355t1/2+0.2517 0.6965 GSP-G Q=0.1857t1/2-0.0752 0.9802 GSP-FLGQ=0.0817t1/2+0.0597 0.9646 Weibull方程GSP Q=0.7410(1-e-[0.283(t-0.019)]0.9487)0.9972 GSP-L Q=0.4285(1-e-[0.2863(t-0.1806)]0.4422)0.9941 GSP-FL Q=0.4947(1-e-[0.4044(t-0.1358)]0.4345)0.9921 GSP-G Q=1.4522(1-e-[0.0386(t-2.5093)]1.169)0.9956 GSP-FLGQ=0.9078(1-e-[0.0284(t-0.3397)]0.5705)0.9933 Ritgerpeppas方程GSP Q=0.3385(t0.2235) 0.7195 GSP-L Q=0.2031(t0.1899) 0.9019 GSP-FL Q=0.2629(t0.1655) 0.8855 GSP-G Q=0.1462(t0.5443) 0.9763 GSP-FLGQ=0.1302(t0.4043) 0.9797
2.4.3 药物的皮肤滞留量测定 体外透皮实验结束后,取出小鼠皮肤,用生理盐水反复冲洗小鼠皮肤表面,直到将皮肤表面的药物清洗干净为止,再剪下给药部位置于10 mL离心管中,用眼科剪将其剪碎,加入甲醇4 mL,置于匀浆机中使其破碎,水浴超声30 min,140 00 r·min-1离心30 min后,弃去鼠皮,将上清液用氮气吹干,以甲醇复溶,过0.22 μm微孔滤膜后,按色谱条件2进样分析测定GSP的药物含量,测定药物的皮肤滞留量(Q)=药物量/有效扩散面积(2.92 cm2)。结果显示,GSP-FL 组72 h皮肤内药物滞留量显著高于GSP 组(P<0.01)。GSP-FLG组在72 h皮肤内药物滞留量显著高于GSP-G组(P<0.05),见表7。
表7 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG的药物皮肤滞留量( ±s,n=3)Tab 7 Drug skin retention of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ±s,n=3)

表7 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG的药物皮肤滞留量( ±s,n=3)Tab 7 Drug skin retention of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ±s,n=3)
注(Note):与GSP组相比,**P<0.01;与GSP-G组相比,##P<0.01(Compared with the GSP group,**P<0.01;compared with the GSP-G group,##P<0.01)。
剂型 Q/(μg·cm-2)GSP-L 42.79±0.981 GSP-FL 46.22±0.439**GSP 39.89±0.173 GSP-G 41.12±1.69 GSP-FLG 48.02±0.45#
2.5 体外释放度考察
精密量取2 mL游离GSP溶液、GSP-FL、GSP-L混悬液以及1 g GSP-G和GSP-FLG 至透析袋(100 kDa)中,以8 mL 20%乙醇-生理盐水为释放介质,于Franz体外透皮扩散池上以300 r·min-1的转速恒温(32±0.5)℃释放,分别于0.5、2、4、6、8、12、24、48、72 h后取样,同时补加等量同等温度的释放介质,接收液用0.22 μm的微孔滤膜滤过后,按照“2.1.1”项下色谱条件1进样分析,计算药物的累积释放量,累积释放率=累积释放量/投药量。结果如表8所示,GSP组在12 h后累积释放率逐渐增加,48 h时后显著高于GSP-FL组(P<0.01),至72 h仍呈释放趋势,表现出明显的突释现象。与GSP-L组相比,12 h后GSP-FL组的累计释放率逐渐增加,48 h后显著高于GSP-L组(P<0.01),GSP-L与GSP-FL表现出长时间的缓释效果。GSP-G组的累计释放率在12 h后显著高于GSP-FLG组(P<0.01),至72 h仍呈释放趋势,表现出明显的突释现象,而GSP-FLG组则在12 h后缓慢释放。将药物制备成GSP-FLG后,在12 h内的药物累积释放率显著小于GSP-FL组(P<0.05),表明凝胶剂型使药物缓释效果更加明显。通过药物释放动力学方程对体外药物累积释放结果进行拟合,结果显示 GSP-FL、GSP-L组以 Weibull 方程,GSP-G以Higuchi方程进行拟合时具有较好的拟合度,而 GSP 、GSP-FLG组以Ritger-peppas拟合度较高。拟合结果如表9 所示。。
表8 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG药物体外累积释放实验结果 ( ±s,n=4,%)Tab 8 In vitro cumulative release data of GSP-FL, GSP-L, GSP, GSP-G and GSP-FLG ( ±s,n=4,%)

表8 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG药物体外累积释放实验结果 ( ±s,n=4,%)Tab 8 In vitro cumulative release data of GSP-FL, GSP-L, GSP, GSP-G and GSP-FLG ( ±s,n=4,%)
注(Note):与GSP-FL相比,*P<0.05,**P<0.01;与GSP-L相比,#P<0.05,##P<0.01;与GSP-FLG组相比,ΔP<0.01(Compared with the GSP-FL group,*P<0.05,**P<0.01;compared with the GSP-L group,#P<0.05,##P<0.01;compared with the GSP-FLG group,ΔP<0.01)。
时间(h) GSP GSP-L GSP-FL GSP-G GSP-FLG 0.5 7.77±0.011 10.71±0.013 8.60±0.0072 4.76±0.005 5.39±0.007*1 10.59±0.014 13.70±0.013 11.47±0.008 7.00±0.010 8.15±0.0156*2 14.58±0.015 16.98±0.018 15.72±0.013 10.38±0.015 11.00±0.021*4 20.66±0.022 21.36±0.026 20.91±0.004 16.67±0.020 15.83±0.027*6 25.02±0.033 23.76±0.031 24.43±0.013 20.98±0.0189 18.79±0.032*8 28.47±0.031 25.35±0.032 27.35±0.011 24.49±0.025 20.49±0.038*10 30.96±0.033 26.87±0.03 30.04±0.014 26.59±0.021 22.12±0.038*12 32.41±0.032 27.70±0.037 31.17±0.017 29.07±0.019Δ 23.55±0.040*24 38.77±0.024 30.57±0.036 35.99±0.017# 40.04±0.012Δ 31.01±0.050 48 60.38±0.021* 40.08±0.010 46.75±0.0235## 62.44±0.014Δ 46.77±0.078 72 63.58±0.042* 40.20±0.008 47.55±0.0232## 73.97±0.018Δ 50.35±0.107
表9 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG药物累积释放率曲线方程拟合( ±s,n=4)Tab 9 Equation fitting of cumulative release rate curve of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ±s,n=4)

表9 GSP-FL、GSP-L、GSP、GSP-G和GSP-FLG药物累积释放率曲线方程拟合( ±s,n=4)Tab 9 Equation fitting of cumulative release rate curve of GSP-FL,GSP-L,GSP,GSP-G and GSP-FLG ( ±s,n=4)
拟合方式 组别 方程 R2零级释放动力学方程GSP Q=0.0075t+0.0.1749 0.8658 GSP-L Q=0.0037t+0.1899 0.7396 GSP-FL Q=0.005t+0.1884 0.741 GSP-G Q=0.0094t+0.1272 0.9347 GSP-FLGQ=0.0061t+0.1271 0.8919一级释放动力学方程GSP Q=0.5886(1-e-0.0.0742t) 0.8992 GSP-L Q=0.3437(1-e-0.2283t) 0.7013 GSP-FL Q=0.4351(1-e-0.1349t) 0.8751 GSP-G Q=0.7354(1-e-0.0434t) 0.9619 GSP-FLGQ=0.4801(1-e-0.0648t) 0.9135 Higuchi方程GSP Q=0.0735t1/2+0.0533 0.9765 GSP-L Q=0.0372t1/2+0.1257 0.9160 GSP-FL Q=0.0506t1/2+0.1011 0.9225 GSP-G Q=0.08991/2-0.0175 0.9975 GSP-FLGQ=0.0589t1/2+0.0306 0.9874 Weibull 方程GSP Q=2.0585(1-e-[0.0016(t-0.0233)]0.4415)0.9827 GSP-L Q=0.7311(1-e-[0.0074(t-0.2019)]0.3030)0.9836 GSP-FL Q=0.5714(1-e-[0.0505(t-0.0492)]0.4848)0.9920 GSP-G Q=9.9378(1-e-[0.0001(t-0.1501)]0.5313)0.9969 GSP-FLGQ=3.5(1-e-[0.0002(t-0.0978)]0.442) 0.9893 Ritger-peppas方程GSP Q=0.1174(t0.4037) 0.9851 GSP-L Q=0.1470(t0.2461) 0.9789 GSP-FL Q=0.1377(t0.3048) 0.9747 GSP-G Q=0.0783(t0.5282) 0.9973 GSP-FLGQ=0.0835(t0.4278) 0.9913
3 讨论
体外透皮实验时接收液应该满足漏槽条件,常用的透皮接收液有生理盐水、等渗磷酸盐缓冲液等,对一些脂溶性强的物质,常在接收液中加入醇类和非离子表面活性剂等。GSP作为聚合物,低聚部分分子量小,水溶性好,随着聚合度增加,溶解度逐渐降低[13-14]。前期尝试过在生理盐水、PBS中加入吐温20、无水乙醇来进行溶解度考察,发现GSP在无水乙醇-生理盐水中具有较好的溶解度且满足漏槽条件,但超过20%的乙醇对皮肤有较强脂质提取和屏障破坏作用,并且容易挥发[15],所以在实验中选择20%乙醇-生理盐水作为接收介质。透皮吸收首选的皮肤屏障是人体皮肤,但由于获得人体皮肤组织较为困难,常用动物皮肤来代替。在使用大鼠皮肤出现了药物的累积透过量低的问题,为减少皮肤差异性的问题,统一采用同一批昆明种小鼠的腹部皮肤作为渗透膜进行透皮实验。
透析袋实验中,通过释药曲线与拟合方程分析GSP-FL及GSP-FLG的释药机制,由释药曲线推测,GSP-FL组释药分为快释和缓释,在10 h后药物开始缓慢释放,推测药物快释过程是由于柔质体中未被包载药物的快速释放。而GSP-FLG组也表现出同样的释药规律,12 h后包裹于脂质体中的药物通过凝胶缓慢释放药物,推测药物快释是由于凝胶剂中附在脂质体表面的或包埋较浅的原花青素或未被包载的游离药物的释放,12 h后包裹在脂质体中的药物通过凝胶缓慢释放。脂质体被致密的凝胶基质固定,使得其聚集、相容更加困难,增加脂质体的稳定性,也进一步增强了药物的缓释效果,徐蕾[16]在进行高乌甲素脂质体凝胶透皮释药考察的实验中也得出了同样的释药规律。通过透析袋释药初步考察脂质体凝胶的释放过程,发现GSP-FLG的释放过程符合Ritgerpeppas释放特性。陈积[17]进行体外透皮实验发现,复方莪术油脂质体凝胶中吉马酮和维A酸24 h的累积透皮量均显著低于复方莪术油凝胶,可长时间稳态释药,具有缓释作用,相较于药物凝胶,脂质体凝胶的缓释作用更加显著。
本实验比较了GSP、GSP-L、GSP-FL的体外透皮性能,游离的GSP表现出突释效果,将其制备为柔质体后,可显著降低其释放速率,达到缓释效果。相比GSP-L,由于GSP-FL的柔韧性和形变性,表现出更高的累计释放率和透皮速率。GSP-FL的皮肤滞留量显著高于GSP,说明将其制备为柔质体能使药物更多地滞留在皮肤内。而将柔质体进一步制备成凝胶后可减少其流动性,使药物长时间与皮肤接触,皮肤滞留量更高,有利于药物在皮肤局部发挥作用;并且水凝胶无油腻感,易涂展,局部给药后易吸收,具有制备工艺简单、稳定性好等优点[18]。张小灵[19]制备的双丹脂质体凝胶剂具有较强缓释作用,可延长给药时间,皮肤内药物贮量较大,药物大多蓄积在真皮层中,有利于瘢痕的治疗。时军等[20]制备的丹皮酚阳离子脂质体凝胶的累积透过量、药物透皮速率与皮肤蓄积量亦显著大于普通凝胶。有研究报道,GSP具有抑制酪氨酸酶的活性[21],而酪氨酸酶是黑色素生成的关键限速酶[22-23],因此有望将GSP-FLG开发为具有美白功效的化妆品制剂,但其效果还需要进一步实验验证。
本研究以柔质体为载体,并将其进一步制备成凝胶剂,实现了皮肤局部给药并具有缓释的效果,充分发挥了柔质体和凝胶剂的优势,具有广阔的应用前景。
