血塞通滴丸整合溶出度测定方法的建立
2022-03-30闫伟伟罗慧玉唐殿飞丁杰陈正源张家口市食品药品检验中心河北张家口075000
闫伟伟,罗慧玉,唐殿飞,丁杰,陈正源(张家口市食品药品检验中心,河北 张家口 075000)
血塞通滴丸是由三七总皂苷提取物应用固体分散技术制成的制剂,具有活血祛瘀、通脉活络等多种功效。临床上多用于治疗中风偏瘫、心脉脑络癖阻、胸痹、心绞痛及脑血管病后遗症等多种病症。查阅资料发现,目前已有关于血塞通滴丸临床应用、制备工艺、定性鉴别及含量测定等方面的研究,但未涉及到溶出度相关报道。溶出度是模拟口服固体制剂在胃肠道中的崩解和溶出情况用来评价制剂活性成分的体内生物利用度和药物的内在品质,会影响药物的吸收并反映制剂的工艺。本试验以三七总皂苷中的三七皂苷R、人参皂苷Rg、人参皂苷Re、人参皂苷Rb和人参皂苷Rd 为指标成分,通过质量权重系数法对皂苷组分进行溶出度整合并以此表征其整体溶出情况,为血塞通滴丸的溶出度检测提供准确可行的检验方法,为其质量控制及评价提供参考。
1 材料
LC-2010A HT型高效液相色谱仪(岛津公司);CPA225D分析天平(德国赛多利斯集团,感量:0.01 mg);RCZ-8M溶出仪(天大天发科技有限公司);Milli-Q Integral纯水/超纯水机(美国Millipore 公司)。血塞通滴丸信息见表1。对照品三七皂苷R(批号:110745-201921,纯度:90.4%)、人参皂苷Rg(批号:110703-201530,纯度:91.7%)、人参皂苷Re(批号:110754-202028,纯度:93.9%)、人参皂苷Rb(批号:110704-202028,纯度:93.1%)和人参皂苷Rd(批号:111818-201603,纯度:92.1%)(中国食品药品检定研究院)。甲醇、乙腈为色谱纯,磷酸、冰醋酸、磷酸二氢钾、醋酸钠均为分析纯,水由超纯水机制备。
表1 血塞通滴丸样品信息
Tab 1 Sample information of Xuesaitong dropping pills
编号 厂家 批号 生产年份A-1 朗天药业 20190401 2019 B-1 昆药集团 181004 2018 B-2 昆药集团 191243 2019 B-3 昆药集团 200113 2020 C-1 神威药业 19082721 2019
2 方法与结果
2.1 色谱条件[10-11]
色谱柱:Thermo C色谱柱(4.6 mm×250 mm,5 μm);流动相:乙腈-水,梯度洗脱(0~21 min,22% 乙 腈;21~45 min,22%~48%乙腈;45~55 min,48%~55% 乙 腈;55~60 min,55% 乙腈;60~62 min,55%~22%乙腈;62~72 min,22% 乙腈);流速:1.0 mL·min;检测波长:203 nm;柱温:30℃;进样量:20 μL,记录色谱图(见图1)。
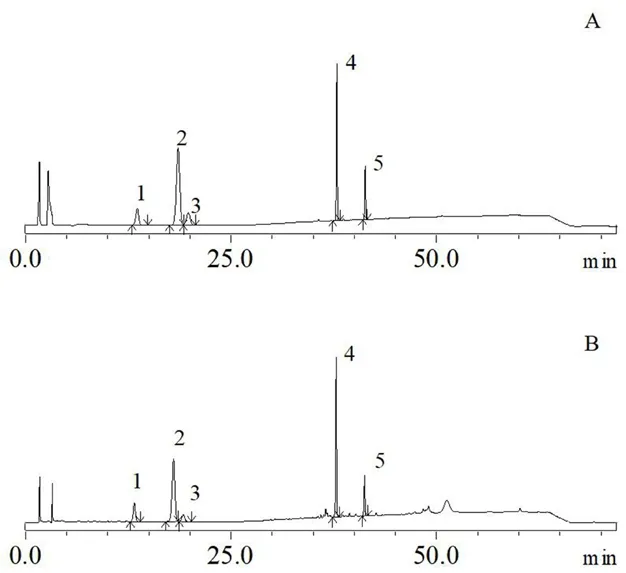
图1 混合对照品(A)和供试品溶液(B)的HPLC图Fig 1 HPLC of mixed reference(A)and sample solution(B)
2.2 溶液的制备
2.2.1 混合对照品溶液的制备 分别精密称取三七皂苷R及人参皂苷Rg、Rb、Rd对照品各22.90、23.32、22.40、21.82 mg,分别置于5 mL棕色量瓶中,加甲醇稀释至刻度,得质量浓度分别 为4.1403、4.2769、4.1709、4.0192 mg·mL的对照品储备液;另精密称取人参皂苷Re对照品13.37 mg置于25 mL棕色量瓶中,加甲醇稀释至刻度,得质量浓度为0.5022 mg·mL的人参皂苷Re对照品储备液。精密量取上述各储备液适量置于同一10 mL棕色量瓶中,加甲醇定容,得三七皂苷R0.041 40 mg·mL,人参皂苷Rg、Re、Rb、Rd质量浓度分别为 0.1634、0.016 72、0.1564、0.050 24 mg·mL的混合对照品溶液。
2.2.2 供试品溶液的制备 以脱气后的200 mL水为溶出介质,转速为50 r·min,照溶出度测定法《中国药典》2020年版四部通则0931溶出度测定方法第三法(小杯法)操作;取滴丸10粒,共6份,称定质量后投入溶出杯中,立即启动溶出仪并计时。于2、5、8、10、15、20、25、30、45 min分别取样,每次1 mL,同时补充等量同温度的水,各时间点溶出液置0℃以下放置30 min,待基质析出后,迅速滤过,即得。
2.2.3 含量测定溶液的制备 取本品50 粒,精密称定质量,计算平均粒重,研细,取约相当于10粒质量的粉末,精密称定,置于200 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,置0℃以下放置30 min,待基质析出后,迅速滤过,即得。
2.3 方法学考察
2.3.1 线性关系考察 精密吸取“2.2.1”项下各对照品储备液适量,加甲醇分别稀释制成不同质量浓度的对照品溶液,进样测定,以峰面积为纵坐标(Y
),质量浓度(mg·mL)为横坐标(X
)绘制标准曲线,结果见表2。表2 各指标成分的线性方程和相关系数
Tab 2 Linear regression equation and related coefficient of index components
成分 线性方程 R2 线性范围/(mg·mL-1)三七皂苷R1 Y=6.53×106X+1.16×104 0.9996 0.005 18~0.207人参皂苷Rg1 Y=8.03×106X-5.18×104 0.9991 0.0107~0.534人参皂苷Re Y=6.49×106X-3.46×103 0.9995 0.002 51~0.0502人参皂苷Rb1 Y=4.69×106X+1.41×104 0.9994 0.0130~1.043人参皂苷Rd Y=5.84×106X-2.58×103 0.9997 0.003 36~0.502
2.3.2 精密度试验 取“2.2.1”项下混合对照品溶液,连续进样6次,三七皂苷R和人参皂苷Rg、Re、Rb、Rd峰面积的RSD
分别为 0.28%、0.63%、0.56%、0.40% 和0.72%,表明仪器精密度良好。2.3.3 重复性试验 取“2.2.2”项下的15 min溶出液(批号:200113)共6份,进样检测,结果三七皂苷R和人参皂苷Rg、Re、Rb、Rd峰面积的RSD
分 别 为1.3%、1.3%、1.8%、1.5%和1.9%,表明方法重复性良好。2.3.4 稳定性试验 取“2.2.2”项下的15 min溶出液(批号:200113),分别在0、2、4、8、12、24 h进样,结果三七皂苷R和人参皂苷Rg、Re、Rb、Rd峰面积的RSD
分别为0.86%、0.62%、1.1%、1.1% 和0.91%,表明供试品溶液在24 h内稳定。2.3.5 加样回收试验 取批号为200113样品,精密称定6份,每份约0.2447 g,分别置于25 mL量瓶中,按大致1∶1比例进行加样,用甲醇稀释至刻度,滤过,精密量取5 mL置于25 mL量瓶中,用水稀释至刻度,0℃以下放置30 min,待基质析出后,滤过,进样,记录色谱峰并计算回收率。结果三七皂苷R和人参皂苷Rg、Re、Rb、Rd的平均回收率分别为99.68%、99.60%、98.36%、97.60%、97.99%,RSD
分别为0.69%、0.62%、0.64%、0.46%、0.73%。2.4 溶出度计算
2.4.1 溶出度计算 以各时间点溶出液的色谱峰面积按线性方程计算该成分的溶出量(M
),公式中C
为某时间点的质量浓度(mg·mL),V
为溶出介质体积(mL),V
为取出液体积(mL)。取“2.2.3”项下溶液,按“2.1”项下色谱条件测定样品峰面积,计算各指标成分的含量(以mg·g计),含量乘以溶出样品的质量计算该成分的累计溶出量(M
)。溶出度公式为:Q
=M/M
×100%,Q
为t
时间某成分的溶出度。2.4.2 整合溶出度计算 中药具有多组分、整体论治的特点,仅靠对单一活性药物成分进行溶出行为的考察指标评价其质量,不能全面体现中药多成分协同作用的特点。本试验参考文献,通过引入质量权重系数,以质量分数为各指标项的权重系数(即质量分数权重系数)综合表征血塞通滴丸皂苷组分的溶出度,以客观真实地反映血塞通滴丸皂苷组分的整体溶出情况。其中,以皂苷组分的质量分数为整体单位,即为质量权重系数参照,各指标成分质量权重系数为该成分与组分质量分数之比。各成分质量权重系数公式如下:
φ
=(933.13/4737.72)×100%=19.70%,φ
=(801.01/4737.72)×100%=16.91%,φ
=(917.14/4737.72)×100%=19.99%,φ
=(1109.29/4737.72)×100%=23.41%,φ
=(947.15/4737.72)×100%=19.99%。根据每一时间点下5种指标成分的溶出度(Q
)与各自的权重系数,计算血塞通滴丸在该时间点下的整合溶出度,则Q
=φ
×Q
+φ
×Q
+φ
×Q
+φ
×Q
+φ
×Q
。2.5 溶出条件的选择
2.5.1 溶出介质的选择 以批号为200113的血塞通滴丸为研究对象,采用小杯法测定,固定其他条件不变,分别考察了水、pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液为溶出介质时的整合溶出度,以该样品在3种溶出介质中的整合溶出度为纵坐标、溶出时间为横坐标,绘制3种介质中的整合溶出曲线,见图2。结果表明溶出介质的改变对整合溶出度影响较大,选择水作为溶出介质时,血塞通滴丸溶出迅速,在样品达到溶出平衡后,整合溶出度最大,因此确定水作为溶出介质。
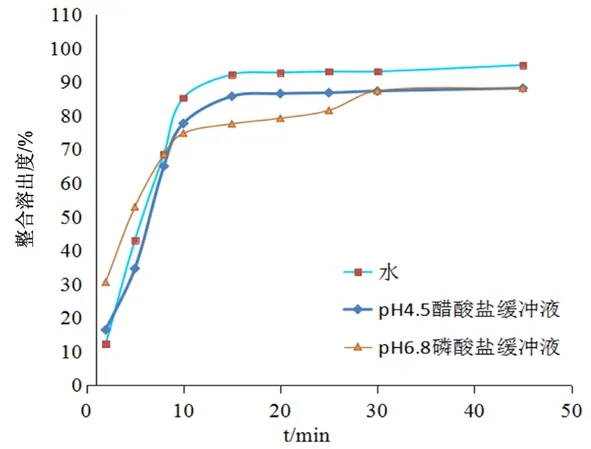
图2 血塞通滴丸在不同介质中的整合溶出度Fig 2 Integrated dissolution in different dissolution media of Xuesaitong dropping pills
2.5.2 转速的选择 按拟定溶出条件,采用小杯法测定,固定其他条件不变,以50 r·min与75 r·min进行转速筛选,结果表明两种转速条件下的整合溶出度比较接近,且在50 r·min转速下15 min时整合溶出度即可达85%,因此确定转速为50 r·min。
2.5.3 限度和取样时间的选择 以B厂家的3批次样品为研究对象,按拟订条件进行累计溶出度测定,结果见图3。根据文献确定溶出度取样时间点为溶出曲线中第一次连续两点平均溶出度均在85%以上,且此两点溶出度的平均值之差在5% 以内(即“平台期”)时的第一时间点,并将该点溶出度减去15%作为溶出限度。本实验的3批次样品在15 min时溶出趋于平稳,溶出度在85%以上,故确定取样时间点为15 min,同时,该点的溶出度减去15%为77.03%,确定溶出限度为75%。
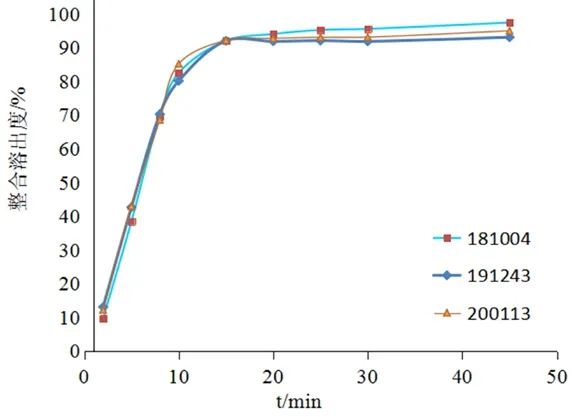
图3 B厂家样品整合溶出度曲线Fig 3 Integrated dissolution curve of samples from manufacturer B
2.6 溶出曲线绘制与比较
以批号为200113的血塞通滴丸为研究对象,绘制了5种指标成分溶出度与整合溶出度的溶出曲线,结果见图4;以整合溶出度为参比,采用非模型依赖的相似因子(f
)法比较各成分溶出曲线的相似性。f
的计算公式为: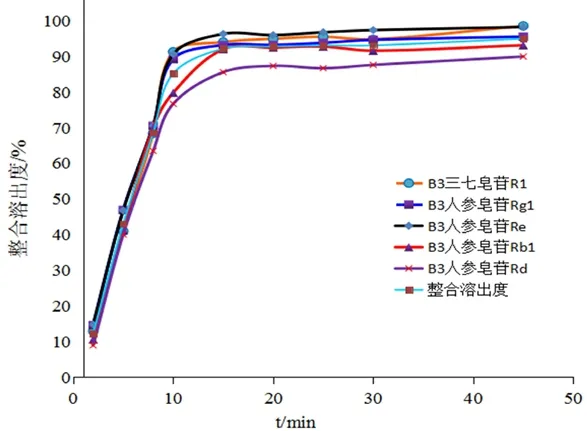
图4 5种指标成分与整合溶出度溶出曲线Fig 4 5 indexes and integrated dissolution curve

n
为时间点个数,R
为参比样品(或变更前样品)在t
时刻的溶出度值,T
为试验批次(变更后样品)在t
时刻的溶出度值。f
越接近100,相似度越高;当f
在50~100时,表示溶出行为相似,无显著性差异。通过计算,本样品中三七皂苷R及人参皂苷Rg、Re、Rb和Rd 的f
因子分别为76.2389、80.3563、70.7574、80.9373和62.0467,均大于50,表明整合溶出曲线与5种指标成分的溶出曲线相似性较好,可以反映血塞通滴丸皂苷组分的整体溶出情况。2.7 溶出模型拟合与比较
取批号为200113血塞通滴丸,采用不同的模型进行拟合,推测药物溶出机制,结果见表3,以Weibull模型最好。选用Weibull模型计算该批次样品溶出参数T
、T
和T
,结果分别为3.87 min、5.19 min和12.33 min,表明血塞通滴丸在15 min内溶出度可达到85%以上,可实现速效的目的。表3 整合溶出度拟合结果
Tab 3 Fitting of integrated dissolution
模型 拟合方程 R2零级释放方程 Q=1.4905t+48.5300 0.4996一级释放方程 ln(1-Q)=-0.0637t+3.8157 0.6993 Weibull方程 ln[1/(1-Q)]=1.0383lnt-5.3163 0.9267 Peppas方程 lnQ=0.6107lnt+2.6312 0.7680 Higuchi方程 Q=14.3210t1/2+19.0630 0.6826
2.8 样品测定
按拟定溶出度测定方法对3个企业5批次血塞通滴丸样品进行溶出度试验,平均整合溶出度见表4,不同企业的血塞通滴丸样品在15 min时溶出度均已达到所设定的限度要求。
表4 5批血塞通滴丸溶出度试验测定(=6)
Tab 4 Dissolution of 5 batches of Xuesaitong dropping pills (=6)
批号 整合溶出度/% RSD/%20190401 90.36 0.85 181004 92.06 1.26 191243 92.03 1.08 200113 92.20 1.35 19082721 86.03 0.95
3 讨论
由于血塞通滴丸样品中每粒滴丸含三七总皂苷较少,5种指标成分含量相对较低,为提高准确度,本试验选择考察10粒血塞通滴丸的溶出度,同时选择小杯法,溶出介质体积选择 200 mL,以降低试验偏差。有文献报道三七总皂苷在pH 1.0盐酸溶液中不稳定,易发生水解而生成脂溶性苷元;在预试验时,课题组以pH 1.2盐酸溶液为溶出介质时,有部分成分色谱峰未检测到,故本试验仅选用pH 4.5醋酸盐缓冲液、pH 6.8磷酸盐缓冲液和水进行溶出曲线的测定及溶出介质的筛选。
为使各色谱峰与相邻峰分离度大于1.5,本试验参考文献并进行优化,确定以乙腈-水流动相系统进行梯度洗脱,取得了满意的分离效果,且理论板数按人参皂苷Rg计算大于6000。本试验同时对比了各指标成分的含量与溶出60 min后快速搅拌30 min(250 r·min)的最大溶出量的差异以确定完全溶出点,结果两种方法含量无明显差别,故确定以制剂自身含量为完全溶出点,作为溶出度的计算参照,以准确反映样品的真实溶出度。
滴丸制剂在制备过程中混有不同比例的聚乙二醇等成型基质,容易对仪器及系统造成严重损害,根据血塞通滴丸含量测定方法,将样品溶液置于0℃以下30 min,待基质析出后再过滤进样可减少对仪器的损害。
