巨噬细胞外泌体-脂质体杂化纳米粒的制备及表征
2022-03-30鲍倩倩王强桑冉王雷陈卫东安徽中医药大学药学院合肥230012中药复方安徽省重点实验室合肥230012药物制剂技术与应用安徽省重点实验室合肥230012蚌埠医学院第一附属医院安徽蚌埠233000蚌埠医学院安徽蚌埠233030
鲍倩倩,王强,桑冉,王雷*,陈卫东*(1. 安徽中医药大学药学院,合肥 230012;2.中药复方安徽省重点实验室,合肥 230012;3. 药物制剂技术与应用安徽省重点实验室,合肥 230012;4. 蚌埠医学院第一附属医院,安徽 蚌埠 233000;5. 蚌埠医学院,安徽 蚌埠 233030)
外泌体(exosomes,Exos)是一种几乎所有类型的细胞都会分泌的细胞外囊泡,其直径约为100 nm。近年来,Exos作为载药体系受到了越来越广泛的关注,与其他载药系统相比,Exos因源于自体而具有免疫原性低、生物相容性高等特点;更重要的是,Exos具有潜在的靶向能力,有助于提高药物的靶向能力。但载药量较低、修饰的灵活性低,且稳定性差等缺点极大地制约了Exos作为药物载体的进一步开发应用。
脂质体(liposomes,Lips)是磷脂在水中形成的一种具有磷脂双分子层的囊泡,粒径一般在40~200 nm。Lips因其载药性能良好、易于制备和修饰灵活而被作为药物载体广泛应用,但Lips属于外源性物质,易被单核巨噬细胞系统快速清除且靶向性较差。Exos与Lips在结构上相似,都具有脂质双分子层,粒径相近;在生理功能上,两者具有良好的互补性。因此,将这两种纳米囊泡融合形成一个新的杂化纳米囊泡可以保留两者的优点。这种巨噬细胞外泌体-脂质体杂化纳米粒(macrophages derived exosomes-liposomes hybrid nanoparticles,MEL NPs)同时具有Exos的内源性和Lips修饰的灵活性,还能提高Exos的稳定性。基于此,本研究采用超声法融合Exos与Lips,并对融合后的MEL NPs进行表征,为MEL NPs作为药物载体的后续研究提供基础。
1 材料
1.1 仪器
DF-101S集热式恒温磁力搅拌器(巩义市予华仪器有限责任公司);Tecnai G2 SpirtBiotwin透射电子显微镜(美国赛默飞公司);Nano ZS90马尔文粒度分析仪(美国马尔文公司);anti-JP-1高速低温离心机、L-90K超高速低温离心机、CYTOMICS FC 500流式细胞仪(美国贝克曼公司);F-4600荧光分光光度计(日本Hitachi公司);THUNDER 倒置荧光显微镜(德国徕卡公司);JY92-Ⅱ超声波细胞粉碎机(宁波新芝生物科技股份有限公司)。
1.2 试药
DMEM高糖培养基、青霉素-链霉素、胎牛血清(美国Hyclone公司);细胞膜橙色荧光探针(DiI)染料(大连美仑生物技术有限公司);细胞膜红色荧光探针(DiD)、细胞膜绿色荧光探针(DiO)染料(上海碧云天试剂公司);3%醋酸双氧铀染液(河南锐欣实验用品有限公司);胆固醇、蛋黄卵磷脂(上海源叶生物科技有限公司);泊洛沙姆188(北京金克隆生物技术有限公司);多聚甲醛、DAPI、抗荧光淬灭剂(安徽Biosharp公司);一抗稀释液、HRP标记的山羊抗兔IgG、ECL发 光 液(山 东SparkJade公 司);TSG101、Alix抗体(成都正能生物公司)。
1.3 细胞
小鼠腹腔巨噬细胞Raw 264.7和肝癌细胞Hepa 1-6购自中国科学院上海细胞库。
2 方法
2.1 细胞培养
小鼠腹腔巨噬细胞Raw 264.7在37℃、5% CO恒温培养箱中,采用含10%胎牛血清的DMEM高糖培养基培养。待细胞融合度到80%左右,用不完全培养基继续培养24 h后,收集细胞上清液。
2.2 Exos提取
采用超高速离心法提取Exos,细胞上清液4℃、300 g离心10 min去除细胞,然后4℃、2000 g离心10 min去除死细胞,4℃、10 000 g离心30 min去除细胞碎片。取上清液4℃、100 000 g离心70 min,所得沉淀即为Exos粗提物。沉淀用PBS重悬后,于4℃、100 000 g离心70 min,所得沉淀用PBS重悬后保存在-80℃备用。
2.3 Lips制备
精密称取处方量的蛋黄卵磷脂、胆固醇,溶于3 mL无水乙醇中,处方量的泊洛沙姆188溶于50℃预热的20 mL ddHO中,用1 mL注射器在液面下将溶解完全的有机相缓慢注入至水相中,50℃,1000 r·min搅拌2 h使有机溶剂挥发,即得Lips。
2.4 MEL NPs的制备
采用超声孵育法制备MEL NPs:取4份Exos(200 μg蛋白)分别与200、1000、2000、4000 μg的Lips混合均匀后用PBS定容至500 μL,80 W超声10 min(5 s开,5 s关)后,37℃孵育1 h。
2.5 MEL NPs的表征
2.5.1 形态学观察 各取10 μL的Exos、Lips、MEL NPs稀释液滴加在铜网上,用1%醋酸双氧铀染液进行染色,染色完成后用滤纸吸去多余的染液,在透射电镜下观察其形态。
2.5.2 粒径和Zeta电位 取Lips、Exos、MEL NPs母液,适量稀释后测定纳米囊泡的平均粒径以及Zeta电位。
2.5.3 外泌体的标志性蛋白检测 使用适量的RIPA裂解液(含1%PMSF溶液)提取Raw 264.7细胞、Exos以及MEL NPs总蛋白,定量后调整蛋白浓度,100℃煮沸8 min后进行电泳,转膜,封闭,洗涤和孵育抗体(TSG101和Alix抗体浓度为1∶1000,二抗浓度为1∶12 000),ECL发光液显影曝光。
2.5.4 荧光共振能量转移分析 荧光共振能量转移(fluorescence resonance energy transfer,FRET)是指当一个供体荧光基团的发射光谱与受体荧光基团的激发光谱有部分重叠,当两个基团的距离足够接近时,处于激发状态的供体能将其荧光能量转移给受体,从而激发受体的荧光。膜融合会导致两个荧光基团的距离增加,FRET效应减弱,供体的荧光强度随着融合的进行而恢复,相反,受体的荧光强度降低。本研究以DiI作为荧光供体,DiD作为荧光受体,两者按摩尔比1∶7加至脂质体中得到FRET脂质体,去除游离染料后与Exos融合得到MEL NPs,测量Lips和MEL NPs在550~750 nm的荧光光谱,通过MEL NPs中DiD荧光强度的减弱判断是否发生融合。
2.6 MEL NPs 的细胞摄取
在MEL NPs中加入适量DiO染料,37℃避光孵育15 min,10 000 g离心10 min初步去除多余的染料,然后将上清液转移至100 kDa超滤离心管内,10 000 g离心10 min,弃去上清液,加入200 μL PBS重悬,重复3次,即得DiO标记的MEL NPs。
将Hepa 1-6细胞以适宜的密度接种于覆盖有细胞爬片的12孔板中,待细胞贴壁后,加入DiO标记的MEL NPs共孵育2 h后,4%多聚甲醛固定15 min,DAPI标记细胞核,抗荧光淬灭剂封片,倒置荧光显微镜观察。
将Hepa 1-6细胞以适宜的密度接种于6孔板中,待细胞贴壁后,加入DiO标记的MEL NPs共孵育2 h后,预冷的PBS洗涤细胞3遍,加入胰酶消化细胞,1200 r·min离心5 min,弃去上清液。预冷的PBS洗涤细胞两次,弃上清液,PBS重悬,流式细胞仪上机检测。
3 结果
3.1 MEL NPs的制备条件优化
以粒径、PDI和FRET效应作为考察指标,考察Exos与Lips的比例对MEL NPs制备的影响,结果见表1。由表1可知,各条件下制备的MEL NPs粒径均在100 nm左右,尺寸分布比较均匀,稳定性良好。Exos与Lips的比例为1∶1、1∶5和1∶10时,FRET效应减弱,证明Exos与Lips融合成功。研究表明,不同比例的Exos和Lips混合会改变杂化纳米粒中Exos和Lips的百分比,且在一定范围内,随着Lips比例的增大,杂化纳米粒中Lips的比例也会随之增大。由于MEL NPs的建立是为后期载药奠定基础,而药物是载在Lips中,考虑到载药量、同时保留Exos的内源性优势,选择1∶5进行后续研究。
表1 Exos与Lips的比例对MEL NPs的影响(=3)
Tab 1 Influence of different Exos to Lips ratios on MEL NPs (=3)
Exo∶Lips 粒径/nm PDI FRET效应减弱1∶1 114.83±2.91 0.17±0.02 有1∶5 97.25±2.66 0.20±0.02 有1∶10 115.63±1.60 0.16±0.002 有1∶20 102.56±2.77 0.17±0.02 无
3.2 MEL NPs的表征
3.2.1 形态表征 纳米粒的形态见图1。Lips、Exos与MEL NPs均呈囊泡状结构,这些纳米囊泡大小相似,形态近似球形。
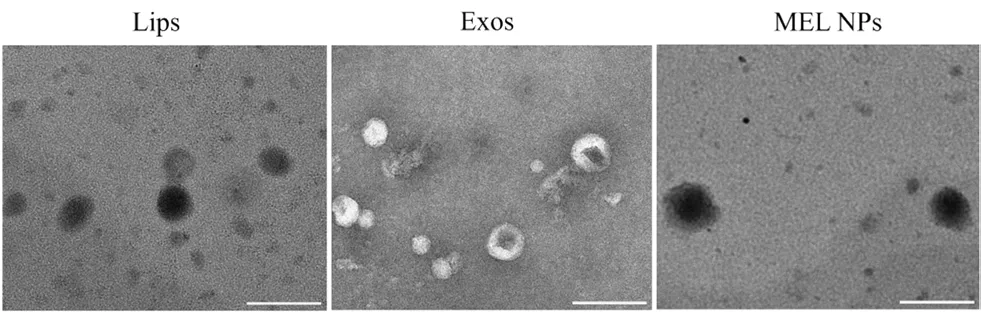
图1 透射电镜观察Lips、Exos和MEL NPs的形态(标尺:200 nm)Fig 1 Morphology of Lips,Exos and MEL NPs were imaged with transmission electron microscopy(scar bar:200 nm)
3.2.2 粒径及Zeta电位表征 结果见图2,Lips、Exos和MEL NPs的粒径分别为(91.79±0.31)nm(PDI=0.16±0.003)、(127.17±0.45)nm(PDI=0.22±0.01)和(98.20±0.45)nm(PDI=0.17±0.02),Zeta电位分别为(-24.53±0.58)mV、(-13.13±0.34)mV和(-16.23±1.00)mV。MEL NPs的粒径大于Lips,可能是Lips与Exos的融合增加了水分子的相互作用点,从而增加了水化层数。此外,相较于Exos,MEL NPs的电位和PDI有所降低,表明MEL NPs具有良好的尺寸均匀性和稳定性。

图2 马尔文纳米粒度仪检测Lips、Exos和MEL NPs的粒径(A)和Zeta电位分布(B)Fig 2 Size distribution(A)and Zeta potential(B)of Lips,Exos,and MEL NPs measured by dynamic light scattering
3.2.3 Western blot表征 结果见图3,所提取的Exos和超声融合后的MEL NPs均表达Alix和TSG101蛋白,且表达量显著高于Raw 264.7细胞,表明超声融合不影响外泌体的性质。
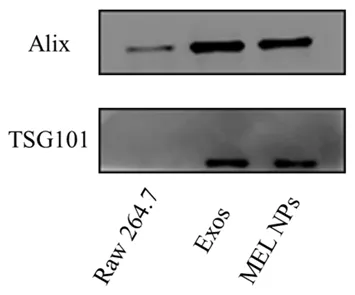
图3 Western blot检测融合后外泌体标志蛋白的Alix和TSG101的表达Fig 3 Exos markers Alix and TSG101 detected by Western blot after the fusion
3.2.4 FRET表征 结果见图4,Lips光谱为融合前,MEL NPs光谱为融合后,融合后MEL NPs的DiI荧光强度恢复,DiD荧光强度降低,FRET效应减弱,表明FRET荧光供体和受体之间的距离增加,Lips与Exos成功融合。

图4 FRET验证Lips与Exos融合Fig 4 Verify Lips and Exos fusion through FRET
3.3 MEL NPs的细胞摄取
由图5可知,相比Lips,Hepa 1-6细胞对于MEL NPs的摄取有所增加,表明超声融合并未破坏Exos的体外靶向能力。

图5 倒置荧光显微镜(A)和流式细胞仪(B)检测Hepa 1-6 细胞对Lips和MEL NPs的摄取Fig 5 Inverted fluorescence microscope(A)and flow cytometry(B)recorded the uptake of Lips and MEL NPs by Hepa 1-6 cells
4 讨论
巨噬细胞是先天性免疫细胞的主要组成部分,其在炎症调节和肿瘤的发生、发展中起着至关重要的作用。Exos可以携带亲本细胞的信息,从而具有亲本细胞的功能。例如,人巨噬细胞Exos可以携带高水平的miR-142和miR-223,在进入肝癌细胞后,抑制肝癌细胞的增殖。M1型巨噬细胞Exos可以诱导肿瘤局部炎性微环境,从而增强紫杉醇的体内抗肿瘤作用。巨噬细胞Exos在肿瘤和炎症中的重要作用以及其内源性的优点,让其作为药物载体受到了研究者越来越广泛的关注。但Exos载药量的不足可能会限制其进一步的应用,而Lips在载药量方面具有显著优势,将Exos和Lips融合可以将两者的优势结合,同时规避各自的劣势。这种混合膜杂化纳米粒载药系统近年来受到了国内外学者的广泛关注。Rayamajhi等将巨噬细胞来源的小细胞外囊泡与负载阿霉素的Lips融合,制备出具有靶向能力且可在酸性条件下pH敏感性释放药物的混合膜杂化纳米粒。Cheng等将过表达CD47的CT26细胞Exos与负载光热剂的热敏Lips融合制备混合膜杂化纳米粒,该杂化纳米粒可以通过竞争性结合SIRPα
来增强巨噬细胞对肿瘤细胞的吞噬,并可以通过近红外激光照射光热剂消融肿瘤细胞,具有优异的体内外抗肿瘤效果。混合膜杂化纳米粒载药系统同时具有Exos和Lips的优点,表现出优异的靶向性,高载药量和对单核巨噬细胞系统的逃避,是一种很有应用前景的载药系统。Exos的提取方法主要有超高速离心法、免疫亲合法、PEG沉淀法、尺寸排阻色谱法和微流体技术等,其中超高速离心法因操作简单,成本相对低廉并且获得的Exos纯度较高而被广泛使用。
MEL NPs的制备方法主要有孵育法、超声法、反复冻融法,所有这些技术在Exos特性的保持方面各有优劣,孵育法可能导致制备的MEL NPs颗粒粒径不均一,而反复冻融过程中Exos蛋白可能遭到破坏。本研究采用超声法制备MEL NPs,通过马尔文粒度分析仪、透射电镜、荧光分光光度计、Western blot、倒置荧光显微镜以及流式细胞仪对其进行了一系列表征,发现超声融合在未破坏Exos内源性优势的同时提高其稳定性,这为其作为药物载体进行进一步研究提供了一定的基础。
