匹伐他汀钙光降解杂质的合成
2022-03-30林辉王正泽陈慧南京长澳医药科技有限公司南京210038
林辉,王正泽,陈慧(南京长澳医药科技有限公司,南京 210038)
匹伐他汀钙,化学名为(+)-双-{(3R
,5S
,6E
)-7-[2-环丙基-4-(4-氟苯基)-3-喹啉基]-3,5-二羟基-6-烯庚酸}单钙盐,是由日产化学工业株式会社和日本兴和株式会社共同研制的3-羟基-3-甲基戊二酰辅酶A(HMG-CoA)还原酶抑制剂,于2003年在日本上市,主要用于高胆固醇血症和家族性高胆固醇血症治疗。他汀类原料药如匹伐他汀钙、氟伐他汀钙、阿托伐他汀钙和瑞舒伐他汀钙等通常对光照敏感,原料药及制剂产品在生产和贮存过程中若曝露于光环境中,会发生光环化和光氧化反应,分解成不同类型的降解产物。文献报道匹伐他汀钙经曝光可分解为(+)-双-{(3R
,6E
)-7-[2-环 丙 基-4-(4-氟 苯 基)-3-喹 啉 基]-3-羟基-5-氧代-6-烯庚酸}单钙盐(简称5-酮体,1)和(+)-双-{(3R
,5S
)-5-[6-环 丙 基-7,8-二氢-10-氟苯并[k]菲啶-8-基]-3,5-二羟基戊酸}单钙盐(简称闭环体,2)。匹伐他汀钙及其光降解杂质结构式见图1。
图1 匹伐他汀钙及其降解杂质的结构式Fig 1 Structure of pitavastatin calcium and its photodegradable impurities
由于匹伐他汀钙对光照比较敏感,因此在工艺开发和处方研究时,需要考察光照对匹伐他汀钙及有关物质的影响。高效液相色谱(HPLC)法可以准确直观地反映各杂质的变化情况,是目前用于控制药物有关物质的主要方法,但其前提是获得被测杂质的对照品。本文主要研究了匹伐他汀钙光降解产物1和2的制备方法,可以为匹伐他汀钙原料药及制剂工艺研究、筛选合适的遮光剂和包装材料提供杂质对照品。
本课题组前期以匹伐他汀钙为原料,经2,3-二氯-5,6-二氰对苯醌(DDQ)氧化,再经柱层析分离得到化合物1,总收率为28%。但该方法通过饱和碳酸氢钠溶液淬灭反应,易析出大量固体,包裹产物,造成产物损失。DDQ氧化性较强,选择性较差,除了氧化C-5位羟基外,还会继续氧化C-3位羟基,生成副产物3,5-二酮体。DDQ在萃取或者柱层析工序中均不易去除,从而在产物中残留。产物极性大,柱层析分离纯化效果差,产物纯度仅96.0%。本研究最初参照文献方法,以二甲基亚砜为溶剂,采用二氧化锰(MnO)氧化匹伐他汀钙制备化合物1,但HPLC检测显示无目标产物1产生。后尝试采用铬氧化物、高锰酸盐、金属铑络合物和高价碘试剂氧化匹伐他汀钙,但这些氧化剂选择性差,副产物多,后处理复杂,产物难分离纯化。本研究在文献研究基础上,选择活性MnO氧化匹伐他汀游离酸得5-氧代匹伐他汀(3),再在碱性条件下成钙盐制得化合物1。合成路线如图2所示。该路线反应条件温和,可选择性氧化C-5位烯丙醇,不会引起双键的异构化,反应收率高;反应液为非均相,后处理只需简单地过滤;底物和产物为羧酸形式,产物易通过柱层析或者重结晶的方式分离纯化。
Grobelny等将匹伐他汀钙样品溶液暴露于紫外光中,HPLC检测到包含化合物2在内的4种光降解产物。文献报道了其他他汀类结构如氟伐他汀钙和瑞舒伐他汀钙在水中通过阳光或紫外光照射发生环化反应,产生非对映异构体二氢苯并咔唑和二氢苯并喹唑啉结构,并通过制备HPLC分离出毫克级样品用于结构确证。以上3种他汀类化合物均含邻乙烯基联苯结构,易发生光环化反应,生成稳定的类二氢菲结构,因此,本研究选择光环化的方法制备化合物2,最初采用匹伐他汀钙或匹伐他汀游离酸进行光环化,由于产物极性过大,柱层析分离纯化效果差。Cermola等利用重氮甲烷进行甲基化制得甲酯,降低光降解产物的极性,再经制备HPLC分离纯化。本研究参考上述方法,将匹伐他汀经对甲苯磺酸催化,分子内脱水内酯化得到匹伐他汀内酯(4),化合物4在光照条件下发生光环化反应制得内酯闭环体非对映异构体(5),再在碱性条件下水解、成盐转化为化合物2。合成路线如图2所示。该路线选择内酯结构作为底物进行光降解反应,产物极性降低,易分离纯化;底物溶解度更高,溶液状态有利于光环化反应。

图2 匹伐他汀钙5-酮体和闭环体的合成Fig 2 Synthetic routes of pitavastatin calcium 5-keto form and ring-closed form
1 仪器与试药
7890型高效液相色谱仪、6200 Q-TOF型质谱仪(美国Agilent公司);AV-500型核磁共振仪、AV-400型核磁共振仪(德国Bruker公司);ZF-1型三用紫外分析仪(上海光豪)。柱层析使用100~200目硅胶(青岛海洋化工五厂,试剂级)。匹伐他汀钙(江苏天晟药业有限公司,药用级);活性MnO(成都艾科达化学试剂有限公司);其他试剂均为市售分析纯。
2 方法
2.1 匹伐他汀的合成
在反应瓶中加入匹伐他汀钙(80.0 g)、乙酸乙酯(400 mL)和水(200 mL),室温下搅拌15 min。用10%盐酸调节pH 3,继续搅拌10 min,分液。水层用乙酸乙酯(100 mL×3)萃取。合并有机层用饱和氯化钠溶液(200 mL)洗涤,经无水硫酸钠干燥后抽滤,滤液减压蒸除溶剂,得无色油状物匹伐他汀(72.1 g,以匹伐他汀钙计收率为94.2%)。
2.2 匹伐他汀钙5-酮体(1)的合成
将匹伐他汀(30.0 g,71.18 mmol)溶于干燥二氯甲烷(300 mL)中分批加入活性MnO(116.3 g,1.07 mol),回流搅拌10 h。用硅藻土填充的漏斗抽滤,滤饼用二氯甲烷(50 mL×3)洗涤,合并滤液,减压蒸除溶剂。剩余物经硅胶柱色谱[洗脱液为二氯甲烷-甲醇(80~20∶1)]纯化剩余物得浅棕色油状物3。加入水(180 mL),用1 mol·L氢氧化钠调节pH为9。冰浴冷却,滴加1 mol·L乙酸钙(29 mL),搅拌1 h。抽滤,滤饼水洗涤,烘干,得浅黄色固体1(17.1 g,以匹伐他汀计收率为54.8%),纯度为99.0%[HPLC归一化法:色谱柱C柱(4.6 mm×250 mm,5 μm);流动相A为pH 3.8醋酸钠缓冲溶液,流动相B为乙腈,梯度洗脱(0→20 min:60%A,20→40 min:60%→30%A,40→65 min:30%A);检测波长245 nm;柱温40℃;流速1.0 mL·min。相对保留时间1.3(相对于匹伐他汀钙)]。mp. 139.6~140.6℃;H NMR(500 MHz,DMSO-d
)δ
:7.89(d,J
=8.35 Hz,1H,Ar-H),7.68(t,J
=7.45 Hz,1H,Ar-H),7.57(d,J
=16.5 Hz,1H,=CH),7.31~7.43(m,6H,Ar-H),6.34(d,J
=16.5 Hz,1H, =CH),5.61(br,1H,CHOH),4.16(s,1H,CH),2.53~2.63(m,1H,CH),2.40~2.45(m,1H,CH),2.15~2.19(m,1H,CH),2.05~2.10(m,1H,CH),1.26(s,2H,CH),1.09~1.10(m,3H,CH);C NMR(125 MHz,DMSO-d
)δ
:198.13(C=O),177.90,162.81,160.86,159.68,146.49,145.34,138.41,134.43,132.04,131.88,129.74,128.38,127.31,125.99,125.83,125.14,115.50,115.33,64.97,55.98,47.85,43.78,18.48,15.86,10.69,10.66;HRMS-ESI calcd for CHFNO[M-Ca +2H]420.1606,found 420.1609。2.3 匹伐他汀内酯(4)的合成
将匹伐他汀(10.0 g,23.73 mmol)溶于二氯甲烷(100 mL)中,加入一水对甲苯磺酸(0.5 g),回流搅拌4 h。冰浴冷却,加入饱和碳酸氢钠调节pH为7,分液。有机层用饱和氯化钠溶液(50 mL)洗涤,经无水硫酸钠干燥后抽滤,滤液减压蒸除溶剂。剩余物用乙酸乙酯-正己烷重结晶,得类白色固体4(8.4 g,以匹伐他汀计收率为87.8%)。mp. 127.1~127.9℃;H NMR(500 MHz,CDCl)δ
:8.05(d,J
=6.65 Hz,1H,Ar-H),7.67(t,J
=7.35 Hz,1H,Ar-H),7.31~7.45(m,2H,Ar-H),7.21~7.26(m,4H,Ar-H),6.77(d,J
=16.15 Hz,1H, =CH),5.69(dd,J
=1.65,16.15 Hz,1H,=CH),5.22(m,1H,CH),4.28~4.30(s,1H,CHOH),2.72~2.76(m,1H,CH),2.62~2.66(m,1H,CH),2.40~2.45(m,1H,CH),2.2(br,1H,CHOH),1.84(d,J
=14.25 Hz,1H,CH),1.66(dd,J
=2.4,13.4 Hz,1H,CH),1.40~1.42(m,2H,CH),1.11(d,J
=7.9 Hz,2H,CH);HRMS-ESI calcd for CHFNO[M+H]404.1656,found 404.1663。2.4 匹伐他汀钙闭环体(2)的合成
将4(5.0 g,12.39 mmol)溶于二氯甲烷(1000 mL)中。将溶液装入透明玻璃量瓶中,置于紫外灯下,365 nm波长照射5 d,减压蒸除溶剂。剩余物经硅胶柱色谱[洗脱液为正己烷-乙酸乙酯(1∶1~2)]纯化,得黄色油状物5。将5(3.5 g,8.68 mmol)溶于乙腈(35 mL),加入1 mol·L氢氧化钠(9 mL),室温搅拌3 h,减压蒸除溶剂。剩余物加入水(35 mL)稀释,冰浴冷却,滴加1 mol·L乙酸钙(5.2 mL,5.2 mmol),搅 拌2 h,抽 滤,滤饼水洗涤,烘干,得黄色固体2(2.9 g,以4计收率为52.7%),纯度为99.7%[HPLC归一化法:色谱条件同1,两个非对映异构体相对保留时间分别为0.53,0.55(相对于匹伐他汀钙),以两个非对映异构体峰面积总和计]。mp. 148.8~151.5℃;H NMR(500 MHz,MeOH-d
)δ
:8.39(t,J
=9.45 Hz,2H,Ar-H),7.95~8.00(m,4H,Ar-H),7.68(t,J
=7.1 Hz,2H,Ar-H),7.51~7.54(m,2H,Ar-H),7.32(d,J
=9.2 Hz,2H,Ar-H),7.17~7.21(m,2H,Ar-H),4.04~4.09(m,1H,CH),3.90~3.96(m,2H,CHOH),3.62~3.65(m,1H,CH),3.55~3.56(m,2H,CHOH),2.88~3.08(m,4H,CH),2.43~2.50(m,2H,CH),2.05~2.18(m,4H,CH),1.63~1.80(m,4H,CH),1.42~1.44(m,1H,CH),1.26~1.27(m,1H,CH),1.12~1.20(m,3H,CH),1.02~1.11(m,3H,CH);C NMR,DEPT(125 MHz,MeOH-d
)δ
:180.22,180.19,164.92,164.83,162.25,161.43,149.01,148.85,145.55,144.78139.91,139.67,139.91,132.67,132.37,129.96,129.80,129.61,129.42,129.35,129.32,128.82,126.75,126.70,126.18,126.12,124.25,124.17,118.03,117.56,114.70,114.30,71.01(CH),69.70(CH),69.51(CH),69.00(CH),46.71(CH),45.06(2C,CH,CH),45.03(CH),43.00(CH),42.47(CH),26.71(CH),27.61(CH),15.87(CH),9.27(CH),9.89(CH),8.26(CH),7.73(CH);F NMR(376 MHz,MeOH-d
)δ
: -114.1(s,Ar-F), -114.7(s,Ar-F);归属于其中信号较弱的异构体。HRMS-ESI calcd for CHFNO[M-Ca+2H]422.1762,found 422.1758。3 结果与讨论
本文在文献基础上对化合物1的合成方法进行了改进。原料使用匹伐他汀游离酸代替钙盐,降低了底物和产物的极性,容易通过柱层析分离纯化,产物纯度提高到99.0%(文献为96.0%)。氧化反应氧化剂用MnO代替DDQ,反应选择性更高,反应后处理简单。工艺优化发现反应温度、MnO的用量和加入方式对反应速率、副产物含量和反应收率影响较大,反应温度由室温提高至40~50℃,大大缩短了反应时间;优化MnO的用量为15当量(以匹伐他汀计),通过分批加入MnO的方式,可减少副产物4的生成。市售MnO粒度较小,过滤时加入硅藻土助滤,可以提升过滤速度。合成总收率提高至52%(文献为28%,以匹伐他汀钙计)。
化合物1的高分辨率质谱(HRMS)实测值和计算值误差在±0.0030之内,核磁共振氢谱(H NMR)和碳谱(C NMR)测试数据与文献报道一致。
本文从匹伐他汀钙光降解机制出发,首次报道采用光环化方法成功合成克级化合物2,总收率为44%,产物纯度为99.7%。4的光环化反应遵循邻乙烯基联苯类化合物的光环化反应机制:第一步底物4经光照射发生环化,产生不稳定非对映异构体混合物4';第二步,中间体4'由于失去芳香性,结构不稳定,会发生1,5-氢迁移反应,生成稳定的二氢苯并[k]菲啶结构5。反应机制如图3所示。
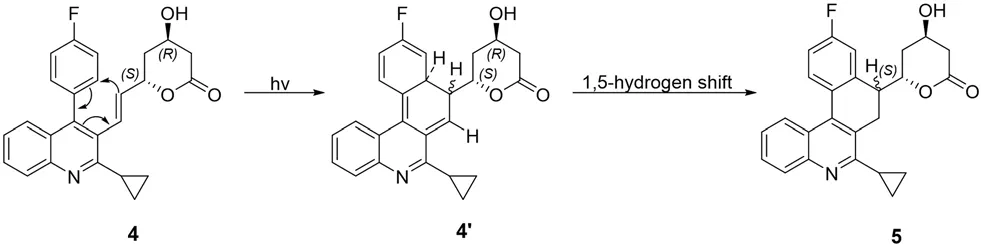
图3 化合物4光环化反应机制Fig 3 Mechanism of compound 4 photocyclization
化合物2的HRMS实测值和计算值误差在±0.0030之内,HPLC和核磁共振氟谱(F NMR)分别显示两组峰,表明2为非对映体混合物,HPLC的紫外峰积分比例约1∶1,与文献报道一致。徐敏等研究苯醚甲环唑非对映异构体发现,在核磁共振谱中非对映异构体相应的信号存在差别,特别是C NMR谱信号峰成对出现。2的H NMR谱中两种构型C-6位碳原子上的质子化学位移分别为δ
4.04~4.09和δ
3.90~3.96,积分比例约1∶1,与HPLC的UV峰积分一致。C NMR谱显示了50个信号,其中24组峰成对出现(一强一弱),2个重叠峰,分别对应非对映异构体中25个碳原子。DEPT谱显示分子中含 5组仲碳、11组叔碳和9组季碳,符合2的化学结构式。与匹伐他汀钙的NMR数据比较,发现其新增了一个附加环,少了一个烯键和一个芳香质子。4 结论
本研究成功合成了匹伐他汀钙5-酮体(1)和闭环体(2)两种光降解杂质,并经核磁共振氢谱、碳谱、氟谱、DEPT谱和HRMS等确证结构,纯度经HPLC检测均在99.0%以上,可以作为匹伐他汀钙原料药及其制剂质量控制的对照品。
