端粒酶协同蛋白1在宫颈鳞状上皮病变组织中的表达情况及其与高危型HPV E6/E7的相关性分析*
2022-03-29冯俊明李明松何福果徐开梅姚海波
陈 娟 ,冯俊明△ ,李明松 ,童 阔 ,何福果 ,徐开梅 ,姚海波
1.重庆市璧山区人民医院病理科,重庆 402760;2.四川省成都市妇女儿童中心医院病案统计室,四川成都 611731
宫颈癌是常见的妇科恶性肿瘤之一,研究已经证实宫颈上皮持续感染高危型人乳头瘤病毒(HPV)是导致宫颈癌发生发展的最主要原因[1]。高危型HPV的持续感染最终导致宫颈上皮内环境发生改变,如抑癌基因的失活、相关癌基因的激活、端粒酶的高表达等[2-3],最终导致宫颈上皮细胞异常增生、癌变。端粒酶活化与细胞分裂、增殖及永生化紧密相关,在肿瘤的发生发展中起重要作用。端粒酶是一种由人端粒酶RNA 组分(hTERC)、人端粒酶反转录酶(hTERT)及端粒酶协同蛋白1(TP1)3部分亚基构成的具有反转录酶活性的核糖核蛋白。端粒酶被激活后,可促使hTERC、hTERT 及端粒酶相关蛋白异常表达,细胞发生永生化,最终导致肿瘤的发生[4-5]。有研究报道,hTERC及hTERT的激活与宫颈癌的发生发展具有显著相关性,并与宫颈上皮内瘤变(CIN)的严重程度呈正相关[6-8]。但国内关于TP1与CIN 变相关性的报道较少。本研究探讨了TP1在宫颈鳞状上皮病变组织中的表达情况,分析了TP1表达与HPV E6/E7的相关性,旨在为临床判断CIN 级别提供有价值的实验室检测指标。
1 资料与方法
1.1 一般资料 采用回顾性研究的方法,将2018年12月至2019年12月在重庆市璧山区人民医院行高危型HPV E6/E7 mRNA 检测,结果为阳性且进行过宫颈病理学检查的患者纳入研究。纳入标准:宫颈病理组织标本直径>2 mm。排除标准:宫颈病理组织标本直径<2 mm 且富含大量黏液,不适宜做病理诊断及免疫组织化学染色的标本。经过筛选,本研究共纳入141例患者,年龄17~75岁。以组织病理学检测结果将纳入研究的患者分为5组:慢性宫颈炎组19例、CINⅠ组24例、CINⅡ组14例、CINⅢ组44例及鳞状细胞癌(SCC)组40例,各组间年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经该院伦理委员会审查通通过,所提交的研究方案符合医学伦理原则和赫尔辛基宣言的各项要求。
1.2 方法
1.2.1 高危型HPV E6/E7 mRNA 检测 高危型HPV E6/E7 mRNA 检测试剂盒购自郑州科蒂亚生物技术有限公司,用于定性检测人宫颈上皮脱落细胞中16、18、31、33、35、39、45、51、52、56、58、59、66和68型HPV E6/E7致癌基因片段mRNA,操作步骤严格按试剂盒说明书执行,若S/CO 值≥1,则HPV E6/E7 mRNA 检测结果为阳性。
1.2.2 TP1免疫组织化学染色及结果判读 对5组患者的宫颈病理组织标本进行TP1免疫组织化学染色,相关试剂和一抗TP1购买于Santa Cruz公司,通用型二抗购自福州迈新生物科技有限公司,操作步骤严格按试剂说明书执行。结果判读标准如下,阳性染色细胞:TP1表达于染色质,呈棕色颗粒状;阴性:无阳性细胞;弱阳性(+):阳性染色细胞数≤25%;中阳性(++):阳性染色细胞数>25%且≤50%;强阳性(+++):阳性染色细胞数>50%。
1.3 统计学处理 采用SPSS22.0软件进行统计学分析。不符合正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskal-WallisH检验,两两比较采用Bonferroni校正P值;计数资料采用百分数表示,组间比较采用χ2检验,两两比较采用χ2检验;有序分类变量之间的相关性分析选择Kendall's tau-b等级相关系数进行分析。以P<0.05为差异有统计学意义。
2 结果
2.1 不同病变组间TP1阳性率比较 各组间TP1阳性率差异有统计学意义(χ2=28.432,P<0.001),见表1。两两比较显示,CINⅠ组、CINⅡ组、CINⅢ组及SCC组的TP1阳性率均高于慢性宫颈炎组,差异均有统计学意义(P<0.05);而CINⅠ组、CINⅡ组、CINⅢ组及SCC 组间TP1阳性率比较,差异无统计学意义(P>0.05)。
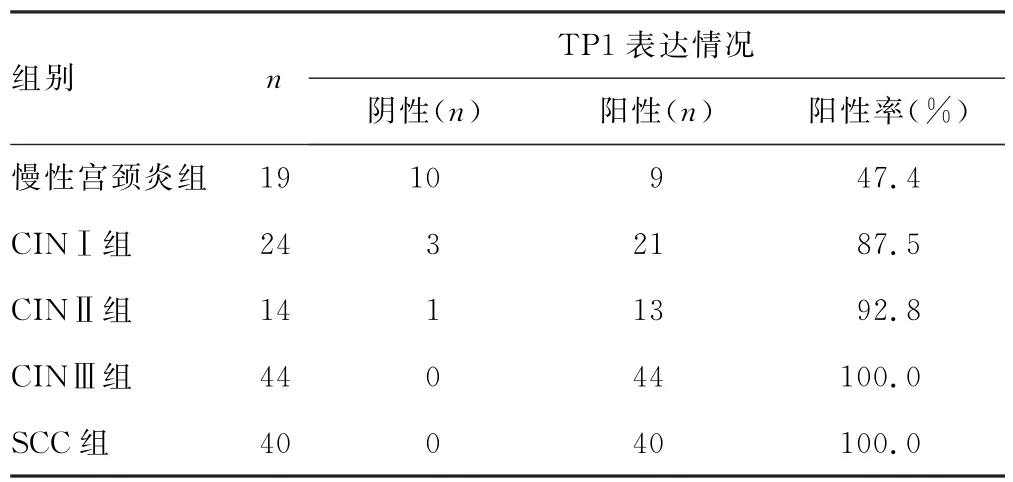
表1 不同病变组间TP1阳性率比较
2.2 TP1与宫颈鳞状上皮病变严重程度的相关性TP1的表达强度与宫颈鳞状上皮病变严重程度呈正相关(Kendall's tau-b=0.592,P<0.001)。各组病理组织TP1染色情况见图1。

图1 TP1在不同宫颈上皮病变中的免疫组化结果
2.3 各组间HPV E6/E7 mRNA 表达情况 各组间HPV E6/E7 mRNA S/CO 值比较差异有统计学意义(H=10.806,P<0.05),进一步两两比较显示,CINⅡ组的S/CO 值高于CINⅠ组,差异有统计学意义(H=29.842,P<0.05),见表2。

表2 HPV E6/E7 mRNA S/CO 值在5组间的比较[M(P25,P75)]
2.4 TP1的表达强度与HPV E6/E7 mRNA S/CO值的相关性分析 TP1表达强度与对应的HPV E6/E7 mRNA S/CO 值之间无相关性(H=1.783,P>0.05),见表3。
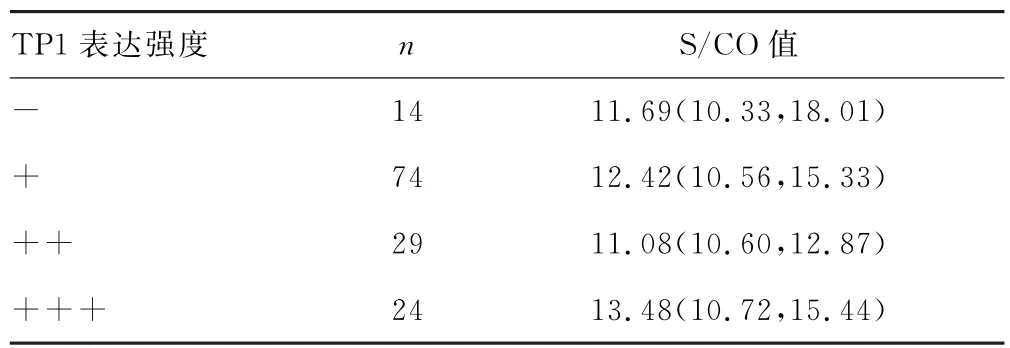
表3 不同TP1表达强度的HPV E6/E7 mRNA S/CO 值比较结果分析[M(P25,P75)]
3 讨论
高危型HPV的持续感染可导致宫颈鳞状上皮细胞内hTERC及hTERT 激活并参与调节酪氨酸蛋白酶信号传递,使端粒酶活性提高,促进HPV E6/E7的致癌作用,从而加快或加重CIN的发生、发展[8-10]。有文献报道,端粒酶活性的提高还可见于乳腺癌、尿路上皮癌、胃癌、卵巢癌组织[11-13]。
TP1作为组成端粒酶的亚基之一,在端粒酶的活化及肿瘤细胞形成过程中具有调节作用[14]。赵瑞皎等[15]在卵巢良性和恶性上皮性肿瘤中发现TP1的表达水平与端粒酶活性之间无明显相关性,但恶性上皮性肿瘤中TP1的表达强度高于卵巢良性上皮性肿瘤。宫颈鳞状上皮病变中TP1的表达情况目前鲜有报道。本研究表明,CINⅠ组、CINⅡ组、CINⅢ组及SCC 组TP1阳性率均高于慢性宫颈炎组,提示TP1 可能参与了宫颈鳞状上皮异型增生及癌变过程,且TP1的表达强度与宫颈鳞状上皮病变严重程度呈正相关。因此,笔者推测TP1在宫颈鳞状上皮瘤变过程中具有促肿瘤作用。
本研究还发现,CINⅡ组HPV E6/E7 mRNA S/CO 值高于CINⅠ组,而其余组间两两比较差异无统计学意义(P>0.05),提示CINⅠ组中的高危型HPV感染可能处于可逆阶段,此阶段由于人体的自身免疫作用能清除掉部分未被整合到宫颈上皮细胞内的HPV DNA;而CINⅡ组中的高危型HPV 感染可能已不可逆,人体自身清除病毒能力有限。而HPVDNA 复制增强,最终导致宫颈鳞状上皮高度异型增生乃至癌变[16]。故在CINⅠ阶段清除或阻止HPV DNA 与宫颈上皮细胞DNA 整合对抑制CIN 进一步发展至关重要。最新研究发现,当HPV DNA 与人体细胞DNA 发生整合以后,鳞状上皮癌变的风险明显增加,可表现出非HPV 依赖性的癌变过程,在这个过程中其他促癌途径发挥着比HPV E6/E7更为重要的作用,如端粒酶的活化[17]。
TP1的表达程度随着宫颈鳞状上皮病变严重程度的增加而增加,提示TP1在宫颈鳞状上皮瘤变过程中可能起着促肿瘤的作用,但TP1的表达与HPV E6/E7 mRNA S/CO 值无相关性,这提示TP1的促肿瘤机制可能与HPV E6/E7无关,笔者推测其促肿瘤机制可能与端粒酶活性增加有关,但需要进行更深入的研究。
