酶联免疫吸附法与同位素稀释液相色谱串联质谱法测定GA的一致性研究*
2022-03-29黄云川任用坤
黄云川 ,杨 琴 ,唐 敬 ,张 敏 ,任用坤△
四川省南充市中医医院:1.医技科;2.检验科,四川南充 637000
糖化清蛋白(GA)为清蛋白糖基化产物,是近年新发现的可用于确认糖尿病患者治疗中期效果的血糖监测指标。与传统指标糖化血红蛋白(HbA1c)比较,GA 反映的是患者近3周内血糖水平,且在血红蛋白异常情况下其结果不受影响[1]。血清GA 水平测定方法主要有免疫层析法、高效液相色谱法、酶法等,不同方法参考区间存在较大差异,目前国内外尚无公认的参考测量方法。近年来日本临床化学学会和日本糖尿病委员会指出,以JCCRM611作为GA 测量标准物,同位素稀释液相色谱串联质谱法(ID-LC/MS/MS)可作为GA的参考测量方法[2]。另外周慧娟等[3]对该方法进行了方法学评价得出,ID-LC/MS/MS测定血清GA 水平准确可靠。酶联免疫吸附试验(ELISA)是利用酶标记抗原或抗体,从而检测相应抗原或抗体水平的检测手段,相较于ID-LC/MS/MS,具有操作简便、价格低廉等特点,更利于临床大规模筛查[4]。鉴于此,本研究拟对ELISA 和ID-LC/MS/MS检测血清GA 水平性能进行比较,旨在为临床应用提供理论依据。
1 资料与方法
1.1 一般资料 收集2020年1-6月本院检验科保留的体检人群剩余血清300份作为研究标本,-80 ℃保存备用。纳入标准:(1)18 岁以上;(2)体检合格。排除标准:(1)妊娠或哺乳期女性;(2)溶血、乳糜、黄疸血清标本。本研究经医院伦理委员会批准。
1.2 仪器与试剂 人GA ELISA 试剂盒(英国Abbexa公司)。Ultra PFPP色谱柱(北京迈瑞达科技有限公司)。七氟丁酸、乙腈(日本TCI公司)。Multiskan FC 型酶标仪(美国赛默飞世尔公司)。TSQ VANTAGE型三重四极杆液相色谱质谱联用仪(美国赛默飞世尔公司)。
1.3 方法
1.3.1 ELISA 将抗体预包被至96孔板上,按照试剂盒说明书配置标准品、测试样品和生物素偶联试剂,加至孔中孵育;加入结合了辣根过氧化物酶(HRP)的试剂并孵育,磷酸盐缓冲液(PBS)冲洗;添加3,3',5,5'-四甲基联苯胺,观察到蓝色产物时,加入酸性终止液,Multiskan FC 型酶标仪测定波长450 nm 处吸光度(A)值,根据标准曲线计算GA 水平。
1.3.2 ID-LC/MS/MS (1)标准工作液及上机标准工作液制备:按比例将赖氨酸和同位素标记赖氨酸、糖化赖氨酸和同位素标记糖化赖氨酸混匀;不同摩尔比标准工作液与待测样品混匀,依次进行氢化还原反应、强酸高温水解反应。(2)液相色谱条件:色谱柱为Ultra PFPP(柱长2.1 mm,内径150 mm,粒径3 μm),乙腈(90∶10)为流动相A,水(含0.06%七氟丁酸)为流动相B,等度洗脱,流速250 μL/min,进样量1 μL。(3)质谱条件:TSQ VANTAGE型三重四极杆液相色谱质谱联用仪,电离气压3 998.65 V,离子源为电喷雾(ESI),喷雾气体为氮气,喷雾器压力30 PSI,气体流速10 L/min,离子源温度200.42 ℃,扫描类型MS2SRM,扫描范围300~2 000 M/Z。(4)标准曲线质谱采集:工作模式为选择反应检测扫描(SRM)模式,采集赖氨酸碎片离子峰84.2、67.1、56.2(147 M/Z),同位素标记赖氨酸碎片离子峰88.2、70.2、56.2(151 M/Z),选择两种物质在碎片离子峰56.2的峰面积比值作标准曲线,糖化赖氨酸碎片离子峰84.2、248.4、130.0(311 M/Z),同位素标记糖化赖氨酸碎片离子峰84.2、270.1、189.1(317 M/Z),选择两种物质在碎片离子峰84.2的峰面积比值作标准曲线;ID-LC/MS/MS法测定GA水平单位为mmol/mol,根据公式将其转化为酶法常用单位%,GA(%)=0.056 52×GA(mmol/mol)-0.042 17。
1.3.3 一致性评价 将两种方法检测结果分别按照各试剂提供的参考范围和本研究初步评估建立的参考范围上限为标准,高于标准为阳性,低于标准为阴性;采用Kappa一致性检验评价两种方法测定结果一致性,Kappa=(Po-Pe)/(1-Pe),Po为每一类正确分类的样本数量之和除以总样本数,即实际一致率,Pe为理论一致率。
1.3.4 精密度评价 根据ELISA 测定值得到GA低、中、高水平样本,将水平相近样本混合制备血清GA 候选标准品,连续测定5 d,每天测定4次;计算两个水平重复度和实验室内不精密度,分别用Sr和S1表示,确认其精密度范围是否与厂商标注精密度符合,以基于生物学变异的精密度质量规范(<2.6%)为质量目标[5],将测定的精密度与质量目标进行比较,以确保试验结果可接受的医学实用性。Sr=D 为测试总天数,n为每天重复次数,Xdi为第d天第i次测定结果。
1.3.5 正确度评价 ELISA 法测定3个水平GA 标准物(JCCRM611-1HH),由同位素稀释质谱法(ID/MS)赋值,认证值为31.1%;计算测定值与认定值的相对偏差,正确度(%)=(测定值-认证值)/认证值×100%,以小于1/2允许总误差(±5%)为判断标准[6],确保试验结果正确度。
1.3.6 质量控制 每个样本连续测定3次,且在同一批内完成测定,两种检测方法测定样本在30 d内完成。
1.4 统计学处理 采用Microsoft Excel2010软件对数据进行统计。非正态分布的计量资料用M(P25,P75)表示。Passing-Bablok回归计算两种方法斜率、截距的95%置信区间(95%CI),Bland-Altman图分析两种方法平均偏差,以Kappa值作为两种方法一致性评价结果,以Kappa值≥0.75表示两者一致性较好,0.40~0.75表示两者一致性一般,<0.40表示两者一致性较差。以P<0.05为差异有统计学意义。
2 结果
2.1 ID-LC/MS/MS测定血清GA 水平 血清GA水平检测结果为偏态分布,ID-LC/MS/MS检测血清GA 水平为18.73%(13.21%,22.48%)。
2.2 ELISA 测定血清GA 水平 检测结果为偏态分布,ELISA 检测血清GA 水平为15.36%(11.14%,18.78%)。
2.3 两种方法检测血清GA 水平的一致性评价Passing-Bablok回归分析结果显示,两种方法检测血清GA 水平的斜率和截距的95%CI分别为0.911~1.157,0.114~0.487,斜率的95%CI包含1,但截距的95%CI未包含0,见图1。Bland-Altman图显示,两种方法检测血清GA 水平的差值均数为3.78%,低于临床最低要求(4.5%),见图2。两种方法检测血清GA 水平的一致性较高(Kappa=0.814)。

图1 ID-LC/MS/MS和ELISA 测定血清GA 水平的Passing-Bablok回归图

图2 ID-LC/MS/MS和ELISA 测定血清GA 水平的Bland-Altman图
2.4 ELISA 方法学评价
2.4.1 精密度 ELISA 测定各样品血清GA 水平变异系数(CV)均低于厂家提供近似水平标准品CV。见表1。
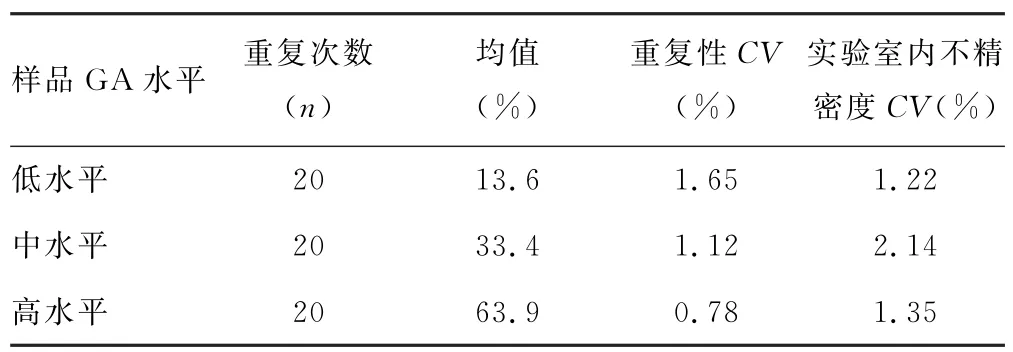
表1 精密度评价结果
2.4.2 正确度 ELISA 测定各样品血清GA 水平测定值与认定值的相对偏差均小于1/2允许总误差,在可接受范围。见表2。

表2 正确度评价结果
3 讨论
目前临床GA 检测方法尚无统一的参考标准,因此,无法避免因采用单位或溯源性不同导致的结果差异较大[7-8]。近年来随着液相色谱和质谱技术发展,LC/MS/MS 成为目前研究的热点。而探索与IDLC/MS/MS一致性较高,且具有简便、高效、经济的检测方法,对临床大规模应用具有重要意义[9]。ELISA 主要将蛋白、抗体或激素等直接或间接固定于固相载体,再加入一级检测抗体形成抗原抗体复合物,从而检测样本中抗原水平,具有操作简便、价格较低、灵敏度高等优点。有研究对比了LC/MS/MS和ELISA 性能发现,两者在检测血清25-羟基维生素D水平上一致性较好,且以LC/MS/MS为“金标准”作为参考,ELISA 诊断维生素D 缺乏的灵敏度和特异度较 高[10]。ID-LC/MS/MS 是 在LC/MS/MS 基 础上增加了同位素标记技术,具有更高的灵敏度和特异度[11]。任文华等[12]研究指出,ID-LC/MS/MS 测定血清GA 精密度高、正确性好,与常规酶法相关性较好,推荐作为我国测定GA的候选参考方法。但由于ID-LC/MS/MS对检测设备及样品质量要求较高,操作费时,费用较高,不利于基层医院推广和大规模筛查[13]。
本研究中,ELISA 采用的是英国Abbexa公司生产的GA 检测试剂盒,结果显示ELISA 检测血清GA水平为15.36%(11.14%,18.78%),在ID-LC/MS/MS测定血清GA 水平[18.73%(13.21%,22.48%)]范围内,提示ELISA 在血清GA 检测中具有一定应用价值;ELISA 检测血清GA 水平与以往报道的结果[14-15]存在差异,分析原因与检测系统、参考范围等有关。一致性评价中,Passing-Bablok回归分析显示两种方法检测血清GA 水平斜率的95%CI包含1,但截距的95%CI未包含0,提示两种方法间不存在系统和比例误差,Bland-Altman图显示两种方法检测血清GA水平的平均偏差低于临床最低要求(3.78%vs.4.5%),通过计算Kappa值发现,两种方法检测血清GA水平的一致性较高,提示ELISA 有可能成为IDLC/MS/MS的有效替代方法。进一步对ELISA 进行方法学评价发现,ELISA测定各样品血清GA 水平CV均低于厂家提供近似水平标准品CV,提示其符合基于生物学变异的精密度质量规范;ELISA 法测定各样品血清GA 水平测定值与认定值的相对偏差均小于1/2允许总误差,在可接受范围内,提示其准确度较高。
综上所述,ELISA 与ID-LC/MS/MS 测定血清GA 具有良好一致性,均能满足临床要求,以ID-LC/MS/MS为参考,ELISA 具有良好的正确度和精密度,且操作简单、费用相对较低,可用于临床大规模快速检测。
