香樟不同树龄和组织的端粒酶活性测定
2021-05-03刘立盘钟永达杨爱红陈彩慧余发新
刘立盘 钟永达 杨爱红 周 华 陈彩慧 胡 萍 余发新
(江西省科学院生物资源研究所,江西省观赏植物遗传改良重点实验室,江西 南昌 330096)
端粒位于真核细胞线性染色体末端,由DNA重复序列与蛋白质组成的特异复合体结构[1]。几乎所有高等植物的端粒都是由七核苷酸拟南芥端粒重复序列(TTTAGGG)n组成[2]。樟属牛樟(Cinnamomum kanehirae)基因组测序在染色体末端存在大量的“TTTAGGG”七聚体序列,拷贝数范围在320~2 547之间[3]。
端粒酶是能够延长端粒序列的一种特殊的反转录酶,其功能是以自身的RNA亚基作为模板,在染色体的末端添加端粒保守重复序列,维持染色体的稳定性[4]。端粒酶是一种位于线性染色体3"末端的核糖核蛋白(RNP),由端粒酶RNA(TER)和端粒酶逆转录酶(TERT)2个核心亚基组成[5]。TER是由1个单一的长链非编码RNA序列组成,TERT亚基包含N-末端域(TEN)、TR结合域(TRBD)、中心逆转录酶域(RT)和C-末端延长域(CTE)保守结构[6]。端粒酶在各个亚单位的协作下补偿端粒在染色体复制过程中所产生的持续性丢失序列,调控端粒的延长和缩短[7]。
在木本植物中,衰老是受多因素调控的生理生化动态变化的过程,树龄是机体衰老的直接反映,端粒酶活性与植物树龄的研究近年来有不少报道。银杏(Ginkgo biloba)叶片端粒酶活性随树龄的增加呈下降的趋势[8-9],但狐尾松(Pinus longaeva)根系端粒酶活性随着树龄的增加而升高[10]。说明端粒酶活性与树龄存在直接或者间接的关系,在调节树种寿命方面起着至关重要的作用。
植物不同组织的分化能力不一致导致端粒酶活性存在差异。银杏胚性愈伤组织、小孢子和叶片的端粒酶活性存在差异,其中胚性愈伤组织的端粒酶活性最高[9];拟南芥(Arabidopsis thaliana)和女娄菜(Melandrium album)萌发的幼苗和根尖的端粒酶活性最高,休眠的种子中没有活性[11];大麦(Hordeum vulgare)的胚、花药和心皮组织端粒酶活性较高,在胚胎发育过程中活性逐渐降低[12-13];另外在大豆(Glycine max)根尖、菜花(Brassica oleracea)分生组织和胡萝卜(Daucus carota)悬浮培养组织中端粒酶活性较高[14]。说明端粒酶活性与细胞和组织的分化能力有重要的关系。
多年生木本植物在生长过程中,不同组织部位的发育时间不一致,导致其生理年龄存在差异。叶片的生理年龄表征了植物生长的不同生理阶段,反映了植物组织的生长和分化能力[15]。油松(Pinus tabulaeformis)和银杏不同叶位的叶片端粒酶活性与叶位高度呈正相关关系,随着叶片高度的增加端粒酶活性升高[8]。油松新叶的端粒长度短于老叶,但端粒酶活性高于老叶[16];另外还发现银杏[9]、油松[16]及青梣(Fraxinus pennsylvanicavar.subintegerrima)和 旱 柳(Salix matsudana)[17]树种在全年发育周期中端粒酶活性具有季节性变化,与月平均温度呈现正或负相关性关系。因此端粒酶活性在不同树种、不同生长阶段和不同生理阶段均存在差异性。
本研究以7株不同树龄香樟(Cinnamomum camphora)为材料,测定不同树龄叶片、不同叶位高度叶片、新叶和老叶、以及8个不同组织的端粒酶活性,研究端粒酶活性与树龄、叶片生理年龄的相关性,以及香樟不同组织的端粒酶活性的差异,为香樟的端粒酶分子机理研究及古香樟种质资源的保存提供参考。
1 材料与方法
1.1 试验材料
从江西省乐安县“中国第一古樟林”古樟群落、安福县古樟群落和南昌黄马基地,根据古树树龄标识采集7个年龄段(5,100,210,460,700,900和1 200年)的香樟叶片(表1)。取样的方法:新叶和老叶取树干基部一级分支的小于1 a的当年生和大于1 a的往年生叶片,不同叶位高度的叶片取每棵树茎基部、茎1/3高度、茎2/3高度、茎顶端4个枝条顶梢叶片,不同组织取种皮、茎干树皮、枝条树皮、老叶、嫩叶、叶芽、花芽和花测定端粒酶活性,每个组织和部位取样3次作为生物学重复。
1.2 端粒酶蛋白的提取
对香樟叶片和不同组织提取端粒酶蛋白,端粒酶蛋白提取使用CHAPS裂解液:50 mmol/L Tris-HCl(pH7.5)、20.0 mmol/L EGTA、0.5%(质量体积分数)CHAPS、10%(质量体积分数)甘油、5.0 mmol/L MgCl2、0.1 mmol/L 苯 甲 脒、0.1 mmol/L PMSF、2.0 mmol/L 亚精胺、5.0 mmol/L DTT、1.5%(质量体积分数)PVP。
参照Kim等[18]和王瑾瑜等[19]提出的方法,称取约100 mg香樟组织和叶片,液氮研磨置于预冷的CHAPS裂解液700 μL(5 μL DTT和10 μL PMSF),充分混匀后,冰浴裂解30 min。取上清液置于新的离心管,加入PEG8000使其终浓度为10%,冰浴悬浮放置30 min,其间不断上下颠倒混匀。在4 ℃ 下16 000 g离心10 min,沉淀重置于CHAPS裂解液175 μL,充分混匀后,冰浴悬浮放置30 min。在4 ℃下16 000 r/min离心5 min,迅速取出上清,分装后于-80 ℃保存。
1.3 端粒酶扩增引物的筛选
根据木本等植物端粒酶活性测定不同引物的筛选研究[14,19],本研究选择6条先导引物(GG,GGG,TS21,PBR,47F和TS18)和1条反向引物RP对香樟叶片的端粒酶蛋白进行PCR扩展,筛选扩展条带最清晰的为最佳引物(表2)。
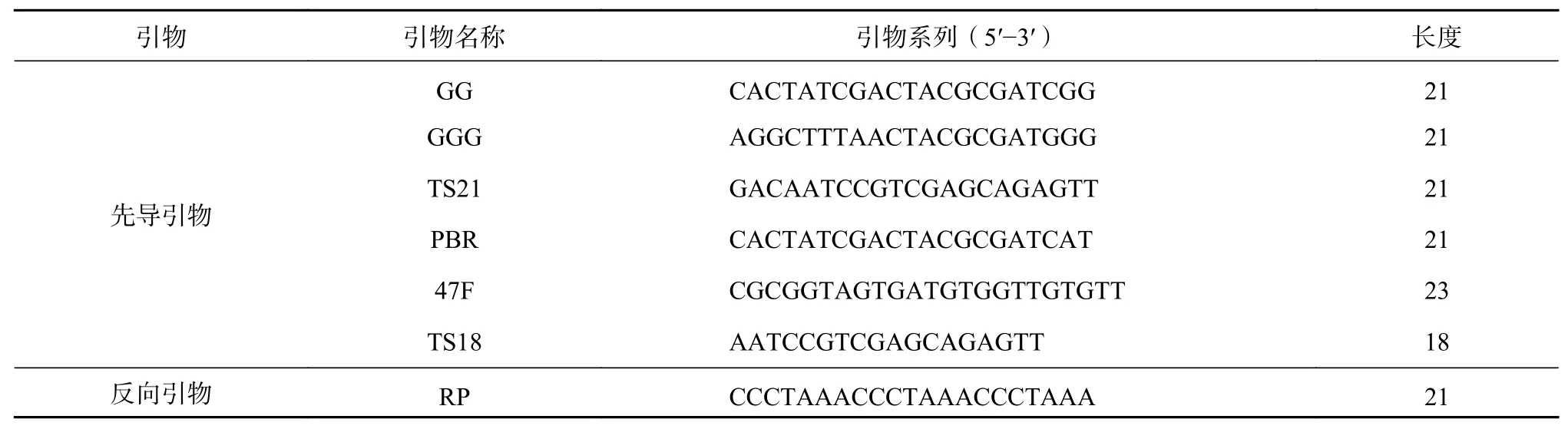
表 2 端粒酶活性PCR扩增引物Table 2 PCR amplification primer of telomerase activity
1.4 香樟端粒酶活性的测定
对不同树龄的香樟叶片,不同叶位高度和生理年龄的叶片,及不同组织按照TRAP方法,使用筛选的最佳引物进行PCR扩增测定端粒酶活性。
PCR反 应 体 系 为50 μL:10×TRAP buffer 5 μL,10 mmol/L dNTP mixture 1 μL,先导引物1 μL,反向引物RP 1 μL,Taq酶1 μL,端粒酶提取液2 μL,DEPC H2O 39 μL。
PCR扩 增 程 序:PCR仪 延 伸30 ℃ 30 min;预变性95 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃60 s,30个循环;72 ℃ 10 min,4 ℃保存。
对PCR扩增产物采用2%的琼脂糖凝胶电泳,凝胶中加入1×SYBR Green I(Solarbio)染色液,然后置于Gel Doc XR凝胶成像仪下观察拍照。
1.5 数据分析
用Quantity one软件对凝胶图片进行半定量分析,使用平均值±标准差表示。对数据结果采用IBM SPSS 19软件进行单因素方差分析,以LSD法评价显著性。根据得到的端粒酶活性值,用GraphPad Prism 5绘制柱形图。
2 结果与分析
2.1 香樟叶片端粒酶活性测定引物筛选
端粒酶测定引物筛选结果显示引物:TS21和RP扩展凝胶图能看到明显的6 bp递增的条带,其他引物凝胶图6 bp条带比较模糊,及检测不到6 bp的扩展条带。端粒酶提取液作为阴性对照,阴性对照只有1条内参条带(图1)。
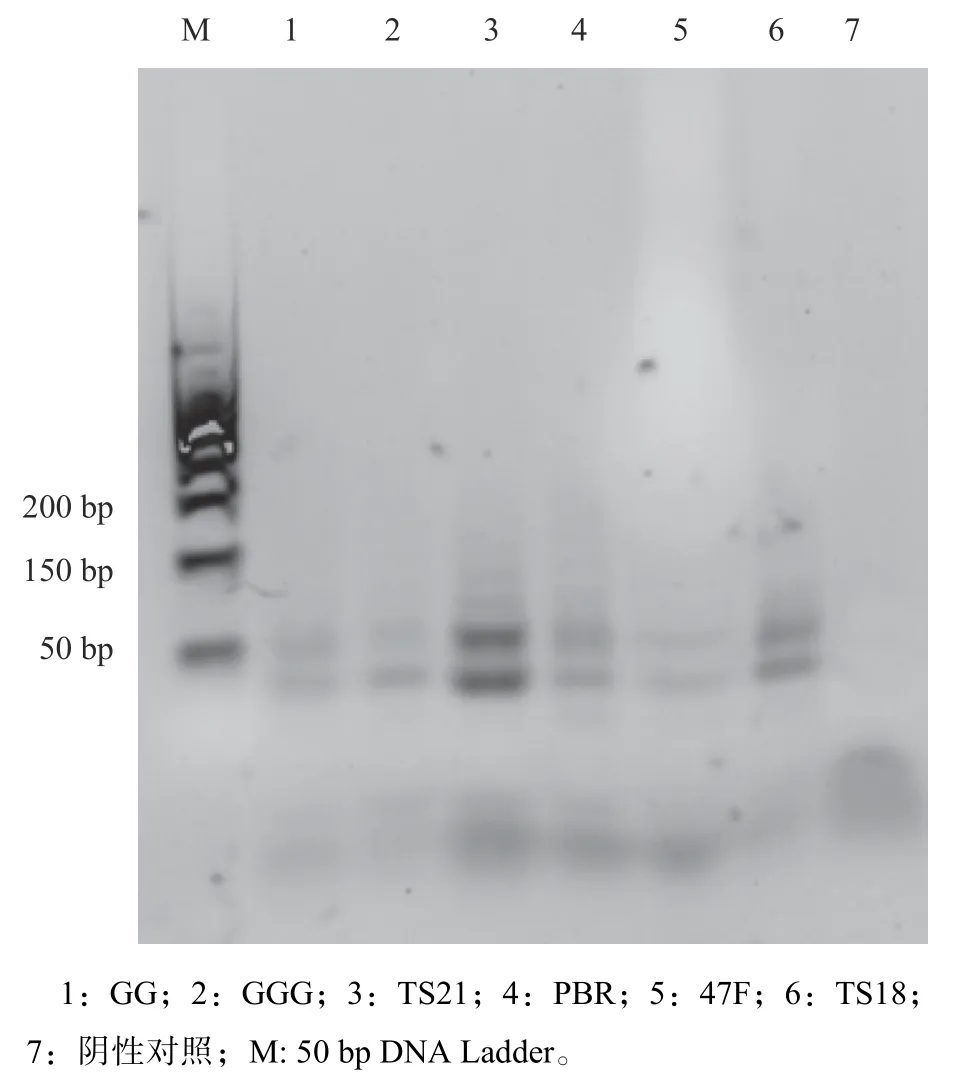
图 1 不同先导引物在香樟叶片端粒酶活性的PCR扩增效果Fig. 1 PCR amplification effects on leaf telomerase activity of different forward primers in C. camphora
2.2 不同树龄香樟叶片端粒酶检测
为了研究不同树龄香樟与端粒酶活性的关系,选取不同树龄香樟茎基部相同叶位高度的叶片,对其进行端粒酶电泳及活性测定,从图2可以看出,树龄5年的端粒酶活性为1.70,树龄1 200 a的端粒酶活性为0.80。可以看出端粒酶活性随着香 樟 树 龄(5,100,210,460,700,900 a和1 200 a)的增加呈现下降的趋势,说明在香樟5~1 200 a,端粒酶活性与树龄存在负相关关系。
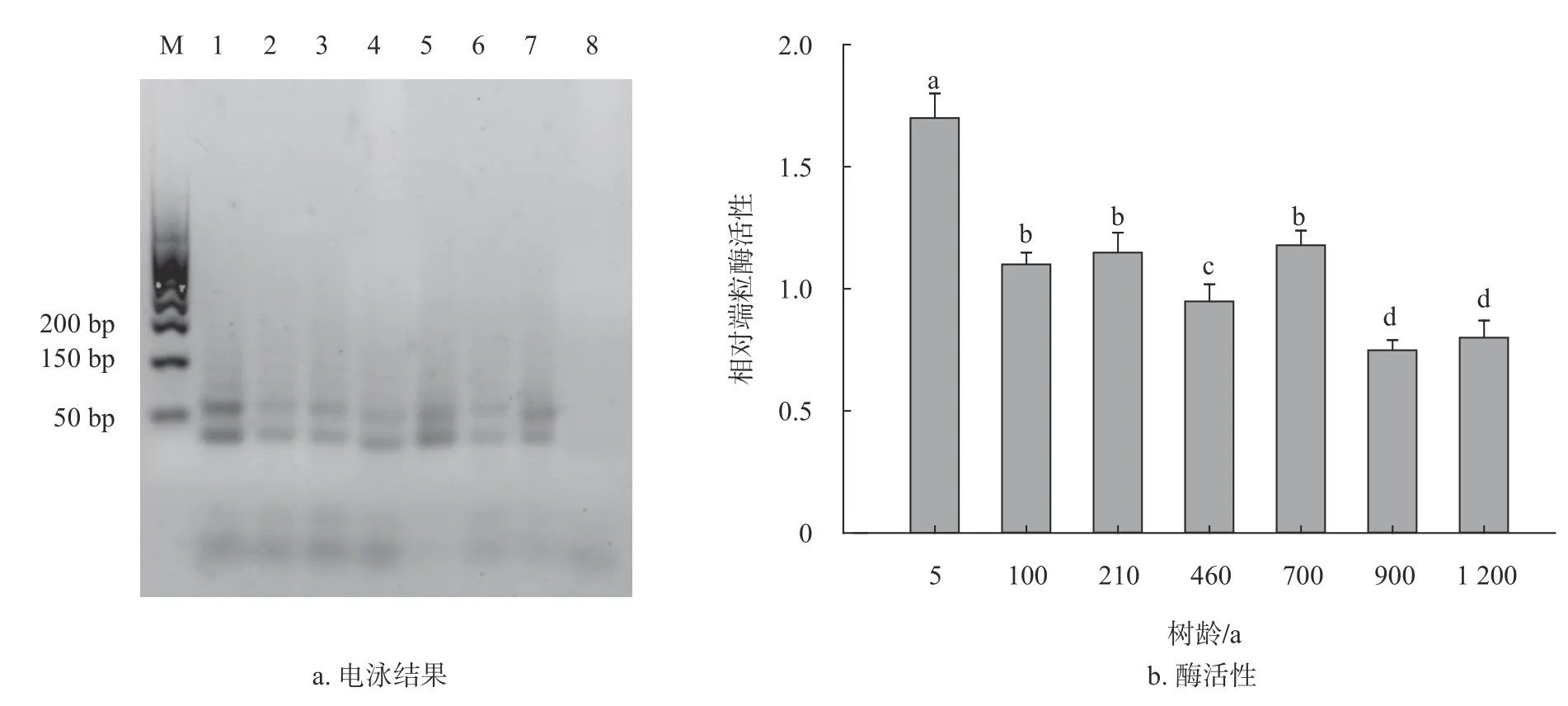
图 2 不同树龄香樟叶片的端粒酶电泳及活性检测Fig. 2 Leaf telomerase activity and electrophoresis of C. camphora at different ages
2.3 不同高度叶片端粒酶检测
香樟不同叶位高度的叶片采用的是新叶测定端粒酶活性,100 a香樟叶片从下到上的端粒酶活性分别为1.60,1.40,1.55和0.55(图3)。茎基部的叶片端粒酶活性最高,茎顶端的端粒酶活性最低,可以得出随着叶位高度的上升,端粒酶活性呈下降的趋势,可能是由于叶片的生理年龄衰老导致。

图 3 香樟不同叶位高度叶片的端粒酶电泳及活性检测Fig. 3 Leaf telomerase activity and electrophoresis of C. camphora in different height
2.4 香樟新叶和老叶端粒酶检测
香樟新叶和老叶在生理上分化时间不一致,导致其分化能力有差异。本研究对100 a香樟茎基部相同叶位高度的新叶和老叶进行端粒酶电泳及活性测定,而且是从同一根枝条萌发的叶片。新叶的端粒酶活性为1.70和1.85,老叶的端粒酶活性为0.65和0.95,表明新叶的端粒酶活性显著高于老叶(图4)。
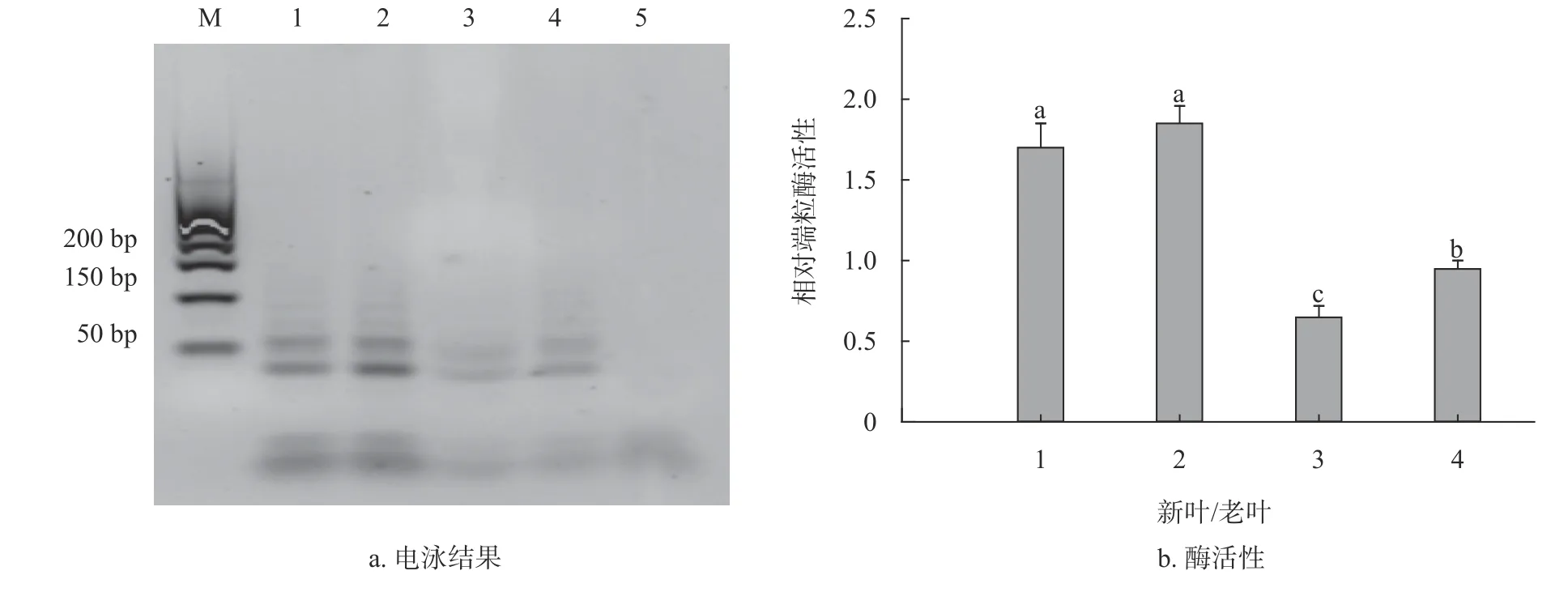
图 4 香樟新叶和老叶端粒酶电泳及活性检测Fig. 4 Leaf telomerase activities and electrophoresis in new and old leaves of C. camphora
2.5 香樟不同组织端粒酶检测
为了检测香樟不同组织的端粒酶活性差异,本试验选取了100 a香樟的种皮、茎干树皮、枝条树皮、老叶、嫩叶、叶芽、花芽和花8个不同组织测定端粒酶活性。端粒酶活性分别为1.25,1.15,1.30,0.65,1.56,1.85,1.95和1.10(图5)。从图中可以看出不同组织的端粒酶活性存在差异性,其中在叶芽和花芽组织中端粒酶活性较高,花芽的端粒酶活性在所有组织中最高,说明分化能力较强的幼嫩组织的端粒酶活性较高,而高度分化组织老叶的端粒酶活性最低。

图 5 香樟不同组织的端粒酶电泳及活性检测Fig. 5 Telomerase activity and electrophoresis in different tissues of C. camphora
3 结论与讨论
目前植物端粒酶活性的主要检测方法是基于聚合酶链反应(PCR)的端粒酶重复扩增法(TRAP)[18]。不同植物TRAP方法测定端粒酶活性,PCR扩增所使用的反向引物是RP,但先导引物不同。胡萝卜端粒酶活性测定发现TS、GG和GGG三种先导引物PCR扩增检测效果较好[14]。银杏端粒酶活性测定TS先导引物效果最好[9]。这种差异性可能与物种特异性有关。在本研究中,同一香樟叶片样品用先导引物TS21比TS18能扩增出更多的6 bp条带,说明21 bp的引物更适合端粒酶活性的测定。这与前人的研究结果一致,TS21引物扩增效果更好[14,19]。另外相对于其他引物,扩增引物TS21和RP条带最清晰,能明显的检测到6 bp的条带,因此TS21和RP引物是最适合香樟端粒酶活性的测定。
衰老存在于大多数多细胞生物中,常常伴随着端粒磨损,表观遗传改变,蛋白质稳态丧失和细胞功能退化[20]。衰老与植物的生长和分化有关,而衰老则是最后一个阶段,最终以死亡告终[21]。分生组织细胞具有无限复制的能力是树种长寿的重要因素。狐尾松针叶端粒酶活性随着树龄的增加显著降低[10],银杏叶片端粒酶活性随着树龄(10~700 a)的增加呈下降的趋势[8-9]。本研究的香樟叶片的端粒酶活性得到类似的结果,随树龄(5~1 200 a)的增呈下降的趋势。因此,端粒酶活性与林木植物的树龄可能存在比较直接的负调控关系,在延长树木寿命方面起着重要的作用。
不同植物、同一植物不同组织、同一植物不同分化程度的相同组织及不同环境条件下的相同部位端粒酶活性都可能存在差异[22]。端粒酶活性在农作物和林木中研究比较多。在幼嫩组织和分化能力较强的组织端粒酶活性较高,在银杏胚性愈伤组织[9];女娄菜幼苗和根尖[11];烟草(Nicotiana tabacum)愈伤组织[23];大麦胚、花药和心皮组织[12-13];及大豆、菜花和胡萝卜悬浮培养组织[14]中端粒酶活性都比较高。油松新叶的端粒酶活性都高于老叶[16]。因此端粒酶活性在生殖器官和愈伤组织细胞中较高,但在大多数营养器官中较低。在本研究中,香樟的8个不同组织的端粒酶活性分析得出叶芽和花芽端粒酶活性较高,其中花芽端粒酶活性最高,在老叶中活性最低。这与前人的研究结果相类似。这些结果表明,端粒酶活性对植物细胞的分化和增殖至关重要,分化能力较强的组织也具有较高水平的端粒酶活性,而高度分化的组织的端粒酶活性则较低。因此端粒酶活性可以作为衡量组织的分化增殖能力的指标。目前在林木中端粒长度和端粒酶活性与不同叶位高度的关系研究比较少。Aronen和Ryynänen[24]研究指出欧洲赤松(Pinus sylvestris )老树(50~200 a)从树干基部到顶端,茎形成层组织的端粒长度逐渐缩短,但端粒酶活性没有检测到变化。张徐俞等[8]指出油松和银杏随着叶位高度的上升,端粒酶活性逐渐增加。但在本研究中,香樟不同叶位高度从茎基部到顶端,叶片端粒酶活性呈下降的趋势。树木的这种端粒酶活性的差异性,可能是由于不同高度叶片的生理年龄不一样导致的。总之,端粒酶活性在植物体的各个组织都存在,不同生理年龄和分化能力组织的端粒酶活性都可能存在差异。
