PLAC8在子宫内膜癌中的表达及其调控癌细胞增殖和凋亡的机制*
2022-03-29代永娟
代永娟,高 燕,杨 建
成都医学院第三附属医院/成都市郫都区人民医院肿瘤血液科,四川成都 611730
胎盘特异性蛋白8(PLAC8)也称为onzin,在骨髓细胞、淋巴细胞和肺、肠的上皮细胞等各种类型细胞中表达[1]。PLAC8 在正常组织稳态中发挥重要作用,研究显示其表达异常导致多种疾病和人类肿瘤的发生、发展,PLAC8在肺癌、乳腺癌和结直肠癌等常见恶性肿瘤中均发挥促癌作用,促进肿瘤细胞生长、侵袭和转移,抑制肿瘤细胞凋亡[2-4]。然而,PLAC8在子宫内膜癌进展中的确切功能和潜在机制仍不清楚。HUANG 等[5]报道PLAC8 与蛋白 激酶B(AKT)相互作用,激活AKT/mTOR 信号通路促进鼻咽癌恶性进展。AKT/mTOR 信号通路在细胞生长、凋亡以及化疗耐药等生物过程中均具有重要作用,可作为药物干预的靶点[6]。且AKT/mTOR 信号通路在子宫内膜癌中也处于激活状态[7],而PLAC8是否可以调控AKT/mTOR 信号通路促进子宫内膜癌细胞增殖,抑制细胞凋亡尚不清楚。本研究旨在探讨PLAC8在子宫内膜癌恶性进展中发挥的重要作用,探讨PLAC8是否可以作为子宫内膜癌预后判断的生物标志物和治疗的潜在新分子靶点,现报道如下。
1 资料与方法
1.1 一般资料 收集2015年3月至2016年9月保存于本院病理科的子宫内膜癌石蜡包埋组织块80例,正常子宫内膜石蜡包埋组织块36例。患者均没有放疗或化疗史;组织标本的病理诊断由两名专门病理医师确认;临床病理、随访预后资料完整(患者术后3个月随访一次,随访60个月或者患者死亡时终止)。80例子宫内膜癌患者中死亡52例,存活28例。所有研究对象均签订知情同意书。标本的使用得到了本院伦理委员会的批准。
1.2 试剂来源 细胞培养瓶及培养板购于美国Corning公司;子宫内膜癌细胞株Ishikawa购于中科院上海细胞库;胎牛血清、DMEM-F12培养基购于美国Gibco公司;NC 短发夹RNA(shRNA)或PLAC8 shRNA 购于上海吉玛基因技术有限公司;兔源PLAC8一抗、兔源Ki67一抗、兔源AKT 一抗、鼠源pAKT 一 抗、兔源mTOR 一抗、兔 源pmTOR 一 抗、HRP偶联的羊抗兔二抗、羊抗鼠二抗购于英国Abcam 公司;MTS试剂购于上海同仁化学技术有限公司;细胞凋亡检测试剂盒购于上海碧云天生物技术有限公司。
1.3 方法
1.3.1 免疫组织化学法(IHC) 4 μm 石蜡切片经脱蜡和水化后,在抗原修复液中微波1 min,浸入3%过氧化氢中10 min,阻断内源性过氧化物酶活性。磷酸盐缓冲液(PBS)洗3次后,用3%牛血清蛋白封闭15 min。将切片与抗兔PLAC8抗体在4 ℃下孵育过夜、二抗室温孵育1 h。PBS洗3次后,加入显色液。苏木精复染后,分级乙醇中脱水,封片。染色测定结果由两名病理学专家独立评估和评分。PLAC8染色强度评分标准如下:强,3分;中等,2分;弱,1分;阴性,0分。PLAC8染色面积评分标准如下:>75%,4分;>50%~75%,3 分;>25%~50%,2 分;>10%~25%,1分;≤10%,0分。最终染色分数:染色强度分数×染色面积分数。最终染色分数≥2 分定义为PLAC8高表达,<2分定义为PLAC8低表达。Ki67增殖指数按热点区域进行评价,即阳性肿瘤细胞数/总的肿瘤细胞数×100%。
1.3.2 细胞培养、转染和分组 子宫内膜癌细胞株Ishikawa采用含有10%胎牛血清的DMEM-F12 培养基培养,放置在37 ℃、5% CO2、饱和湿度的培养箱内培养。Ishikawa细胞呈对数生长期时,胰酶消化收集细胞,将细胞按2×105个/孔接种于6孔板内,分为sh-NC组、sh-PLAC8-1组、sh-PLAC8-2组。按照Lip 2000转染试剂说明书进行转染,取5 μg NC shRNA或PLAC8 shRNA-1、PLAC8 shRNA-2分别与1 mL无血清DMEM-F12培养基混匀后室温孵育5 min,5 μL Lip 2000与1 mL无血清DMEM-F12培养基混匀后室温孵育5 min。NC shRNA 或 PLAC8 shRNA-1、PLAC8 shRNA-2分别加入各组Ishikawa细胞中。转染48 h后,通过Western-blot检测沉默效率。
1.3.3 MTT 试验检测细胞增殖能力 细胞转染48 h后收集sh-NC 组和sh-PLAC8-1组、sh-PLAC8-2组细胞,将细胞调整至浓度为1×104个/毫升的单细胞悬液。向96孔板中加入100 μL 细胞悬液,每组设置1、2、3、4及5 d检测时间点,每个时间点设置6个复孔,放置在37 ℃、5% CO2、饱和湿度的培养箱内培养。于对应的检测点每孔加入20 μL MTS试剂,继续孵育2 h后采用全波长扫描仪检测各样品在490 nm 波长处的吸光度值(A 值)。
1.3.4 细胞凋亡检测 取处于对数生长期的细胞采用无EDTA的胰酶消化收集sh-NC 组和sh-PLAC8-1组、sh-PLAC8-2组细胞,PBS洗3洗后,细胞沉淀采用250 μL 缓冲液重悬,并用尼龙网过滤。并加入5 μL FITC和10 μL PI染色液混匀后,于常温下避光孵育10 min。通过流式细胞术检测各组细胞凋亡情况。
1.3.5 Western-blot 胰酶消化sh-NC 组和sh-PLAC8-1组、sh-PLAC8-2组细胞,加入RIPA 裂解缓冲液和蛋白酶抑制剂混合物混匀,冰上裂解30 min,裂解液在4 ℃以12 000×g离心15 min,获得蛋白裂解液。根据说明书,使用BCA 蛋白质检测试剂盒测定蛋白质浓度,蛋白煮沸变性。等质量的蛋白质样品通过10%聚丙烯酰胺凝胶电泳-SDS(PAGE-SDS)分离,并湿转将蛋白转移到硝酸纤维素滤膜(PVDF膜)上。PVDF膜在室温下与5%脱脂奶粉孵育封闭1 h。TBST 洗3 次后,膜与AKT、pAKT、mTOR 和pm-TOR 和GAPDH 一抗稀释液4 ℃孵育过夜。TBST洗3次后,PVDF膜与HRP偶联的羊抗兔、羊抗鼠二抗室温孵育2 h。使用 ChemiDocTMMP 成像系统可视化蛋白条带成像。
1.4 统计学处理 采用SPSS20.0统计软件进行分析。所有试验重复3次。使用Graph Pad Prism 软件作图展示。计数资料采用百分数表示,组间比较采用χ2检验。计量资料采用表示,两组间比较采用t检验,多组间比较采用单因素方差分析,进一步组间两两比较采用LSD-t检验。通过Kaplan Meier法绘制患者生存曲线,采用Log-Rank 法进行检验。以P<0.05为差异有统计学意义。
2 结果
2.1 PLAC8在子宫内膜癌组织中高表达 IHC 结果显示,80例子宫内膜癌和36例正常子宫内膜中的PLAC8阳性表达率分别为58.75%和41.25%,差异有统计学意义(P<0.05),见图1。
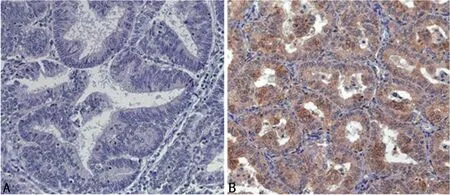
图1 PLAC8在子宫内膜癌组织和正常子宫内膜组织中的表达(×100)
2.2 PLAC8表达与子宫内膜癌患者病理参数的关系 肿瘤级别高、国际妇产科协会(FIGO)分期为Ⅲ~Ⅳ期、Ki67 增殖指数>50的子宫内膜癌中PLAC8阳性表达率明显增高(P<0.05)。发病年龄、是否绝经、肿瘤组织类型、肌层浸润深度和淋巴结是否转移等因素与PLAC8表达无关(P>0.05),见表1。

表1 子宫内膜癌患者组织中PLAC8表达情况与临床病理参数的关系[n(%)]

续表1 子宫内膜癌患者组织中PLAC8表达情况与临床病理参数的关系[n(%)]
2.3 PLAC8表达与子宫内膜癌患者生存时间的关系 PLAC8高表达患者中死亡34例,5年生存率为27.66%;PLAC8低表达患者中死亡18例,5年生存率为45.45%。绘制患者生存曲线,经分析,高表达PLAC8的子宫内膜癌患者其生存时间短于低表达PLAC8者(χ2=5.082,P=0.024)。
2.4 PLAC8 shRNA 转染子宫内膜癌细胞的结果在sh-NC 组和sh-PLAC8-1 组、sh-PLAC8-2 组子宫内膜癌细胞中PLAC8蛋白表达水平分别为1.13±0.14和0.30±0.07、0.39±0.04。sh-PLAC8-1组和sh-PLAC8-2组中的PLAC8蛋白表达水平明显低于sh-NC组(P<0.001),见图2。

图2 PLAC8 shRNA 转染成功的Ishikawa子宫内膜癌细胞
2.5 细胞增殖能力检测 第5天时,sh-PLAC8-1和sh-PLAC8-2组中的细胞增殖数量明显低于sh-NC组中的细胞增殖数量,差异有统计学意义(P<0.05),见图3。

图3 PLAC8 shRNA 转染Ishikawa子宫内膜癌细胞的生长曲线
2.6 细胞凋亡情况 sh-NC 组和sh-PLAC8-1、sh-PLAC8-2组子宫内膜癌细胞凋亡率分别为4.65%±1.62%和21.93%±5.98%、19.48%±3.57%。与sh-NC组相比,sh-PLAC8-1和sh-PLAC8-2组子宫内膜癌细胞凋亡率显著增加(F=15.558,P=0.004),见图4。

图4 流式细胞术分析PLAC8 shRNA 转染子宫内膜癌细胞的细胞凋亡情况(×100)
2.7 AKT/mTOR 信号通路检测 sh-NC 组、sh-PLAC8-1和sh-PLAC8-2 组细胞中AKT 和mTOR蛋白表达无明显变化。与sh-NC 组比较,sh-PLAC8-1和sh-PLAC8-2组细胞中pAKT 和pmTOR 蛋白表达明显降低(P<0.05),见图5。
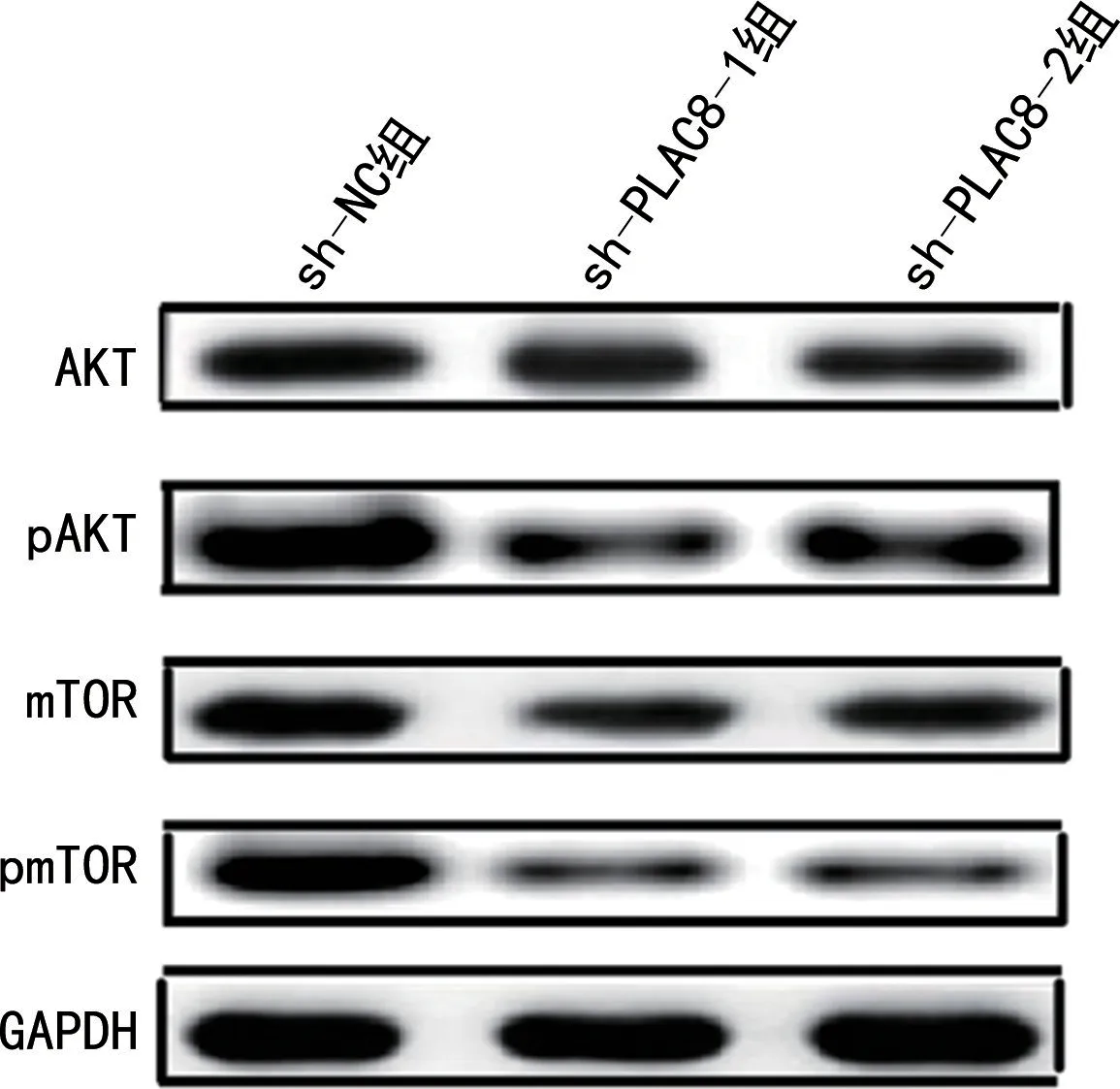
图5 PLAC8 shRNA 转染癌细胞中AKT、pAKT、mTOR 和pmTOR的表达水 平
3 讨论
PLAC8是一种相对分子质量为12.5×103的蛋白质,其分子结构从两栖动物到人类都高度保守,PLAC8被证明参与调节代谢和免疫等各种细胞生理过程,以及细胞增殖、分化、凋亡、侵袭、转移、耐药性生成等肿瘤病理过程,其作用机制可能是通过调控PI3k/AKT/NF-κB、PI3K/AKT/GSK3β、TGF-β/SMAD等信号途径发挥作用[8-10]。子宫内膜癌的发病率和病死率逐年增加,严重威胁女性患者生命健康[11]。大多数子宫内膜癌患者可选择的治疗手段疗效有限,预后较差[12]。研究显示,任何组织学的ⅢB期或ⅢC 期疾病以及ⅠA 期(伴有肌层浸润)、ⅠB、Ⅱ或ⅢA 期浆液性或透明细胞癌是子宫内膜癌患者预后不良的因素[13],但是子宫内膜癌的发病机制尚未完全阐明,因此,了解子宫内膜癌的发病机制对于探索子宫内膜癌的预防和治疗策略至关重要。PLAC8在子宫内膜癌中发挥的作用未知,研究PLAC8在子宫内膜癌中发挥的作用及作用机制,对于探索子宫内膜癌治疗的分子靶点具有重要意义。
本研究采用IHC 检测发现PLAC8 蛋白在子宫内膜癌组织中表达上调,说明PLAC8在子宫内膜癌中的表达异常,提示PLAC8在子宫内膜癌的发病过程中可能发挥重要作用,考虑为候选癌基因。同时本研究发现,PLAC8 高表达与患者肿瘤级别高、FIGO分期Ⅲ~Ⅳ期和Ki67增殖指数>50相关,且PLAC8高表达的子宫内膜癌患者预后较差,说明PLAC8与子宫内膜癌恶性进展密切相关,是子宫内膜癌预后不良的分子标志物,提示PLAC8在子宫内膜癌中发挥重要的生物学功能,相关研究也显示,肺癌和乳腺癌组织中PLAC8表达升高,并且PLAC8高表达与肺癌患者肿瘤大小、组织学分级和淋巴结转移及TNM 分期呈正相关,高表达PLAC8的肺癌患者预后较差[2-3]。研究显示,PLAC8过表达在体外和体内促进乳腺癌细胞增殖和迁移并抑制细胞凋亡[3],敲低PLAC8的表达导致胰腺神经内分泌肿瘤细胞的增殖和活力降低[14]。本研究采用shRNA 干扰PLAC8的表达,采用MTS和细胞凋亡试验检测PLAC8是否在细胞水平影响子宫内膜癌的增殖和凋亡能力,结果显示敲低PLAC8的表达在体外显著抑制子宫内膜癌细胞的增殖,促进肿瘤细胞凋亡的发生,表明PLAC8在子宫内膜癌中发挥促癌基因作用,提示PLAC8是子宫内膜癌进展中的重要分子。
PLAC8在子宫内膜癌中的作用机制仍需进一步探讨,细胞凋亡是程序性细胞死亡的主要机制,机体通过不同的机制维持正常生理和细胞稳态。在肿瘤细胞中,细胞凋亡受到抑制,细胞恶性增殖失控,从而导致肿瘤的恶性进展[15]。PLAC8可通过调控不同的信号通路促进不同的肿瘤恶性表型,既往研究显示,PLAC8通过调控PI3k/AKT/NF-κB信号通路抑制乳腺癌细胞凋亡[3]。PLAC8通过抑制 PI3K/AKT/GSK3β信号通路促进鼻咽癌的放射抗性[9]。HUANG 等[10]报道,敲低PLAC8的表达后,TGF-β/SMAD 信号通路失活并抑制鼻咽癌细胞增殖、伤口愈合、迁移、侵袭及异种移植物的生长。研究显示,在鼻咽癌细胞中PLAC8 与AKT 共定位,两者可以相互作用,干扰PLAC8的表达,其可通过抑制AKT/mTOR 信号通路抑制细胞增殖,并促进鼻咽癌细胞的凋亡[5]。AKT/mTOR 信号通路在肿瘤的发生发展中发挥重要作用[6],提示PLAC8在子宫内膜癌中发挥作用可能是通过调控AKT/mTOR 信号通路实现的,本研究Western-blot检测结果显示干扰PLAC8显著抑制子宫内膜癌细胞中pAKT 和pmTOR 蛋白的表达。表明干扰PLAC8的表达显著抑制子宫内膜癌细胞AKT/mTOR 信号通路,提示PLAC8可能通过激活AKT/mTOR 信号通路在子宫内膜癌中发挥作用,但PLAC8是否通过直接与AKT 相互作用激活AKT/mTOR 信号通路进而促进子宫内膜癌的恶性进展本文未进行深入研究,这也是本课题组后续的研究方向。
综上所述,子宫内膜癌中PLAC8呈高表达,敲低PLAC8表达能促进癌细胞的凋亡,其机制可能是通过调控AKT/mTOR 信号通路起作用。
