有机氯农药的微生物降解
2022-03-26商文贤徐宏英王俊伟
商文贤,徐宏英,王俊伟,张 婵
(太原科技大学环境科学与工程学院,山西 太原 030024)
有机氯农药(organochlorine pesticides,OCPs)是我国上世纪广泛使用的杀虫剂,主要以苯和环戊二烯为原料合成。我国使用最多和最广的杀虫剂为滴滴涕、六六六、氯丹、七氯和百菌清等。有机氯农药在土壤中的残留时间长,且降解困难,累积在动植物体内,最终通过食物链进入人体,危害人类健康。我国虽然在1983年禁止生产滴滴涕和六六六等有机氯农药,但因其在环境中的稳定性、持久性及其使用的广泛性,大量的有机氯农药仍残留在环境中,对生态环境和人类健康造成较大的威胁。生物修复技术操作简单、成本低、无二次污染,是一种高效经济、绿色环保的技术,有机氯农药降解微生物的筛选技术和相关降解理论的研究已相对成熟。作者介绍了近年来我国有机氯农药的污染现状,重点总结了国内外5种主要有机氯农药的微生物降解方面的研究进展及其降解酶和降解基因,为生物修复有机氯农药污染环境提供借鉴。
1 我国有机氯农药的污染现状
研究人员对国内有机氯农药的污染现状进行了大量研究。李子成等[1]对丹江口水库迁建区土壤进行有机氯农药检测,结果表明,总有机氯农药含量为ND~249.37 ng·g-1,平均值为24.82 ng·g-1;其中,滴滴涕与六六六的含量较高,分别为ND~104.53 ng·g-1和ND~69.68 ng·g-1。张家泉等[2]研究发现,闽江干流沿岸土壤中总有机氯农药含量为4.31~877.80 ng·g-1,平均值为74.13 ng·g-1;且闽江干流沿岸土壤及河口沉积物中滴滴涕含量高于六六六的,滴滴涕含量为1.67~876.49 ng·g-1,平均值为66.64 ng·g-1,六六六含量为1.32~24.01 ng·g-1,平均值为7.50 ng·g-1。受传统农业用地及农药化工企业分布的影响,闽江干流下游土壤中有机氯农药含量分布呈非均一性,沉积物样品中滴滴涕和六六六的含量分别为1.12~31.04 ng·g-1、0.34~11.72 ng·g-1,分析发现该地区近年来滴滴涕仍有输入,这可能与滴滴涕的替代品——三氯杀螨醇的使用有关。史双昕等[3]对北京地区土壤中持久性有机污染物(POPs)进行了检测,发现六氯苯、滴滴涕的检出率很高,狄氏剂、异狄氏剂、七氯和灭蚁灵均未检出,总有机氯农药类POPs含量平均值为77.7 ng·g-1;其中,滴滴涕占比高达98.9%,是北京地区土壤中有机氯农药类POPs的主要成分,其中城市公园和园林土壤是其主要污染源;六氯苯是北京地区土壤中普遍存在的另一类POPs,但其残留量很低,同样氯丹的检出率也很低,两者没有对土壤造成危害。蘧丹等[4]以重庆某废弃有机氯农药场地及其周边为研究区域,分析土壤中滴滴涕、六六六及其降解产物的含量水平,结果表明,场地土壤中滴滴涕含量为22.74~11 186.10 ng·g-1,六六六含量为3.89~13 385.78 ng·g-1,低于国内已报道的其它污染场地。Wang等[5]对北京10所高校校园的土壤样品进行了分析,确定了15种有机氯农药;滴滴涕是主要污染物,占总有机氯农药含量的93.70%,其次是六氯己烷(2.25%)和六氯苯(1.82%),氯丹、七氯和硫丹分别占15种有机氯农药含量的0.51%、1.05%和0.79%。张静静[6]研究发现,长春市城郊菜地土壤中,滴滴涕和六六六是最主要的有机氯农药残留,两者共占有机氯农药残留总量的88.29%,各种有机氯农药残留量由多到少的顺序依次为滴滴涕>六六六>氯丹>狄氏剂>艾氏剂。
2 微生物对有机氯农药的降解
2.1 滴滴涕的微生物降解
Chandrappa等[7]采用富集方法从未受滴滴涕污染的热带土壤中筛选得到数株分属于Bacillus、Staphylococcus及Stenotrophomonas的菌株,其能以滴滴涕为唯一碳源,且其31 d对滴滴涕的降解率为28.48%~58.08%。高晶晶[8]从巢湖周边受滴滴涕污染严重的土壤中筛选得到1株滴滴涕降解菌Alcaligenessp.DX8,其3 d对滴滴涕的降解率可达到54.83%。茅燕勇等[9]对洪泽湖湿地淤泥进行研究,从中筛选获得1株高效滴滴涕降解菌Bacilluscereus2D-1,在最适条件(33 ℃、pH值6.5)下培养8 d后,其对滴滴涕的降解率达到95.64%。Zhao等[10]研究发现,白腐菌漆酶能有效降解滴滴涕,对滴滴涕的降解符合准一级动力学;不同漆酶用量土壤中滴滴涕的残留量在培养5 d、10 d、15 d和25 d后分别下降了21%~32%、29%~45%、35%~51%和36%~51%。李红权等[11]从滴滴涕污染的土壤中筛选得到1株寡养单胞菌属(Stenotrophomonassp.)菌株,在培养温度为30 ℃、底物质量浓度为40 mg·L-1、pH值为7.0、摇床转速为200 r·min-1的条件下,其10 d对滴滴涕的降解率为69.0%。申艳萍等[12]研究发现,血红密孔菌对有机氯农药的降解具有明显的促进作用,在未接种菌剂情况下,高温堆肥对滴滴涕的降解率为43.6%;接种1%菌剂时,滴滴涕的降解率较未接种堆肥的提高34.6%;接种3%菌剂时,滴滴涕的降解率较未接种堆肥的提高34.6%。Qu等[13]从有机氯农药污染的土壤中分离得到1株能降解多种有机氯农药并将其作为唯一碳源和能源生长的金杆菌属(Chryseobacteriumsp.)PYR2菌株,其在30 d内对滴滴涕异构体(50 mg·L-1)的降解率为80%~98%;对高有机氯农药污染土壤进行了中试规模的PYR2强化的迁地生物修复研究,在45 d的试验期内,施用PYR2(35.37 mg·kg-1)的土壤中滴滴涕浓度降低了80.3%,而对照土壤仅降低了57.6%。
2.2 六六六的微生物降解
赵煜坤等[14]用六六六降解菌BHC-A处理盆钵土壤,10 d后土壤中六六六降解率达到89.07%,20 d后六六六降解率达到98.93%。李名星[15]研究发现,菌株BHC-C在12 h内对α-六六六的降解率为60.1%,对β-六六六的降解率为30.2%,对γ-六六六的降解率为100%,对δ-六六六的降解率为38.6%。张明星等[16]将降解菌 BHC-A添加到土壤中,7 d后六六六的降解率为86.16%,残留量为0.31 mg·kg-1;15 d后六六六降解率达到90.18%,残留量降至0.22 mg·kg-1,其含量符合农业生产的生态环境标准。Johri等[17]研究发现,少动鞘胺醇单胞菌3 d就能完全降解5 mg·L-1的α-六六六,在12 d内对β-六六六、γ-六六六的降解率均达到98%,对δ-六六六的降解最慢。Singh等[18]研究发现,白腐菌在 28 d对 78 mg·L-1的六六六的降解率高达100%。de Paolis等[19]研究发现,Arthrobactersp.72 h后对α-六六六的降解率为88%,对β-六六六的降解率为60%,对γ-六六六的降解率为56%。肖鹏飞等[20]研究发现,表面活性剂Tween80 浓度为1.0 g·L-1时,白腐真菌对六六六的降解率达到最高,为86.38%。申艳萍等[12]研究发现,在未接种菌剂情况下,高温堆肥对六六六的降解率为51.1%;接种1%菌剂时,六六六的降解率较未接种堆肥的提高16.2%;接种3%菌剂时,六六六的降解率较未接种堆肥的提高41.1%。
2.3 氯丹的微生物降解
杨东璇等[21]研究发现,白腐真菌能有效降解土壤中的氯丹,其最适温度为25~35 ℃、最适pH值为4~6;在合适的温度和pH 值下,白腐真菌对100 mg·L-1氯丹的30 d平均降解速率最高为1.71 mg·kg-1·d-1。Hirano等[22]利用河底淤泥中的微生物,在已充满氮气的厌氧条件下降解浓度均为0.025 mg·L-1的顺式氯丹和反式氯丹的混合物,140 d后发现,顺式氯丹降解率为12%,反式氯丹降解率为33%。Petruska等[23]采用好氧堆肥的方法进行氯丹的降解实验,21 d后氯丹降解率达到49.6%。党立晨[24]用Enterobactersp.LY402对氯丹进行降解,发现在30 ℃经过4 d的好氧降解,总降解率接近95%;其中,顺式氯丹和反式氯丹的生物降解率没有明显差别。
2.4 七氯的微生物降解
肖鹏飞等[25]研究了1株木材腐朽菌及其粗酶液对七氯的降解,发现该菌株对初始浓度为50 μg·L-1的七氯具有0.303 1 μmol·L-1·h-1的最大降解速率;当接种15%菌剂时,降解速率达到最高,为0.204 5 μmol·L-1·h-1;其降解产物主要为1-羟基-2,3-环氧六氯、1-羟基六氯和环氧七氯。Purnomo等[26]研究了白腐真菌降解污染土壤中的七氯和环氧七氯,结果发现, 28 d后七氯的降解率达到了89%。Purnomo等[27]研究发现,平纹假单胞菌在14 d内完全消除了PDB培养基和HN培养基中的七氯,除氯烯和1-羟基氯烯外,还检测到七氯环氧化物是主要的代谢产物。该菌株在培养14 d后对PDB培养基中的环氧七甲草醚的降解率为31%,主要代谢产物为2,3-二羟基七氯(七氯二醇)。
2.5 百菌清的微生物降解
Katayama等[28]从污染土壤中分离得到11株降解菌,分属于Pseudomonas、Azomonas、Moraxella和Flavobacterium等4个属,结果发现,土壤中百菌清浓度的增加可以促进百菌清降解菌数量的增长,进而分离得到可抗高浓度百菌清的降解菌。Lal等[29]分离得到百菌清降解菌TB1,其在5 d内不依靠其它碳源降解30 mg·L-1百菌清,产生4-羟基-2,3,5,6-四氯间苯二甲氰和一个单位的氯离子。Lee等[30]从污染土壤中分离得到1株百菌清降解菌Ochrobactrumsp.SH35B,在30 ℃、1/10 LB培养基中30 h对10 mg·L-1百菌清的降解率可达到100%。史秀珍等[31]从污染土壤中分离得到百菌清降解菌OchrobactrumlupiniTP-D1,采用硅胶薄层层析(TLC)分离、LC-MS检测代谢产物,确定代谢产物为4-羟基-2,3,5,6-四氯间苯二甲氰和1,3-二氨甲酰基-2,4,5,6-四氯苯。Yu等[32]从百菌清重复使用的土壤中分离得到1株棒状杆菌Y1,其在培养14 d后对10 mg·L-1百菌清的降解率达到67.9%。Wang等[33]分离得到1株在分类地位上属于新种的百菌清降解菌Lysobacterruisheniisp.CTN-1,其可以在无机盐农药平板上形成透明降解圈。谷月[34]研究发现,色齿毛菌CerrnaunicolorY4941培养72 h后,百菌清的残留率仅为1.92%;同时发现,硬毛粗盖孔菌FunaliatrogiiW4289、桦褶孔菌LenzitesbetulinaY4962、藏红硬孔菌RigidoporuscrocatusD10146、裂褶菌SchizophyllumcommuneD9466和云芝栓孔菌TrametesversicolorW4614对百菌清的降解率均可达80%以上。
表1列出了能降解以上5种主要有机氯农药的微生物,共涉及16个属。
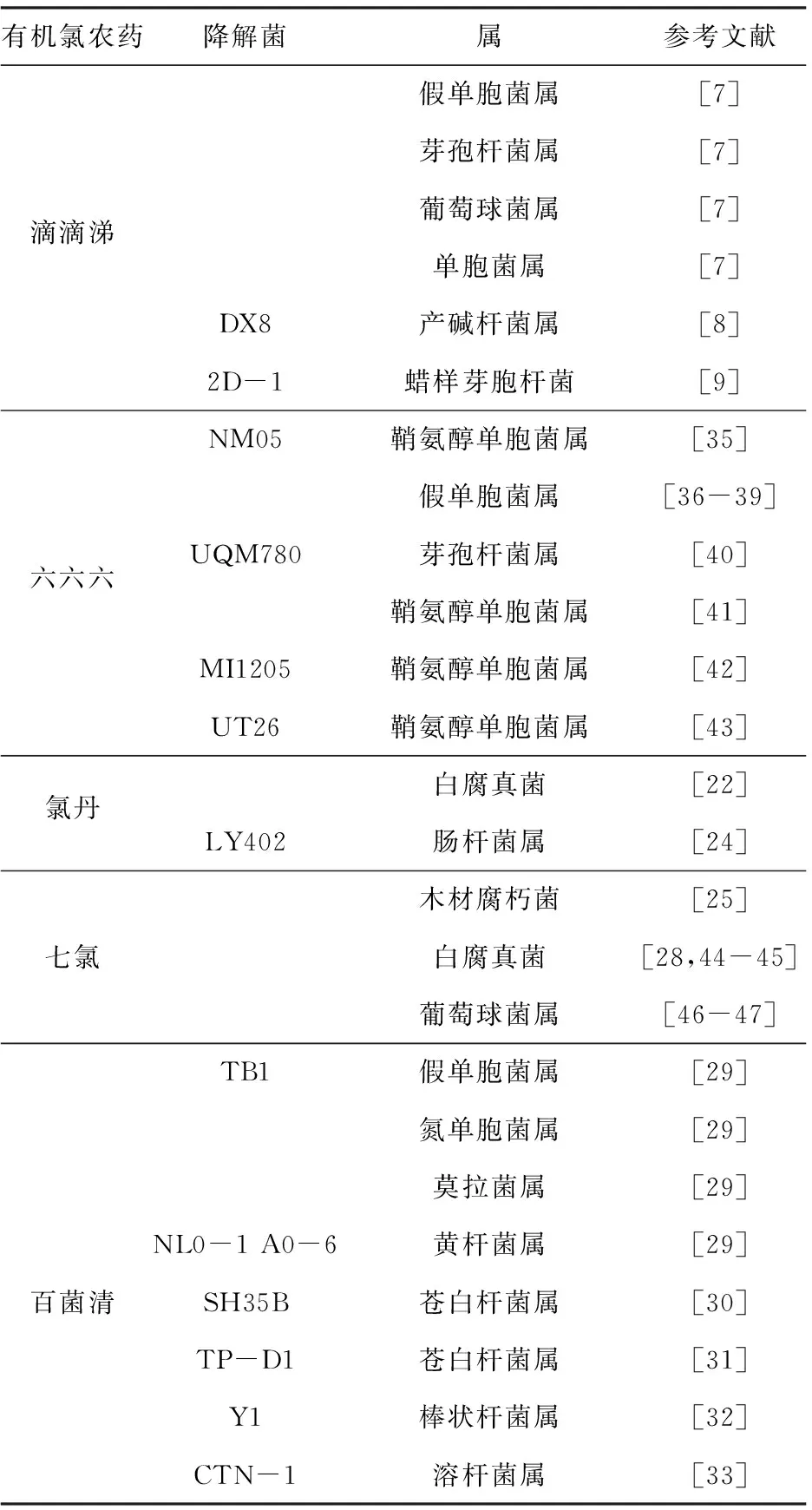
表1 国内外降解主要有机氯农药的微生物Tab.1 Organochlorine pesticides-degrading microorganisms at home and abroad
2.6 有机氯农药的混合菌群降解
赵煜坤等[14]研究发现,菌株BHC-A和wax能够对水稻田土壤中残留的六六六和滴滴涕起到很好的修复作用,降解率分别达到了98.93%和97.85%,且农药残留的降解速率与土壤中高效降解微生物的数量呈正相关。Abraham等[48]在研究毒死蜱、有机磷和硫丹污染土壤时发现,微生物菌群能对其进行高效降解,且降解产物为无毒代谢物。从毒死蜱污染的土壤中筛选得到Alcaligenessp.JAS1、Ochrobactrumsp.JAS2和Sphingobacteriumsp.JAS3,从有机磷污染土壤中筛选得到EnterobacterludwigiiJAS17、PseudomonasmoraviensisJAS18和SerratiamarcescensJAS16,从硫丹污染土壤中筛选得到KlebsiellapneumoniaeJAS8、EnterobactercloacaeJAS7、HalophilicbacteriaJAS4和Enterobacterasburiaestrain JAS5。Kurashvili等[49]采用微生物、植物对污染土壤进行联合修复,其中,利用Pseudomonassp.TBM6、Pseudomonassp.4JL50及大豆联合修复时,土壤中的滴滴涕含量降低了80%;利用Pseudomonassp.8JL63、Pseudomonassp.TP335及玉米联合修复五氯酚污染土壤最有效,土壤中五氯酚含量降低67%。Barragán-Huerta等[50]研究发现,利用绿豆、咖啡作为营养来源,铜绿假单胞菌(Paeruginosa)和稻瘟病菌(Foryzihabitans)可在厌氧条件下对滴滴涕和硫丹进行降解。高亚楠[51]在新疆棉花种植地区,利用混合菌种降解土壤中的高效氯氰菊酯,结果表明,棉田土壤中能降解高效氯氰菊酯的可培养微生物种类较少,其中优势微生物是铜绿假单胞菌,占90.91%,而无色杆菌占9.09%。该菌群最适条件为:温度27 ℃、初始pH值7.0、装样量200 mL。在培养24 h时,高效氯氰菊酯的降解率为68.81%;在培养132 h时,高效氯氰菊酯的降解率为 92.39%。张宁[52]利用贪铜菌(Cupriavidussp.)YNS-85和根瘤菌(Rhizobiumsp.)ZL-27组建复合菌剂,发现两种细菌能够共存并能同时降解溶液和土壤中的五氯硝基苯和乙草胺。在20 mg·kg-1五氯硝基苯和 30 mg·kg-1乙草胺为碳源的无机盐液体培养基中,复合菌剂3 d内对五氯硝基苯的降解率为 65.77%,对乙草胺的降解率为 86.10%。盆栽土壤降解实验结果显示,40 d内ZL-27对乙草胺的降解率为30.91%,复合菌剂对五氯硝基苯的降解率为62.72%,对乙草胺的降解率为10.23%。总之,微生物菌群的联合作用明显优于单菌株的降解效果,微生物菌株之间的协同作用强化了有机氯农药的降解。这与Xu等[53]对难降解有机物多环芳烃的生物修复结果以及王晓慧[54]对高效氯氟氰菊酯的生物修复结果一致。
3 微生物降解有机氯农药的降解酶和降解基因
微生物降解有机氯农药需要多种酶的共同参与,目前发现有机氯农药的降解酶主要包括脱氯化氢酶、水解酶、脱氢酶和脱氯酶等。脱氯化氢酶是对有机氯农药底物分子上脱去氯化氢形成碳碳双键的酶。Nagata等[55]在降解菌SphingomonaspaucimobilisUT26 中发现了无需辅助因子的由linA基因编码的六六六脱氯化氢酶;Kumari等[56]从SphingomonaspaucimobilisB90中发现了需辅助因子的3-氯-D-丙氨酸-脱氯化氢酶,编码该酶的基因linA有两个不同副本,分别为linA1和linA2;还有学者从Muscadometistica中分离得到了需辅助因子的真核脱氯化氢酶[57]。由linB基因编码的水解酶催化有机氯农药的C-Cl键断裂,生成烷基-酶中间产物,然后被水解[55]。还有报道称linB能够降解linA不能降解的β-六六六[58]。六六六降解上游途径中,最后产生的酶是一种NAD+依赖的脱氢酶,该酶由linC基因编码[38]。六六六降解终产物为2,5-二氯对苯二酚[55]。Liang等[59]分离得到百菌清高效降解菌Pseudomonassp.CTN-3,构建基因文库后克隆得到水解脱氯酶chd基因,该基因直接负责降解百菌清,通过核磁共振波谱鉴定水解脱氯产物为4-Cl被-OH取代形成CTN-OH。此外,还有在有机氯农药降解下游途径中出现的还原酶,其典型代表就是氨基酸序列和θ-谷胱甘肽S-转移酶(GSTs)相似的linD,它能够将2,5-二氯对苯二酚经氯代对苯二醛还原为对苯二醛[60];还有间裂解双加氧酶linE,它能裂解含有两个-OH的苯环中间位-OH,linE也具有环裂解双加氧酶活力,能裂解对苯二醛、氯代对苯二醛、2,6-二氯对苯二酚[61]。氯代对苯二醛则能被马来酰醋酸还原酶linF还原为马来酰醋酸[39]。
表2列出了微生物降解有机氯农药的相关基因和酶。
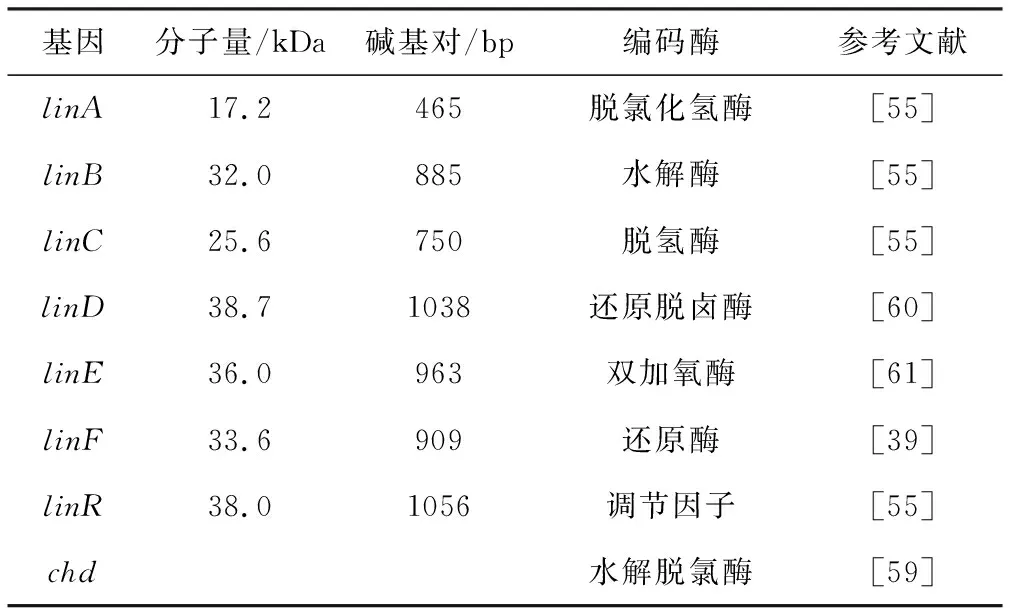
表2 微生物降解有机氯农药的相关基因和酶Tab.2 Related genes and enzymes for microbial degradation of organochlorine pesticides
4 展望
2002年,世界卫生组织宣布,重新启用滴滴涕用于控制蚊子的繁殖以及预防登革热等疾病,因此,有机氯农药对环境造成的污染和危害仍在继续,生物修复有机氯农药污染环境的应用技术仍然需要不断深入研究。目前的研究表明,单一微生物菌株降解有机氯农药时间长、见效慢,且作用环境要求苛刻;而联合培养菌株,构建高效降解优势菌群制成菌剂,对有机氯农药污染环境进行修复,虽快速高效,但要彻底解决有机氯农药的残留污染问题,还需要进一步探究微生物菌群之间的作用机理以及影响微生物降解有机氯农药的环境因素,以优化生物修复技术。同时,需要加强研究lin基因的多样性、分子遗传学及潜在的降解能力,通过基因工程手段构建适合于规模化降解有机氯农药应用的高效工程菌,并应用于有机氯农药污染环境的生物修复。
