燕麦花药培养褐化的研究进展
2022-03-26王春龙孙墨可董玉迪郭来春李春花魏黎明加央多拉任长忠
田 娟 王春龙 张 曼 孙墨可 董玉迪 郭来春 李春花 魏黎明 加央多拉 任长忠
(吉林省白城市农业科学院 吉林白城 137000)
燕麦是禾本科燕麦属一年生草本植物,是一种集营养、饲用、药用于一身的特色杂粮作物。我国燕麦育种面临的问题是 “育种技术单一、方法陈旧、周期长、优良品种少”。通过常规的品种间杂交,难于突破原有性状,创造新的类型,而且想要获得纯合品系至少需要连续自交6~7代。单倍体育种可在较短时间内得到大量纯合的个体,而且加倍单倍体的隐性基因不会受显性基因遮盖而能够正常表达,不仅可以显著缩短育种年限还提高了育种效率。由于影响愈伤组织发生的因素有很多,燕麦属植物的花药培养成功率比较低[1]。在愈伤组织培养过程中,组织褐化、玻璃化和菌类污染统称植物组织培养的三大难题,控制褐化比控制菌类污染和玻璃化更加困难[2]。组织褐化是指外植体在诱导脱分化或再分化培养过程中,自身组织从表面向培养基释放褐色物质以致培养基变成褐色,外植体也随之进一步变褐死亡的现象,严重时愈伤组织周围的培养基也变成褐色,可导致愈伤组织新陈代谢紊乱、细胞破裂而最终坏死[3]。燕麦花药组织培养中褐化主要表现在花药褐变和愈伤组织褐变(未转移时褐变和转移到再生培养基后褐变),其影响燕麦花药愈伤组织诱导、再分化和生根,严重时还可使愈伤组织和培养基褐变,从而抑制燕麦花药培养的正常生理生化反应。所以有效的减少褐化是燕麦花药培养是否成功的关键。结合近几年对燕麦花药培养的研究及查阅国内外相关文献对燕麦花药培养中引起褐化的机理、褐变产生的影响因素和克服褐变的建议及方法进行总结归纳,针对燕麦花药褐化现象对其以后研究方向进行了讨论和展望。希望为解决燕麦花药培养技术中的褐化问题提供帮助。
1 褐化的机理
褐变现象按其发生的机制分2种,一种是非酶促褐变,另一种是酶促褐变[4]。大多数的学者认为酶促褐变是外植体组织培养过程中褐变的主要途径[5]。
1.1 非酶促褐变
植物外植体的非酶促褐变是坏死导致的褐变现象,并不涉及酚类物质产生。是由于细胞受胁迫或其他不利条件影响所造成的细胞程序化死亡或自然发生的细胞死亡。若采取适当措施或外植体适应了胁迫环境则该种褐变现象就不再发生[6]。
1.2 酶促褐变
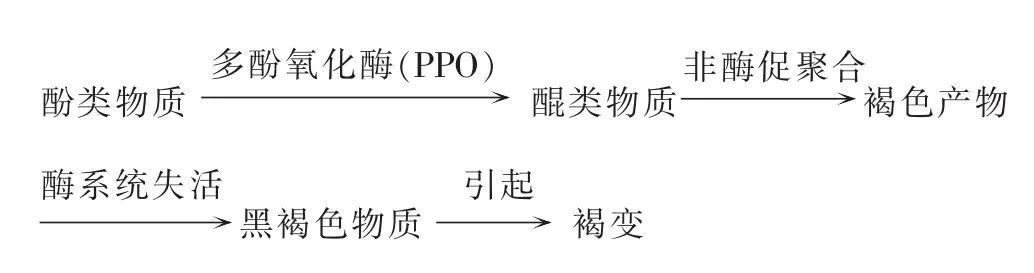
植物外植体的酶促褐变是酚类物质氧化的结果。主要由氧化酶类作用于天然底物酚类物质而引起的,所以褐化又称酚污染[7]。YANG等[8]的研究表明,多酚氧化酶(PPO)和过氧化物酶(POD)是引起外植体和愈伤组织褐变的2种关键酶,其酶活性相似,并以PPO对愈伤组织褐变的影响较大。PPO是植物体中普遍存在的一种末端氧化酶,它可以催化酚类物质形成醌类物质,醌类化合物自发的与组织材料中的蛋白质发生聚合或与其他NH2或SH化合物聚合浓缩而形成褐色产物,引起其他酶系统失活,导致代谢紊乱变色,形成黑褐色物质,从而引起外植体和愈伤组织褐变[9-12]。其机理如下:
2 褐变产生的影响因素
在植物组织培养中褐变现象是由多种因素综合产生的结果,随植物的种类、基因型、外植体生长部位及生理状态,培养基及培养条件等的不同,褐变的程度也有所不同[13]。燕麦花药组织培养中褐化现象也离不开以上原因。
2.1 基因型
燕麦花药相比小麦和大麦很容易变褐,主要是因燕麦不同品种的花药中乙烯的含量不同,抗氧化的能力不同[14]。不同基因型褐化程度也不一样,有些基因型容易诱导愈伤组织,而有些基因型花药则易变褐,诱导愈伤组织较困难。所以在选择花药培养时应注意这个问题。
2.2 燕麦花药生理状态
不同生理状态的燕麦花药酚类物质的含量及PPO的活性有差异。对燕麦花药组织培养而言,供体燕麦植株的生长环境,如温度、水分和光照等对花药的活力都有影响,哪一个因素不符合都能导致燕麦花药在培养过程中出现褐化。燕麦为圆锥花序,同一穗里面的不同小穗发育时期也不同,所以采集花药的时期、花药的大小、颜色对后期培养是否出现褐化也很关键。另外,由于受伤的燕麦花药其体内的多酚氧化酶的活性会逐渐增高,所以受伤的花药易发生褐化。
2.3 培养基
培养基既是为外植体提供营养的基础物质,又是细胞生长和繁殖的生存环境。培养基的无机盐成分和含量、糖的来源和浓度、生长素和细胞分裂素的配比及其他附加物质等都可以影响褐变现象的发生。培养基的pH和硬度的不同也会对外植体的褐变有影响。所以选择适当的培养基的成分和浓度及最佳的生长调节剂等附加物可以有效地克服褐变。
2.4 培养条件
光照和温度等外界条件对植物组织培养褐变的影响也至关重要。因为温度和光照会影响多酚氧化酶的活性,在高温或强光环境中,多酚氧化酶的活性会提高,醌类物质的累积加速,细胞会失水死亡,褐色物质大量聚集,产生褐变。因此,在植物组织培养初期,愈伤组织的诱导一般会在避光环境中进行培养,一旦接触光照就会产生褐变。高CO2会促进褐变[15-16],原因是环境中的CO2向细胞内扩散,使细胞内积累过多的碳酸根离子,碳酸根离子与细胞膜上的钙离子结合使有效的钙离子减少,导致内膜系统紊乱和瓦解,使酚类物质与PPO相互接触,发生褐变。
2.5 其他影响因素
转皿(瓶)时间早晚也会影响分化生长及褐变,在适当时间转皿,不要让花药或愈伤组织在一个地方待得时间太长,以防止其分泌的酚类物质过多而褐化[9]。
3 克服褐变的方法及建议
3.1 选择适合的基因型
文献资料[17-18]表明,在做燕麦花药组织培养时对基因型的依赖性很强。选择褐变程度较小的燕麦品种可以有效的防止褐化。
3.2 选择最佳状态的燕麦
供体植株的生理条件、内源激素水平和花药组织的营养状况都会影响褐化发生,许多基因型的花药应答存在明显的季节变化,从田间种植的植物中提取的花药比从温室提取的花药反应更好,此外在这个季节第一次开花的花药被发现反应更灵敏[19]。有文献记载燕麦花药培养中供体材料的培养要控制一定的温度,在特定的光照时间和光照强度下,花药才会有反应[20]。有研究[14]表明,燕麦在其他条件相同的情况下,纬度不同导致绿苗率不同。所以选择最佳状态的燕麦花药可以防止褐化。
3.3 选择适当时期的花药
花药培养是获得双单倍体生产的首选方法,花粉胚状体和愈伤组织的形成通常是通过小孢子培养完成的,对于燕麦来说,诱导胚胎发生的最佳小孢子发育时期是单核中后期至双核早期,选择好燕麦花药的最佳时期对防止褐化很重要。常用的燕麦花药时期的确定方法有2种,一是镜检法[21-22]:选取燕麦幼穗剥离出花药放在洁净的载玻片上,然后在花药上滴一滴染色剂,染色剂最常用的是醋酸杨红,也可以用龙胆紫、0.3 M甘露醇或者水代替,用玻璃棒敲碎后盖上盖玻片,染色5 min后用显微镜观看;二是形态测量法:Marzena Warcho等[23]选用4种燕麦为试验材料观察旗叶基部到倒数第二叶基部的距离,设置 0~4.0 cm(A)、4.1~8.0 cm(B)、8.1~12.0 cm(C)、12.1~16.0 cm(D)4个梯度,结果发现旗叶基部到倒数第二叶基部距离0~4 cm最好。一般种植在温室条件下需5~6周时间可到这个时期,但是不同品种有所不同,具体情况需自己摸索。也可以观察花药长度和花药颜色,一般花药长度2.5 mm(范围2.0~3.0 mm,因品种而异),常用发育最好最大的小穗,在一个小穗里选用最长最绿的花药[24]。
3.4 预处理
适当的预处理可以减轻花药褐变。燕麦花药组织培养中常用的预处理是冷热预处理[25],将采集的幼穗放在装有水的烧杯内在4℃下保持7 d,然后接种到诱导培养皿放入32℃的培养箱中热处理5 d,转移到正常28℃培养箱内培养。也可以冷热处理和饥饿处理相结合[19],将采集的幼穗放在装有0.3 M甘露醇的烧杯内在4℃下保持7 d后接种到诱导培养皿放入32℃的培养箱中,热处理5 d后转移到正常28℃培养箱内培养,甘露醇处理比水处理可以获得更多的1~2 mm胚胎和产生更多的绿苗和较少白化苗病株。
3.5 选择适当的培养基
在培养基方面应注意适当的无机盐成分、糖源及浓度、激素组合与水平,以及配合一些抗褐变剂等都可减轻褐变现象的发生。
有研究表明Mn2+和Cu2+浓度低时,外植体的褐化程度轻,燕麦最常用的是改良的W14培养基[26],可能是因为它里面的MnSO4·4H2O含量是8 mg/L,较C17(11.2 mg/L)、MS(16.9 mg/L)和 B5(10 mg/L)低,有助于防止花药褐化。刘艺平等[27]认为珊瑚台愈伤组织抗褐化效果麦芽糖比蔗糖好。同样Elina Kiviharju等[28]认为在燕麦花药组织培养中麦芽糖比蔗糖是更好的碳源,改进的W14[29]诱导培养基需要一定量的乙烯利和L-半胱氨酸,其中L-半胱氨酸具抗氧化能力,可阻止褐化;Elina Kiviharju等[30]研究诱导培养基中加入高浓度(3~5 mg/L)2,4-D丁酯和低水平的KT,因为虽然KT可以影响愈伤组织的质量,但是高浓度的KT经常造成花药的褐化,可能与分裂素能促进酚类化合物合成或刺激多酚氧化酶的活性有关。Elina Kiviharju 等[31]将 A(MS+10%蔗糖)和 B(MS+1 mg/L 2,4-D丁酯+10%蔗糖)2种诱导培养基诱导出的燕麦花药愈伤组织转移到E25(2.0 mg/L玉米素+0.1 mg/L TIBA)和 E26(1.0 mg/L TIBA)2 种再生培养基上,结果在A诱导培养基上诱导出的愈伤组织在E25和E26上都获得再生植株,但是在B诱导培养基上诱导出的愈伤组织在E26上获得再生植株,在E25上褐化,说明燕麦花药愈伤组织褐化不光与诱导培养基的激素配比有关,也因再生培养基的生长调节剂的不同而不同。在燕麦花药组织培养中,有人[32]认为加入活性炭虽然能防止褐化,但是愈伤组织的数量会下降,也有人[14]认为抗坏血酸和谷胱甘肽还原剂对防止褐化没有明确的作用。每种抑制褐变发生的方法都有一定的适用范围和局限性,应根据培养中的实际情况选择不同的方法,使其有效地抑制或减轻组织培养中褐变的发生。
3.6 选择适当培养条件
培养过程中还要注意适宜的培养条件。因为在酚类物质的合成和氧化过程中,有许多酶系统参与,其中部分酶系统是光活性的。燕麦花药组织培养过程中,诱导在黑暗中和再生在昏暗的弱光下[14],以减少褐化。较高的温度会使酶促褐变加强,所以建议在培养过程中保持较低的温度来减轻培养材料的褐变。Ponitka A等[17]把燕麦花药愈伤组织转移到再生培养基后再生温度调整为22℃,降低了褐化并且获得绿苗最高能达到42.2%。Sidlu和Davies[33]报道了使用高pH(8.0)的培养基比pH(5.8)较低的培养基能诱导出更多的愈伤组织,在培养基的pH为8.0时细胞生长受到限制,愈伤组织容易出现褐化现象。燕麦花药培养时,培养基的pH要控制在一定的范围内,不要太高,也不要太低,建议最佳pH为5.8。
3.7 其他建议
在取穗时,选择在晴天的上午 7:00~9:00,这个时期小孢子活力强,可以预防出现褐化;培养密度30个/皿(直径 3.5 cm)[25],如果密度过高随着营养元素、激素的消耗及分泌物的积累导致表细胞生理品性降低容易产生褐化;不断添加新鲜的培养液以减轻褐化现象;适当缩短转皿(瓶)周期,如接种2 d转移至新的培养皿,就可以减少酚类物质积累,连续转移几次可以有效的防止褐化;发现愈伤组织有褐变现象要及时继代,选择合适的继代时间,一般15 d进行1次继代,将未发生褐变的愈伤组织转入新培养基中,挑出褐变的愈伤组织,在转皿(瓶)过程中做到轻拿轻放,尽量避免损伤愈伤组织,因为人为损伤也会增加愈伤组织的褐变;如果有愈伤组织逐渐呈现水浸状和半透明状,可以在继代培养基中适当加入甘露醇调节渗透压,避免褐变死亡;在转移时选择表面粗糙、凹凸不平、硬度适中的愈伤组织可以避免愈伤组织转移后发生褐化。
4 讨论及展望
褐变可导致燕麦花药、愈伤组织和幼苗死亡。褐变的发生过程比较复杂,不同基因型和不同生理状态下燕麦体内的酚类物质、酶及其他化合物等因素可引起燕麦组织褐变,培养基的无机盐成分和含量、糖的来源和浓度、生长素和细胞分裂素的配比及其他附加物质的添加,培养时的光照时间和强度、温度的不同、二氧化碳和pH等外界培养条件均可引起燕麦组织褐变。虽然褐变过程复杂,但经过多年的研究和发展,一部分褐变规律和机理已被掌握,同时也提出了一些有效减轻和防止组织褐变的方法。但是还需要不断从组织组成、超微结构学、染色体片段等方面深入研究褐化机制,找到影响褐变的主导因子和克服褐变的更有效方法,并从实践上防止褐变的发生。随着现代分子生物学技术的发展,今后应在相关致褐基因的表达上解释褐变机制,加强防止燕麦愈伤组织褐变措施的研究。抑制燕麦花药组织培养发生褐变的措施多种多样,但每种方法都有一定的适用范围和局限性,应根据培养中的实际情况选择适当的方法,使其有效地抑制或减轻燕麦花药组织培养中褐变的发生。
