影响牡丹石榴外植体褐变的因素分析
2016-11-28王兰明刘艳芬高彦魁
王兰明+刘艳芬+高彦魁

摘要:褐变是影响牡丹石榴离体培养成功的关键因素之一。为减轻牡丹石榴初代培养中的褐变问题,研究基本培养基类型、附加物、光照条件、继代周期、取材时间5种因素对外植体褐变的影响。结果表明:适宜的基本培养基为1/2MS;黑暗处理对褐变的影响不明显;聚乙烯吡咯烷酮对褐变有明显的抑制作用,最佳处理浓度为2.0 mg/L;4月下旬取带芽的半木质化茎段为外植体,其褐变程度最轻;取材时间和转接次数对褐变的影响明显。
关键词:牡丹石榴;聚乙烯吡咯烷酮;外植体;褐变;因素
中图分类号:S665.404+.3 文献标志码: A
文章编号:1002-1302(2016)09-0181-03
石榴(Punica granatum)为石榴科石榴属植物,是我国重要的果树和观赏花木之一。牡丹石榴是近年来选育的新优品种,其花朵硕大似牡丹,花期长达5个月,果大味美,且花果同期同树,是花果俱佳的珍贵石榴品种[1-2],颇具推广价值。
石榴常规的扦插、分株等繁殖方法,繁殖速度慢,难以满足日益增多的种苗需求。目前,已有学者致力于通过组织培养进行石榴快速繁殖的研究[3-5]。但是由于石榴体内酚类物质含量高,组织培养过程中外植体褐变严重[6-7],常造成外植体死亡,成为石榴离体培养过程中的关键制约因素。目前,关于牡丹石榴离体再生技术虽然鲜有报道[8],但没有关于其褐变这一关键问题进行报道和系统研究。本试验以牡丹石榴带芽茎段为外植体,研究基本培养基、附加物、光照条件、转接次数、取材时间5种因素对外植体褐变的影响,以探讨减轻牡丹石榴离体培养中褐变现象的因素条件,为其离体再生体系的建立和规模化繁殖提供依据。
1 材料与方法
1.1 试验材料
试验材料取自河北工程大学实验基地引进的3年生牡丹石榴树苗。
1.2 试验方法
试验于2014年4月下旬进行,以牡丹石榴半木质化茎段为外植体,经过常规消毒后,剪切成单芽茎段,接种于各处理培养基,进行单因子试验。培养基和培养条件若无特殊说明,蔗糖含量均为30 g/L,琼脂含量均为5.5 g/L,pH值5.8,培养温度25 ℃,光照时间16 h/d,光照度2 500 lx。接种1周后统计各处理的褐变率和褐变系数,5周后统计褐变死亡率、萌芽率、腋芽生长状况。
相应计算公式:外植体污染率=污染的外植体总数/接种的外植体总数×100%;褐变率=存活的褐变总数/存活的外植体总数×100%;存活率=存活的外植体总数/接种的外植体总数×100%;褐变指数=(∑褐变级数×该级个数×100)/(褐变总数×最高级级数)。褐变级数:0级,茎段基部褐色物质渗出不明显,5周后腋芽正常萌动;1级,茎段基部有少量淡褐色物质渗出,5周后腋芽正常萌动;2级,茎段基部褐色物质扩散至茎段直径的1~2倍,5周后茎芽萌动缓慢;3级,深褐色物直径扩散至茎段直径的2倍以上,茎段部分变黑褐色,腋芽不萌动;4级,茎段基部有大量褐色物质渗出,5周后腋芽、茎段变黑死亡。
1.2.1 基本培养基的确定 2014年4月中旬,将表面灭菌的外植体接种于MS、1/2MS、1/3MS、1/4MS 4种含有不同浓度无机盐的基本培养基中,每种培养基均添加0.5 mg/L6-BA、0.1 mg/L IBA。每个处理接种8~10瓶,每瓶接种2个外植体。重复3次,数据用SPSS统计软件分析。
1.2.2 光照条件的确定 2014年4月中旬,将外植体表面灭菌后接种于MS+0.5 mg/L 6-BA+0.1 mg/L IBA培养基中,光照条件共设3个处理,分别为黑暗、光照时间16 h/d、全光照。每个处理接种12~13瓶,每瓶接种2个外植体。
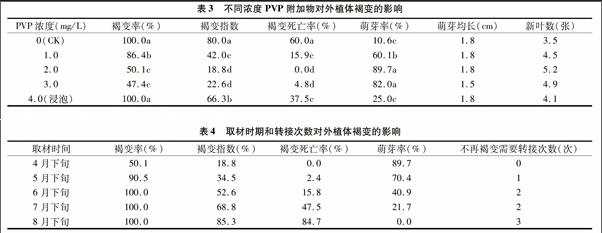
1.2.3 附加物浓度的确定 2014年4月下旬,附加物聚乙烯吡咯烷酮(polyvinylpyrrolidone,简称PVP)共设5个处理,每个处理接种8~10瓶,每瓶接种2个外植体,重复3次。数据用SPSS统计软件分析。各处理配方:处理1,1/2MS+0.5 mg/L 6-BA+0.1 mg/L IBA;处理2,1/2MS+0.5 mg/L 6-BA+0.1 mg/L IBA+1.0 g/L PVP;处理3,1/2MS+0.5 mg/L 6-BA+0.1 mg/L IBA+2.0 g/L PVP;处理4,1/2MS+0.5 mg/L 6-BA+0.1 mg/L IBA+3.0 g/L PVP;处理5,外植体用含4.0 mg/L PVP无菌溶液浸泡5 min后接入处理1培养。
1.2.4 不同取材时期和转接次数的确定 分别于2014年4月下旬、5月下旬、6月下旬、7月下旬、8月下旬5个不同时期进行取材接种,将外植体表面灭菌后接种于1/2MS+0.5 mg/L6-BA+0.1 mg/L IBA+2.0 g/L PVP培养基上。每个处理接种12~13瓶,每瓶接种2个外植体。以2 d为继代周期,分别统计各取材时期不再发生褐变所需的转接次数。
2 结果与分析
2.1 基本培养基对外植体褐变的影响
由表1可见,在MS、1/2MS、1/3MS、1/4MS 4种基本培养基上,褐变发生率均为100.0%,但褐变指数、褐变死亡率以及萌芽率、腋芽生长状态不尽相同;MS培养基与1/2MS、1/3MS、1/4MS培养基的褐变指数、褐变死亡率和萌芽率均有显著差异,说明无机盐含量对褐变程度有明显影响;虽然MS、1/2MS、1/3MS、1/4MS培养基的褐变程度呈逐渐减轻的趋势,但是接种5周后,1/3MS、1/4MS培养基上的新叶较小,可能是无机盐含量低造成的。因此,选择1/2MS作为基本培养基,既可以减轻褐变程度,又不影响腋芽的生长。
2.2 光照条件对外植体褐变的影响
由表2可以看出,外植体在3种光照条件下的褐变程度均较严重,褐变率依然均为100%;虽然褐变指数有逐渐减小的趋势,但是3个处理间整体变化与褐变死亡率、萌芽率均无明显差异。结果表明,仅黑暗处理对于减轻牡丹石榴外植体褐变的效果并不明显。
2.3 附加物对外植体褐变的影响
由表3可见:添加不同浓度PVP的褐变指数、褐变死亡率均显著低于不加PVP(对照)的处理;其中2.0、3.0 mg/L PVP的处理效果最好,但是后者萌发的新芽平均长度和新叶数均低于前者;4.0 mg/L PVP溶液浸泡的褐变率与对照相同,依然为100%,虽然褐变指数、褐变死亡率、萌芽率与对照相比均差异显著,但是仍然显著高于2.0、3.0 mg/L PVP的效果。因此可见,1/2MS+0.5 mg/L 6-BA +0.1 mg/L IBA +2.0 mg/L PVP为减轻牡丹石榴外植体褐变最有效的培养方法。
2.4 不同取材时期和转接继代次数对外植体褐变的影响
取材时间对外植体的褐变率、褐变指数、褐变死亡率以及萌芽率均有明显影响,严重时甚至可导致外植体全部死亡。在生长季枝条半木质化后,取材时间越早,褐变越轻。由表4可以看出,4月下旬接种的外植体褐变指数最小,为18.8%,褐变死亡率为0,萌芽率可达89.7%;而随着取材时间的推移,褐变程度明显加重,虽然培养基中2.0 mg/L PVP为附加物,但是6月下旬开始,外植体褐变发生率已达100%;8月下旬取材时外植体的褐变死亡率已达84.7%,萌芽率为0。
转接继代对于保证外植体的成活有明显的作用。在添加2.0 mg/L PVP的培养基上,4月下旬取材时,不需要转接,外植体就能正常萌芽。5月下旬时,需要2 d后转接1次,即可抑制褐变的发生。以后需要多次转接,才能保证外植体的成活。而8月下旬取材时,褐变死亡率高达84.7%,虽然有个别外植体成活,但5周后由于褐变严重,没有萌芽。
3 结论与讨论
3.1 结论
牡丹石榴组培过程中,外植体褐变严重。本试验表明,无机盐浓度、PVP附加物对减轻褐变有明显效果,1/2MS无机盐浓度、2.0 mg/L PVP附加物可作为最适培养基成分。暗处理对褐变影响效果不明显。取材时间对外植体褐变程度影响极大,河北省中南部4月下旬为最佳的取材时期。多次转接可以起到较好的减轻褐变、保证外植体成活的效果。
3.2 讨论
植物组织培养过程中,外植体的褐变时有发生。尤其是木本植物与单宁、酚类物质含量高的植物,如板栗[9]、核桃[10]、黄连木[11]等,褐变程度尤其明显,严重时可导致外植体死亡。除外植体基因型外,褐变程度还受取材时期、外植体类型、培养基成分、培养条件等多种因素的影响。
降低无机盐浓度对于减轻褐变的发生有较好的作用。但无机盐浓度过低,随着培养时间的延长,会影响外植体的正常生长。培养基中附加不同浓度的抗氧化剂、吸附剂均能有效抑制褐变的发生,但植物材料不同,附加物种类和浓度会有差别。王菲等在三白石榴[6]、王立娅等在蝴蝶兰的研究[12]中,均认为PVP对减轻褐变有较好的效果。而有些研究认为,活性炭抑制蝴蝶兰褐变的效果优于PVP。由此可见,植物组织培养中,加入酚类物质的吸附剂PVP对于减轻外植体的褐变仍没有一定的规律,其抑制褐变的机制还须进一步研究。
一般认为,暗培养由于可以抑制光诱导的多酚氧化酶的活性,因此可以减轻褐变的发生。这在减轻蝴蝶兰的褐变程度[12],延缓黄连木[11]、沙棘[13]的褐变时间方面均有报道。本试验发现,暗培养对褐变程度的减轻或延缓均没有明显作用,推测牡丹石榴褐变的发生过程除与多酚氧化酶相关外,可能还有不受光诱导的其他酶的参与,这一机制仍有待进一步研究。
本试验表明,取材时期对褐变程度有明显影响,褐变程度最轻的取材时期为4月下旬半木质化的枝条,这与在紫叶黄栌[14]、牡丹[15]研究中的报道一致。这可能与不同生长时期植物体内酚类物质含量不同有关。枝条生长早期,牡丹石榴体内酚类物质的含量较低,随着生长的继续,酚类物质含量逐渐增高,褐化日趋严重。
参考文献:
[1]袁 丽,高瑞昌,田永全. 石榴营养保健功能及开发利用[J]. 农业工程技术,2007,2(10):38-42.
[2]王焕兴. 牡丹石榴[J]. 落叶果树,2002,34(2):59-60.
[3]黄剑华,王亦菲,周润梅,等. 软籽石榴组培原种苗的诱导及快繁[J]. 上海农业科技,2002,32(6):16.
[4]王雪婧. 黄花石榴组织培养及植株再生研究[D]. 雅安:四川农业大学,2008.
[5]李佳娣. 软籽石榴组织培养再生体系的研究[D]. 淮北:淮北师范大学,2011.
[6]王 菲,苑兆和,招雪晴,等. 三白石榴再生体系的构建[J]. 中国农学通报,2013,29(19):125-133.
[7]张爱民,李佳娣,薛建平,等. 降低软籽石榴组织培养过程中外植体褐化的研究[J]. 安徽农业科学,2011,39(6):3182-3183.
[8]刘广甫,李洪涛,陈延惠,等. 牡丹花石榴的茎尖组织培养再生体系研究[J]. 河南林业科技,2007,27(3):17-19.
[9]刘玉芬,赵国强,曹庆芹,等. 板栗短雄花序芽变的离体培养研究[J]. 中国农学通报,2008,24(10):99-102.
[10]王 娟,田建保,贺小红,等. “金薄香”核桃组培中灭菌及防止褐变的研究[J]. 山西农业大学学报:自然科学版,2008,28(3):290-292.
[11]程世平,施 江,史国安,等. 黄连木茎段组织培养中防褐化技术研究[J]. 河南农业科学,2010,38(10):110-113.
[12]王立娅,方 正,李英丽,等. 蝴蝶兰组织培养中防褐化技术研究[J]. 河北农业大学学报,2008,31(5):42-45.
[13]杜 研,李 毅,马彦军,等. 几种影响沙棘组织培养外植体褐化因子分析[J]. 河北农业大学学报,2007,30(5):42-42.
[14]刘艳芬,田春雨,孙晓梅. 防止紫叶黄栌组织培养中外植体褐变的试验研究[J]. 辽宁林业科技,2006,33(4):14-15.
[15]田 真,郭 倩,曹 满,等. 牡丹组培鳞芽外植体最佳取材时期的研究[J]. 园艺学报,2014,41(增刊1):2761.
