尿酸性肾病大鼠模型建立的研究
2022-03-25严美霞田瑞敏胡天祥陈达豪陈小玲
严美霞,霍 帅,田瑞敏,5,徐 鹏,5,黎 创,5,胡天祥,陈达豪,陈小玲,毛 炜,6∗
(1.省部共建中医湿证国家重点实验室(广州中医药大学第二附属医院),广州 510120;2.广州中医药大学第二临床医学院,广州 510120;3.广东省中医院肾内科,广州 510120;4.河南省人民医院肾内科,华中阜外医院肾内科,郑州 450003;5.广东省中医药防治难治性慢病重点实验室,广州 510006;6.广东省中医证候临床研究重点实验室,广州 510006)
高尿酸血症(hyperuricemia,HUA)为体内嘌呤代谢紊乱和(或)肾对尿酸排泄障碍所致的一种常见代谢性疾病。尿酸性肾病(uric acid nephropathy,UAN)是HUA最常见的并发症之一[1-2],尿酸盐结晶在肾小管的沉积为其主要病因。大鼠是最常用的实验研究动物之一,但因大鼠体内的UA在尿酸酶作用下可分解成尿囊素,难以出现自发性HUA及UAN,目前国内多采用氧嗪酸钾灌胃或腹腔注射,联合腺嘌呤或酵母灌胃等方法[3]。在氧嗪酸钾作用下,大鼠体内尿酸酶活性下降,抑制UA分解,导致血UA增多,单用氧嗪酸类药物在短期内(5周)可引起大鼠肾动脉病变,需要干预7周以上才能出现明显的肾损伤[4]。该造模方法可引起轻度肾损伤,而造模时间长,氧嗪酸钾药物价格偏贵,若想探究肾小管间质纤维化,则成模周期更长。而尿酸作为引起UAN的直接物质,不用经过体内嘌呤代谢过程。有研究将氧嗪酸钾注射联合尿酸灌胃,第5~6周先后出现肾的炎症反应、肾动脉病变及高血压等病变[5],本研究尝试采用混合氧嗪酸钾和不同浓度尿酸灌胃的方法,尝试建立一种操作简便、重复性好、能够稳定模拟人类尿酸性肾损害的的UAN大鼠模型。
1 材料和方法
1.1 实验动物
雄性SD大鼠,SFP级,20只,体重180~220g,购于广东省医学实验动物中心[SCXK(粤)2016-0041]。无菌手术在广东省中医药科学院动物实验室屏障动物实验设施进行[SYXK(粤)2018-0094],本实验经由广东省中医药科学院动物伦理委员会批准(2017044),同时,向实验动物给予3R原则的人道关怀。
1.2 主要试剂与仪器
氧嗪酸钾(批号:STBH0976)、尿酸(批号:BCCBB2049)购自Sigma公司;羧甲基纤维素钠(批号:20090328)购自上海阿拉丁公司;PBS粉包(批号:14E05A30)购自武汉博士德公司;10%福尔马林固定液(批号:JX0100)购自广州晶欣生物公司;二甲 苯(批 号:20201003)、无 水 乙 醇(批 号:20200820)、3%过氧化氢溶液(批号:20160304)购自天津大茂化学试剂厂;苏木素伊红染液(批号:092520201211)购自上海碧云天公司;中性树胶(批号:20130917)购自上海国药集团化学试剂公司;CD68(批号:GR3287728-2)、E-cadherin(批号:GR3260950-7)、α-SMA(批号:GR248336)购自美国abcam公司。罗氏自动生化分析仪(C702)购自德国Roche公司;组织包埋机(Histostar)购自Thermo Fisher公司;电动显微镜成像系统(BX61)购自日本OLYMPUS公司。
1.3 实验方法
1.3.1 实验分组
动物于广东省中医药科学院实验动物中心SPF级动物房分笼适应性饲养7d后,将已编号的大鼠升序排列体重值,同时经由随机数字表完成分组设计,随机划分出4组,每组5只,即正常组(Control组)、模型A组(M-A组)、模型B组(M-B组)、模型C组(M-C组),其中A、B、C组分别给予氧嗪酸钾750mg/kg+尿酸150mg/kg、氧嗪酸钾750mg/kg+尿酸300mg/kg、氧嗪酸钾750mg/kg+尿酸600mg/kg[6],正常组所用为相应量的0.3%羧甲基纤维素钠溶液,灌胃频次为每天1次,每3d对大鼠体重进行称定,同时基于体重对灌胃剂量进行调节,连续灌胃4周[6]。
1.3.2 标本留取
灌胃4周后收取大鼠血液样本,再借助低速台式离心机,于转速为3000r/min时实施15min离心操作,将分离出的血清分装至无菌的1.5mL离心管中,冻存于-80℃冰箱中。造模4周后取1/2右肾放置4%的多聚甲醛固定液中。
1.3.3 生化指标检测
借助罗氏自动生化分析仪与配套检测试剂,对大鼠血清检测以下指标:血尿酸(serum uric acid,sUA)、尿素氮(blood urea nitrogen,BUN)、血肌酐(serum creatinine,sCr)、甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)及高密度脂蛋白胆固醇(highdensity lipoprotein,HDL-C)[6]。
1.3.4 病理检测及分析
将肾组织移至4%的多聚甲醛溶液内,固定24 h,再实施常规石蜡包埋操作,之后切片厚度为3 μm,实施苏木素-伊红(HE)染色;Masson染色;免疫组化检测CD68、E-Cadherin、α-SMA的表达。并利用显微镜观察大鼠肾组织形态学变化,拍照记录,然后读片。
(1)HE染色:按照5分制评分法进行评分[7],评估细则根据肾病理损伤程度以病理损伤面积与拍摄视野面积比值(%)的大小判断:肾小球系膜基质是否增宽、增厚;肾小球硬化与否;肾小管萎缩与否;炎症细胞是否浸润肾间质;肾组织是否存在纤维化,具体为:无损伤为0分,小于10%为1分,10%~25%为2分,25%~50%为3分,50%~75%为4分,大于75%为5分,病理分析由两人独立进行。各组随机确定3个样本,各样本随机确定8个视野参与评分。
(2)Masson染色:首先进行石蜡切片,再行Masson染色,显微镜下记录其形态学改变,Masson染色胶原呈蓝色,每组3个样本,于400倍显微镜下随机选取8个视野,借助图像分析软件Image J开展分析,其中视野总范围中胶原阳性蓝染部分的占比即胶原容积分数(collagen volume fraction,CVF),将其平均值定为该组织CVF。
(3)免疫组化:4%多聚甲醇固定肾组织制成3 μm厚的石蜡切片脱蜡后,高压处理修复抗原,3%过氧化氢封闭内源性过氧化物酶,加一抗CD68、ECadherin、α-SMA,4℃孵育过夜之后,第2天进行二抗孵育,DAB显色,苏木素复染,最后常规脱水、封片。采用Image J软件评估免疫组化目的蛋白含量,目的蛋白的表达量即为阳性染色区域(棕色染色区域)与拍摄视野的百分比(%),各组随机确定3个样本,各切片随机确定8个视野参与评分,同时计算。
1.4 统计学方法
所有数据均为计量资料,首先评估其呈正态分布与否,符合者以平均数±标准差(±s)的形式表示,若非正态分布,呈现形式为中位数(四分位数)表示,即M(P25~P75)。在对比多组间数据方面,若为正态分布,同时方差齐性,则进行单因素方差分析法(ANOVA)检验,两两对比选择LSD法,差异显著,具有统计学意义的标准为“P<0.05”,上述数据统计工作均在SPSS20.0软件中完成,制图采用Garphpad prism8.0完成。
2 结果
2.1 各组大鼠体重变化
在体重方面,对比未造模时,造模4周后各组间无明显差异(P>0.05,P=0.05),在体重差值上,各组间差异显著(P<0.05),各模型组实验动物体重与Control组比较差异无统计学意义(P>0.05),就体重前后差值而言,相较于Control组,M-A组、M-B组差异显著具有统计学意义(P<0.05),结果见表1。
表1 各组大鼠造模前后体重比较(±s,n=5)Table1 Comparison of body weight of rats before and after modeling
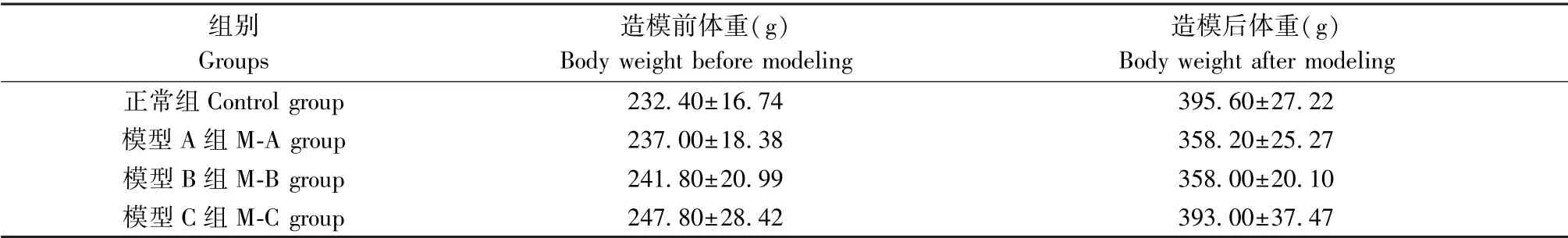
表1 各组大鼠造模前后体重比较(±s,n=5)Table1 Comparison of body weight of rats before and after modeling
注:与Control组比较,P>0.05。Note.Compared with the control group,P>0.05.
组别Groups造模前体重(g)Body weight before modeling造模后体重(g)Body weight after modeling正常组Control group 232.40±16.74 395.60±27.22模型A组M-A group 237.00±18.38 358.20±25.27模型B组M-B group 241.80±20.99 358.00±20.10模型C组M-C group 247.80±28.42 393.00±37.47
2.2 各组大鼠生化指标
2.2.1 各组肾功能比较
同Control组相比,另外3个模型组sUA表达水平示差异显著(P<0.01,P<0.05,P<0.05)。M-A组、M-B组及M-C组的大鼠对比于Control组,在BUN水平上差异不显著,无统计学意义(P>0.05),与Control组相比,M-B组、M-C组的sCr水平明显升高,差异具有统计学意义(P<0.05,P<0.01)。结果见表2。
表2 造模4周后各组大鼠血清尿酸、尿素氮及肌酐水平变化情况(±s,n=5)Table2 Changes in serum uric acid,urea nitrogen and creatinine levels of rats in each group for4consecutive weeks
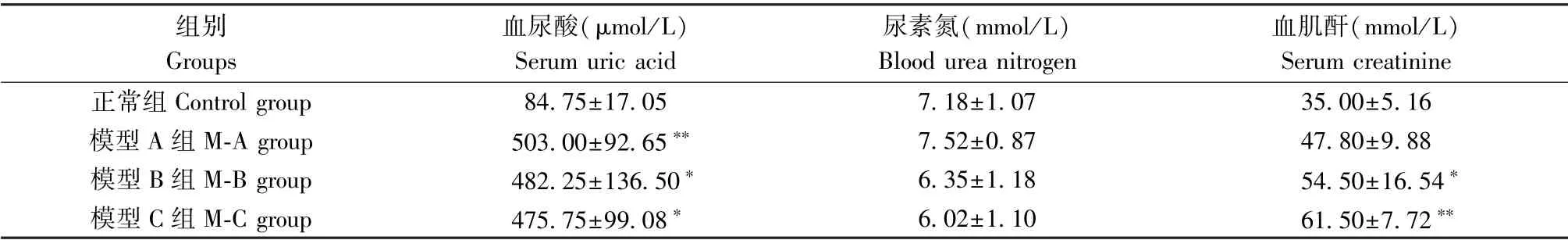
表2 造模4周后各组大鼠血清尿酸、尿素氮及肌酐水平变化情况(±s,n=5)Table2 Changes in serum uric acid,urea nitrogen and creatinine levels of rats in each group for4consecutive weeks
注:与Control组比较,∗P<0.05,∗∗P<0.01。Note.Compared with the control group,∗P<0.05,∗∗P<0.01.
组别Groups血尿酸(μmol/L)Serum uric acid尿素氮(mmol/L)Blood urea nitrogen血肌酐(mmol/L)Serum creatinine正常组Control group 84.75±17.05 7.18±1.07 35.00±5.16模型A组M-A group 503.00±92.65∗∗ 7.52±0.87 47.80±9.88模型B组M-B group 482.25±136.50∗ 6.35±1.18 54.50±16.54∗模型C组M-C group 475.75±99.08∗ 6.02±1.10 61.50±7.72∗∗
2.2.2 各组大鼠血脂结果比较
M-B组的TG明显低于Control组(P<0.05),而3个模型组的TC较Control组无明显差异(P>0.05)。Control组的LDL-C、HDL-C,M-B组的HDLC,M-C组的LDL-C整体检验组间差异均不显著(P>0.05)(见表3)。
表3 连续4周造模各组大鼠血脂水平变化情况,(±s,M(P25~P75),n=5)Table3 Changes in blood lipid levels of rats in each group for4consecutive weeks

表3 连续4周造模各组大鼠血脂水平变化情况,(±s,M(P25~P75),n=5)Table3 Changes in blood lipid levels of rats in each group for4consecutive weeks
注:与Control组比较,∗P<0.05。Note.Compared with the control group,∗P<0.05.
组别Groups甘油三酯TG(mmol/L)总胆固醇TC(mmol/L)低密度脂蛋白LDL-C(mmol/L)高密度脂蛋白HDL-C(mmol/L)正常组Control group 0.77±0.19 1.02±0.43 0.12(0.11~0.12) 0.48(0.44~0.49)模型A组M-A group 0.71±0.21 1.21±0.21 0.13(0.12~0.15) 0.53(0.47~0.58)模型B组M-B group 0.49±0.19∗ 1.04±0.10 0.12(0.11~0.13) 0.45(0.42~0.51)模型C组M-C group 0.67±0.72 1.15±0.11 0.11(0.10~0.12) 0.55(0.47~0.58)
2.3 各组大鼠肾组织病理结果
2.3.1 HE及Masson
HE染色结构表明,正常组大鼠在显微镜下观察到肾组织结构无异常,肾小管上皮细胞未见水肿,整齐排列,肾小球未见硬化且大小均匀,未见炎症细胞分布于肾间质,肾小管未见扩张、萎缩,形态正常,未见其他病理改变。而M-A组、M-B组及MC组相比于Control组,肾小球未见明显病理变化,此外,M-A组中可见部分肾小管扩张,无肾小球萎缩等改变,在M-B组、M-C组中,众多炎性细胞分布于肾间质,肾小管大幅扩张,此外,光镜下可见肾小管上皮细胞萎缩以及刷状缘脱落,细胞核数量大幅度下降,还观察到肾小管间质部位存在众多炎症细胞。在肾病理评分上,比较M-A组与Control组差异无统计学意义(P>0.05),然而M-B组、M-C组相较于Control组肾病理评分显着升高(P<0.01)。通过Masson染色形态学观察可知,Control组肾小球及肾间质红染,未见明显胶原纤维,M-A组与Control组比可见少量的肾间质出现蓝紫色胶原纤维沉积(P<0.05)。而M-B组、M-C组可见明显的胶原纤维沉积于肾小球和肾间质CVF升高(P<0.01)(图1~图3)。

图1 各组大鼠肾病理结果比较Figure1 Comparison of pathological results of rat kidney tissues in each group
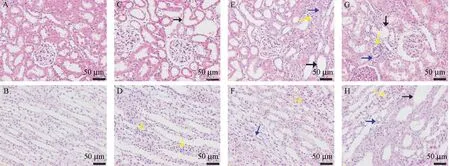
图2 各组大鼠肾病理形态学变化Figure2 Pathological changes of the kidneys in each group
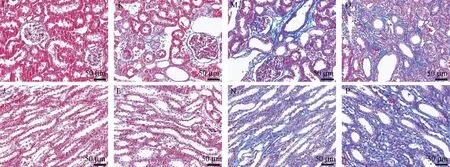
图3 各组大鼠肾Masson染色Figure3 Masson staining of kidney of rats in each group
2.3.2 炎症CD68的表达变化
CD68属于巨噬细胞标记蛋白其中之一,可反映巨噬细胞的浸润程度,从而了解肾间质的炎症情况。其中棕色部分为CD68阳性表达区域,利用CD68表达面积与整个视野面积百分比值(%)来评估肾间质炎症。与Control组相比,M-A组可见少量棕色表达部分(P<0.05),M-B、M-C组可见众多巨噬细胞浸润,具有明显的肾间质炎症反应(P<0.01)(表4、图4~图7)。
2.3.3 上皮细胞-间充质转分化及纤维化的变化
E-Cadherin(E-钙粘蛋白)阳性表达区域为细胞膜和(或)细胞质,作为上皮细胞标志物,其阳性表达率越低,说明上皮细胞数量愈低,上皮细胞-间充质细胞转分化(epithelial-mesenchymal transition,EMT)程度愈甚。相比于Control组大鼠,M-A组ECadherin表达量有所下降,但统计学没有意义(P>0.05),而M-B、M-C组可见明显的棕色表达量降低(P<0.01)(表4、图4~图7)。α-SMA(α-平滑肌肌动蛋白)是肌成纤维细胞、纤维细胞受损激活和表型转化的标志蛋白,其表达增加,可使肾纤维化的进展更快[8]。与Control组相比,M-A组可见少量的α-SMA的表达(P<0.05),此外,M-A组、M-B组表达量明显增加(P<0.01)(见表4、图4~图7)。
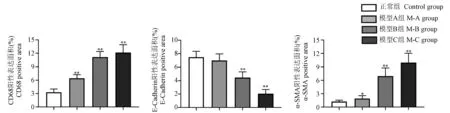
图4 各组大鼠免疫组化CD68、E-Cadherin、α-SMA蛋白阳性表达面积Figure4 Immunohistochemical positive expression areas of CD68,E-Cadherin and α-SMA in each group
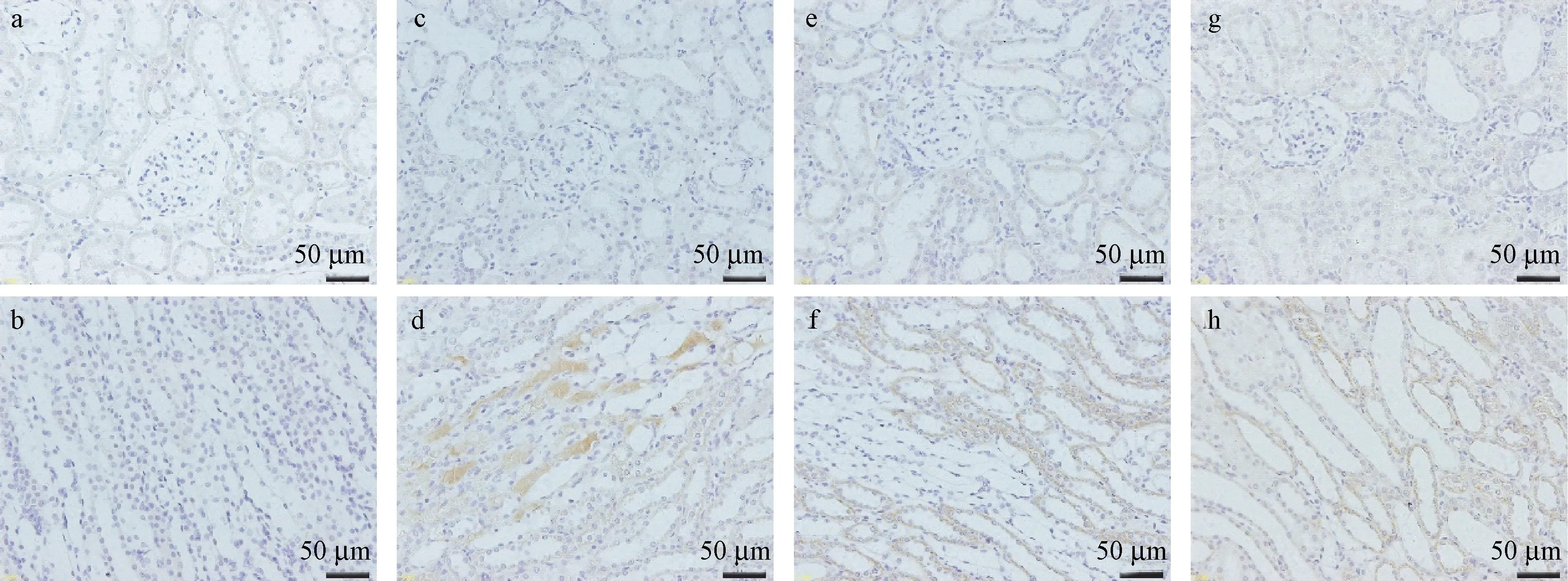
图5 各组大鼠免疫组化CD68蛋白阳性表达Figure5 Immunohistochemical positive expression of CD68protein in each group
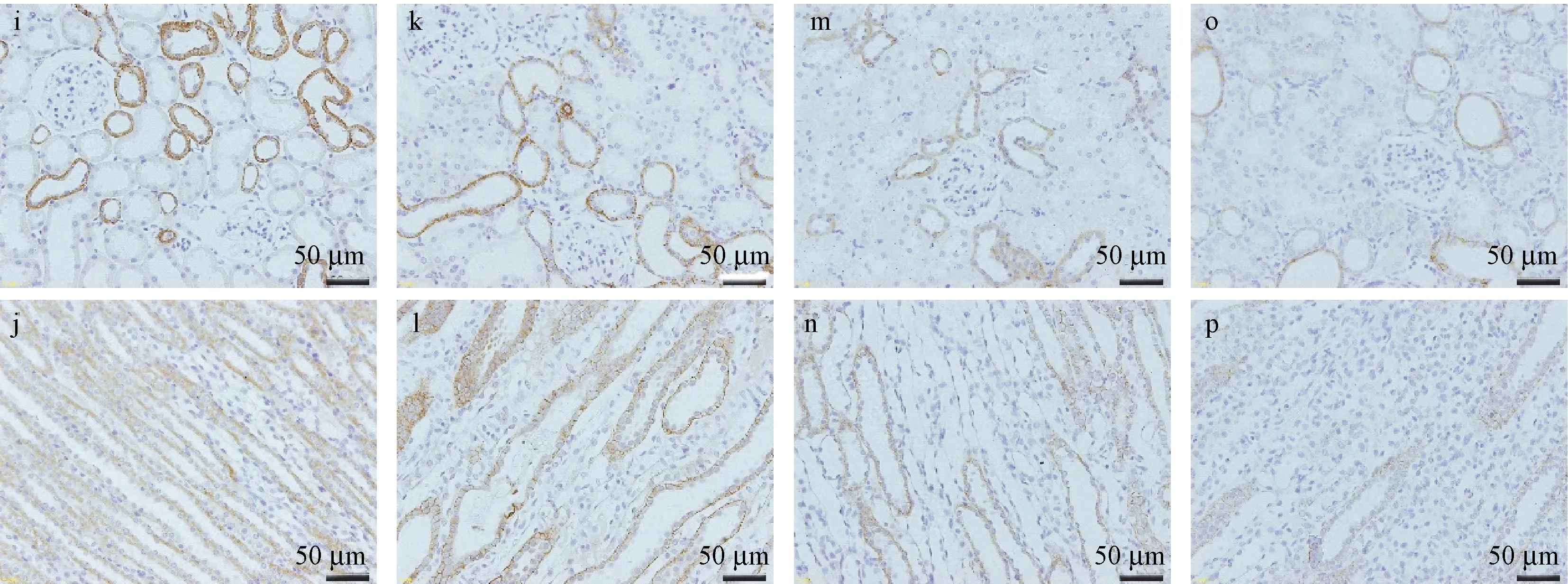
图6 各组大鼠免疫组化E-Cadherin蛋白阳性表达Figure6 Immunohistochemical positive expression of E-Cadherin protein in each group

图7 各组大鼠免疫组化α-SMA蛋白阳性表达Figure7 Immunohistochemical positive expression of α-SMA protein in each group
表4 各组大鼠CD68、E-Cadherin、α-SMA阳性面积百分比(±s,%,n=5)Table4 Percentage of CD68,E-Cadherin and α-SMA positive area of rats in each group

表4 各组大鼠CD68、E-Cadherin、α-SMA阳性面积百分比(±s,%,n=5)Table4 Percentage of CD68,E-Cadherin and α-SMA positive area of rats in each group
注:与Control组比较,∗P<0.05,∗∗P<0.01。Note.Compared with the control group,∗P<0.05,∗∗P<0.01.
组别Groups CD68 E-Cadherin α-SMA正常组Control group 3.30±0.73 7.50±0.87 1.22±0.34模型A组M-A group 6.41±0.84∗∗ 6.99±0.99 1.94±0.64∗模型B组M-B group 11.16±1.28∗∗ 4.44±0.86∗∗ 6.95±1.79∗∗模型C组M-C group 12.17±1.79∗∗ 2.06±0.86∗∗ 9.95±2.09∗∗
3 讨论
目前常用于高尿酸造模的方法有抑制尿酸酶活性如氧嗪酸类药物及Uox基因敲除两种,尿酸的前体物质腺嘌呤法和次黄嘌呤法,增加黄嘌呤氧化酶活性的酵母法以及经过体内嘌呤代谢尿酸法。单纯应用氧嗪酸钾很难诱导大鼠出现UAN,加大氧嗪酸钾剂量又会存在增加动物死亡率的风险[9];腺嘌呤虽然可以引起血尿酸、血肌酐的升高,其代谢产物2,8-二羟基腺嘌呤可直接沉积于肾小管,损伤肾,与尿酸所引起的肾损伤并不一致[10-11];酵母虽可干扰体内尿酸代谢,升高血尿酸,但是酵母溶液灌胃会引起动物饱腹感,且过多的灌胃次数无疑增加劳动成本,虽然有研究者将其混于饲料中饲喂,但是容易造成饲料浪费,且难准确掌握造模所用药物剂量,随着造模后期大鼠的状态不佳,食量明显减少,血尿酸升高程度不稳[12]。然而,以上方法皆有需完善之处。使用氧嗪酸钾联合不同尿酸浓度的方法灌胃,不仅可以抑制尿酸在大鼠体内分解代谢,而且通过直接摄入尿酸,在大幅度提升sUA水平的同时,肾损伤成模期限缩短,此外,尿酸该UAN模型中致肾损伤的唯一因素,且较于腺嘌呤法,该方式所致肾损伤程度更轻[6]。该种造模方式所引起的病变过程以及肾损伤程度均接近于人类
UAN[13]。既往文献报道,大部分研究者选取氧嗪酸钾与尿酸混合成饲料或者氧嗪酸钾饲料饲喂联合尿酸灌胃,但饲喂方法易使大鼠产生饱腹感,食欲受限,造成不稳定的模型,不利于探究后续的药物干预实验[14]。国内研究人员尝试以不同剂量的氧嗪酸钾和尿酸制成的悬液形式对小鼠进行灌胃,1周后观察到sUA显着增加且无肾损伤。我国也有不同剂量的氧嗪酸钾和尿酸混悬液灌胃的方法,1周后小鼠sUA明显升高,但未观察到肾组织明显损伤[15]。通过灌胃该方式可控性较强,因此,我们决定选用氧嗪酸钾与不同剂量尿酸混合给予实验大鼠灌胃方式造模,保证造模药物精确摄入,同时使灌胃次数减少。
本研究结果显示,与正常组相比(163.20±24.55),氧嗪酸钾联合低剂量、中剂量尿酸(121.20±22.82、116.20±17.63)造模前后体重差值明显降低,考虑在造模药物刺激下,大鼠食欲受限,而氧嗪酸钾联合高剂量尿酸(145.20±31.49)组差异不明显,考虑组内差异较大。灌胃4周后,氧嗪酸钾(750mg/kg)联合低剂量(150mg/kg)、中剂量(300 mg/kg)及高剂量(600mg/kg)尿酸组大鼠较于正常组sUA水平明显升高约6倍,但是各模型组间的sUA水平在并未存在尿酸剂量依赖性。BUN和sCr作为常用评估肾功能的生化指标,常用来评估肾功能情况,在造模4周后,氧嗪酸钾联合中剂量、高剂量尿酸组较正常组sCr水平分别升高约1.5倍、1.7倍。在此研究中所采用的UAN大鼠模型相比于腺嘌呤诱导UAN模型的方法,肾功能不全程度相对更轻[11,16]。造模4周后,各模型组BUN水平对比于正常组,升高不显著,考虑各组肾功能不全程度可能与此有关。有研究显示BUN可被肾小管重吸收,只有当肾小球滤过率降低在60%以上时,BUN才会大幅升高,且对于肾功能判断,sCr敏感程度高于BUN[17]。此外,我们发现UAN大鼠的血脂也有所改变通过我们的观察显示,氧嗪酸钾联合低剂量未出现TG明显变化,当出现肾功能减退时,氧嗪酸钾联合中剂量和高剂量尿酸反而降低了血清TG水平,其中氧嗪酸钾联合中剂量尿酸TG降低更为显著,而氧嗪酸钾联合中剂量尿酸组的血尿酸水平也高于高剂量尿酸组,说明尿酸本身对大鼠甘油三酯代谢存在影响,目前具体机制并尚不明确。既往临床报道HUA或UAN患者易伴发高TG血症[18-19],而我们的研究与之相反。与其他UAN造模方法相比较,考虑可能与造模药物中所选用的尿酸相关,因为尿酸可不通过肝的嘌呤代谢,从而直接导致sUA水平上升。
此外,我们构建的UAN大鼠肾病变部位主要集中在肾小管间质,肾组织病理HE染色显示,与正常组相比,氧嗪酸钾联合低剂量尿酸组中仅出现部分肾小管扩张,未见萎缩及炎症浸润,而氧嗪酸钾联合中剂量、高剂量尿酸组可见明显的肾小管扩张以及萎缩的肾小管上皮细胞、脱落的刷状缘和细胞核数量大幅降低,肾间质区分布着大量的炎性细胞。此外,经由Masson染色结果发现,氧嗪酸钾联合中剂量、高剂量尿酸蓝色胶原纤维所占比例明显增加。CD68作为炎症蛋白,我们研究结果显示氧嗪酸钾联合低剂量、中剂量、高剂量尿酸组的大鼠肾CD68表达量均有所增加,这与以往报道结果相似,尿酸可以激活肾组织和肾小管上皮细胞中NLRP3炎性小体的活化和凋亡[20],致因可能为尿酸对肾小管上皮细胞刺激所致。另外肾小管间质区被大量炎性细胞浸侵,尤其是巨噬细胞,而尿酸可激活巨噬细胞中LR4/MyD88/NFκB通路,同时多种炎症细胞因子被释放,如IL-1β、TNF-α、MCP-1等[21]。此外,,而肾小管EMT作为肾小管间质纤维化的早期标志,在肾小管间质纤维化发生之前可存在,而肾小管间质纤维化则是慢性肾病的主要特性之一。研究显示,尿酸诱导大鼠肾小管上皮细胞中α-SMA以及波形蛋白表达的增加而降低E-Cadherin的表达,说明了EMT的发生[22],而尿酸盐性肾病也能刺激TGF-β的产生和激活NLRP3炎性小体从而调节肾炎症和纤维化[23]。鉴此我们检测了E-Cadherin和α-SMA在该UAN模型大鼠肾中的表达变化,氧嗪酸钾联合中剂量、高剂量尿酸组的大鼠肾E-Cadherin表达量较正常组明显降低,而α-SMA达量均有所增加,说明氧嗪酸钾联合中剂量、高剂量尿酸组的大鼠都有不同程度的损伤。在尿酸刺激下,肾小管细胞可产生分泌促纤维化前体物质,如NF-κB通路被尿酸激活后,能够促进肾小管上皮细胞赖氨酰氧化酶、细胞间黏附分子1和血管细胞粘附分子1的表达,导致细胞外基质合成提高,由此引发间质纤维化[24]。
氧嗪酸钾(750mg/kg)联合低剂量(150mg/kg)、中剂量(300mg/kg)、高剂量(600mg/kg)尿酸在干预大鼠4周后,皆会导致大鼠sUA水平大幅度上调,其中氧嗪酸钾联合低剂量尿酸即出现轻微的炎症变化,但氧嗪酸钾联合中剂量、高剂量尿酸炎症变化较为明显,且只有氧嗪酸钾联合中剂量、高剂量尿酸才有显著的EMT改变和肾间质纤维化改变。综上所述,大鼠肾功能异常和肾病理损伤的情况均只出现在氧嗪酸钾联合中、高剂量尿酸组,而且,在造模4周的期限中,中、高剂量模型组中肾损伤程度差异尚不明显,由此,我们认为氧嗪酸钾(750mg/kg)联合中剂量尿酸(300mg/kg)连续灌胃诱导大鼠4周可作为构建UAN大鼠模型较为理想的方法。
