长链非编码RNA TUG1调控miR-137参与局灶性脑缺血大鼠神经损伤的作用机制
2022-03-25周赤忠
陈 俊,周赤忠,张 玲,乔 木∗
(1.武汉市普仁医院,武汉 430081;2.武汉科技大学医学院,武汉 430081)
缺血性脑卒中发生率占脑卒中发生率的60%~80%,脑供血不足和氧气缺乏均导致脑损伤[1]。脑供血不足、氧缺乏等造成脑功能受到影响、神经功能缺损等,具有高致残率、致死率、复发率,已成为脑卒中死亡的主要原因之一[2]。长链非编码RNA(long non-coding RNA,lncRNA)参与缺血性脑卒中神经元抗凋亡、抗炎等过程,为脑卒中的靶标治疗提供依据[3]。牛磺酸上调基因1(taurine upregulated gene1,TUG1)是神经系统发育的重要调控因子,在氯胺酮诱导的神经元毒性中,干扰TUG1可降低海马神经元凋亡和活性氧水平、并增加神经元存活能力,从而降低氯胺酮的神经毒性作用[4],但具体机制尚不清楚。微小RNA(microRNA,miRNA)作为重要的调节剂,miR-137充当神经元分化miRNA,在神经功能中发挥重要作用[5];在缺血性脑卒中中表达降低影响神经元凋亡[6],但与TUG1之间关系尚未发现研究。因此,Longa线栓法建立局灶性脑缺血大鼠模型,干扰TUG1探究其对神经元损伤的影响,初步探讨TUG1影响缺血性脑卒中的作用机制。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
80只健康SD大鼠(北京维通利华实验动物有限公司[SCXK(京)2017-0006]),SPF级、7~9周龄、雄性,体重(280±30)g。大鼠在温度22℃、湿度50%左右条件下饲养。实验动物在武汉华联科生物技术有限公司[SYXK(鄂)2018-0104]单独隔离暂养1周进行实验。动物实验研究经武汉市普仁医院伦理委员会审批(2019L014),遵循3R原则。
1.1.2 细胞
大鼠海马神经元购自基础医学研究所基础医学细胞中心。
1.2 主要试剂与仪器
TUG1-MUT、TUG1-WT、miR-137mimic、miR-137NC、si-NC、si-TUG1、anti-miR-NC、anti-miR-137均购自广州锐博生物科技有限公司;双荧光素酶报告基因检测试剂盒、蛋白酪氨酸激酶1(januskinase 1,JAK1)、信号转导子和转录激活子1(Signal transducer and activator of transcription1,STAT1)、B淋巴细胞瘤-2基因(B-cell lymphoma-2,BCL2)、BCL2相关X蛋白(BCL2associated X protein,BAX)、半胱氨酸天冬氨酸蛋白酶3(Cystein-asparate protease3,caspase3)均购自英国abcam公司;2,3,5-氯化三苯基四氮唑(2,3,5-Triphenyltetrazolium chloride,TTC)染 色 试 剂 盒、苏 木 精-伊 红(hematoxylin-eosin,HE)染色试剂盒、尼氏染色试剂盒均购自北京索莱宝科技有限公司。7500实时荧光定量PCR(real-time fluorescence quantitative PCR,RT-qPCR)仪购自美国ABI公司。
1.3 实验方法
1.3.1 双荧光素酶验证miR-137与TUG1的靶向关系
Starbase分析发现:miR-137与TUG1存在结合位点;将miR-137与TUG1结合处位点序列、结合处突变位点序列分别克隆重组至pGL3-basic荧光素酶报告载体上,构建TUG1野生型(TUG1-WT)及突变型(TUG1-MUT),分别与miR-137mimic或miR-137NC共转染至海马神经元中,检测各组荧光素酶相对活性。
1.3.2 实验分组及处理
参考文献[7]采用Longa线栓法建立局灶性脑缺血大鼠模型,腹腔注射2.5%戊巴比妥钠麻醉大鼠,大鼠仰卧固定在鼠板上,消毒颈部、备皮后纵向切开皮肤,暴露出颈外动脉(external carotid artery,ECA)、左侧颈总动脉(common carotidartery,CCA),近心端缝合线结扎,动脉夹夹闭颈内动脉(internal carotidartery,ICA),距CCA分叉部4mm处剪一小口后,插一根直径为0.24mm拴线,插向ICA,拴线尾端逐层缝合,2h后拔出栓线。Longa分级法对大鼠进行神经功能缺损评分,1~3分为制备成功的模型[8],成功60只,将其随机分为模型组(model group)、si-NC组(si-NC group)、si-TUG1组(si-TUG1 group)、si-TUG1+anti-miR-NC组(si-TUG1+anti-miRNC group)、si-TUG1+anti-miR-137组(si-TUG1+antimiR-137group),每组12只。另12只大鼠假手术组(sham operation group),仅分离CCA、ECA、ICA。
si-NC组、si-TUG1组、si-TUG1+anti-miR-NC组、si-TUG1+anti-miR-137组各组分别在Bregma后3 mm、中线旁开2.2mm、深度2.5mm注射10μL si-NC、10μL si-TUG1、si-TUG1和anti-miR-NC各10 μL、si-TUG1和anti-miR-137各10μL,假手术组和模型组相同部位注射10μL生理盐水。5d1次,第16天检测下列指标。
1.3.3 样本采集与处理
每组随机选6只大鼠取全脑,TTC染色检测脑梗死情况;剩余6只取脑组织中海马区,部分4%多聚甲醛中固定,剩余-80℃冰箱保存。
1.3.4 RT-qPCR检测海马区TUG1、miR-137水平情况
-80℃冰箱组织,TRIzol法提取总RNA,逆转录成第一链cDNA。设计上下游引物序列,TUG1(F:5’-TACGTCCCGTGCCTCCTGAT-3’、R:5’-AGGGCT GTGCTGAATCTGGG-3’),miR-137(F:5’-GCGCGC TTATTGCTTAAGAATAC-3’、R:5’-GTGCAGGGTCC GAGGT-3’)。反应体系:2×Mix10μL,cDNA1μL,F/R(均为10μmol/L)各0.5μL,补ddH2O至20 μL。反应条件:94℃、60s;95℃、30s,(TUG1:59℃、40s,miR-137:59℃、35s),45个循环。2-ΔΔCt法计算TUG1、miR-137相对表达水平。
1.3.5 TTC染色检测脑梗死情况
全脑置于-20℃冰箱冰冻15min后冠状位切片,每个脑组织切片5片,脑片置于2% TTC中37℃恒温水浴锅中避光孵育30min,弃去TTC,置于4%多聚甲醛中4℃固定24h,拍照后用Image pro软件进行分析处理,计算脑梗死体积。脑梗死体积=全脑梗死体积/全脑体积×100%。
1.3.6 HE染色观察海马神经元形态
多聚甲醛中固定的海马组织切片(厚度:6 μm),苏木精染色、乙醇盐酸分色、伊红复染,显微镜下观察海马区神经元形态。
1.3.7 尼氏染色观察神经元形态
1.3.6中切片,二甲苯及梯度乙醇脱蜡、入预热56℃的1%甲苯胺蓝染色60min,经蒸馏水漂洗、95%乙醇分化、脱色数秒,显微镜下观察神经元形态。
1.3.8 蛋白质免疫印迹(Western blot)实验检测海马区JAK1、STAT1、BCL2、BAX、caspase3蛋白水平
-80℃取海马组织后提取总蛋白。分离蛋白、转膜后,5%脱脂奶粉室温封闭2h;对应加入一抗JAK1、STAT1、BCL2、BAX、caspase3、GAPDH,4℃孵育过夜;加入二抗,室温孵育2h;凝胶成像分析系统拍照后定量分析。
1.4 统计学方法
2 结果
2.1 双荧光素酶鉴定miR-137与TUG1的靶向关系
miR-137与TUG1存在互补的结合位点,如图1A。与miR-137NC+TUG1WT相比,miR-137mimic+TUG1WT荧光素酶相对活性下降(P<0.05)。见图1B。
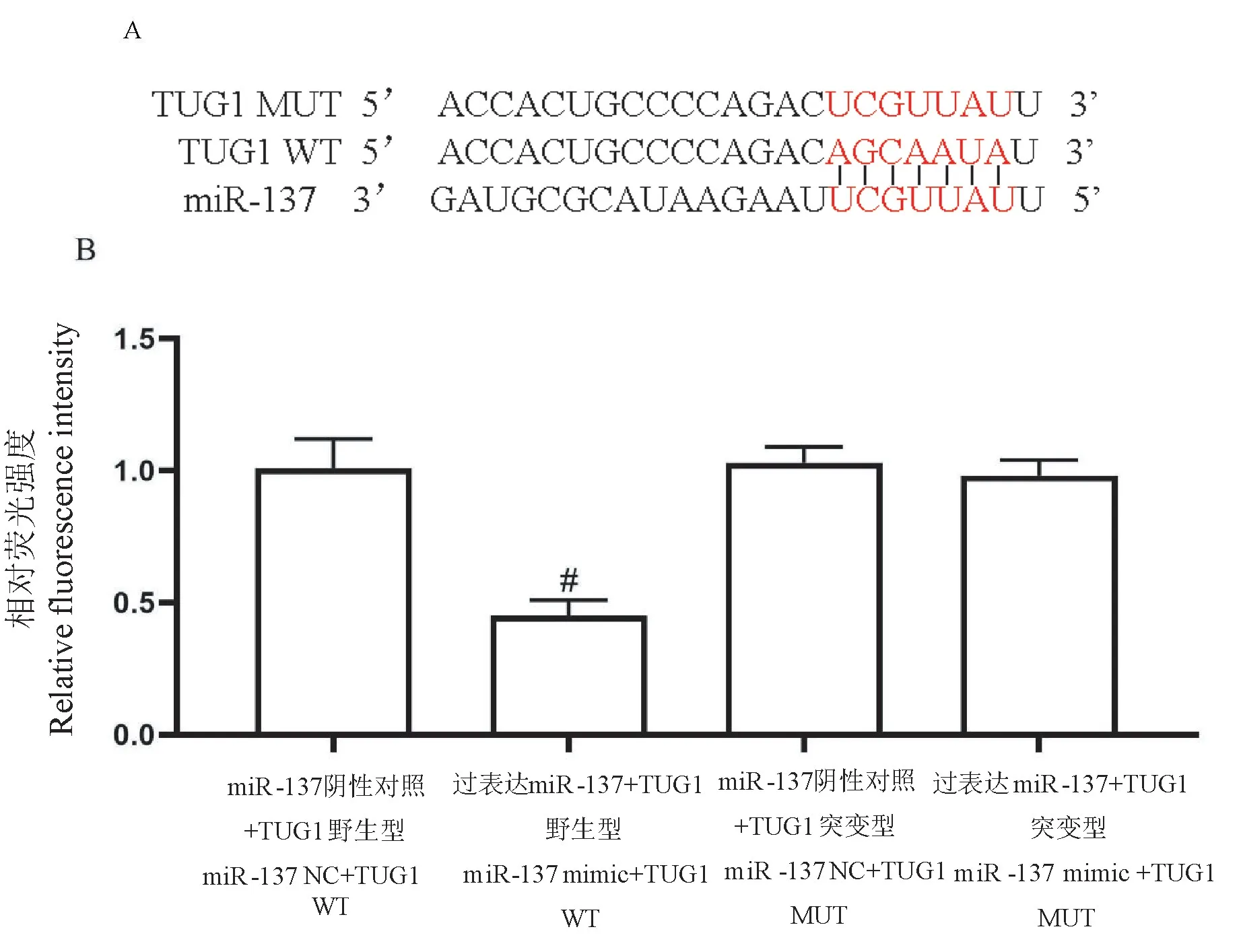
图1 双荧光素酶鉴定miR-137与TUG1的靶向关系(±s,n=6)Figure1 Dual luciferase identification of the targeting relationship between miR-137and TUG1
2.2 各组海马区TUG1、miR-137水平
与假手术组相比,模型组、si-NC组、si-TUG1+anti-miR-137组海马区TUG1水平升高(P<0.05),miR-137水平降低(P<0.05);分别与模型组、si-NC组相比,si-TUG1组、si-TUG1+anti-miR-NC组海马区TUG1水平降低(P<0.05),miR-137水平升高(P<0.05),si-TUG1+anti-miR-137组海马区TUG1水平降低(P<0.05);分别与si-TUG1组、si-TUG1+antimiR-NC组相比,si-TUG1+anti-miR-137组海马区TUG1水平升高(P<0.05),miR-137水平降低(P<0.05)。见图2A、2B。

图2 海马区TUG1、miR-137 水平(±s,n=6)Figure 2 TUG1 and miR-137 level in the hippocampus
2.3 各组脑梗死情况
与假手术组相比,模型组、si-NC组、si-TUG1组、si-TUG1+anti-miR-NC组si-TUG1+anti-miR-137组脑梗死体积升高(P<0.05);分别与模型组、si-NC组相比,si-TUG1组、si-TUG1+anti-miR-NC组脑梗死体积下降(P<0.05);分别与si-TUG1组、si-TUG1+anti-miR-NC组相比,si-TUG1+anti-miR-137组脑梗死体积升高(P<0.05)。见图3A、3B。
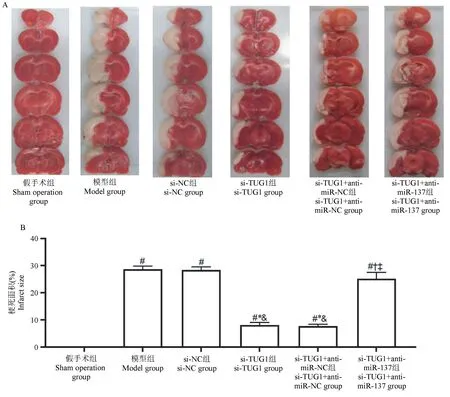
图3 大鼠脑梗死体积(±s,n=6)Figure 3 Volume of cerebral infarction in rats
2.4 各组海马区神经元HE染色情况
假手术组神经元未见异常,排列整齐、层次清晰,核膜、核仁清晰可见;模型组、si-NC组层次紊乱,神经元数量减少、间隙变大、部分出现神经元胞核固缩或溶解、核仁消失等现象;si-TUG1组、si-TUG1+anti-miR-NC组神经元数量有所增加、神经元形态有所恢复;si-TUG1+anti-miR-137组相较于si-TUG1组、si-TUG1+anti-miR-NC组神经元间隙变大、数量减少。见图4。

图4 大鼠海马区神经元形态(HE 染色)Figure 4 Neuron morphology in the hippocampus of rats (HE staining)
2.5 各组海马区神经元尼氏染色情况
假手术组神经元排列整齐且致密、神经元内尼氏体充盈;模型组、si-NC组神经元排列紊乱、间隙大,核膜、核仁模糊不清,尼氏体数量减少;si-TUG1组、si-TUG1+anti-miR-NC组神经元形态有所恢复,尼氏体数量增多;si-TUG1+anti-miR-137组相较于si-TUG1组、si-TUG1+anti-miR-NC组神经元形态破坏严重。见图5。
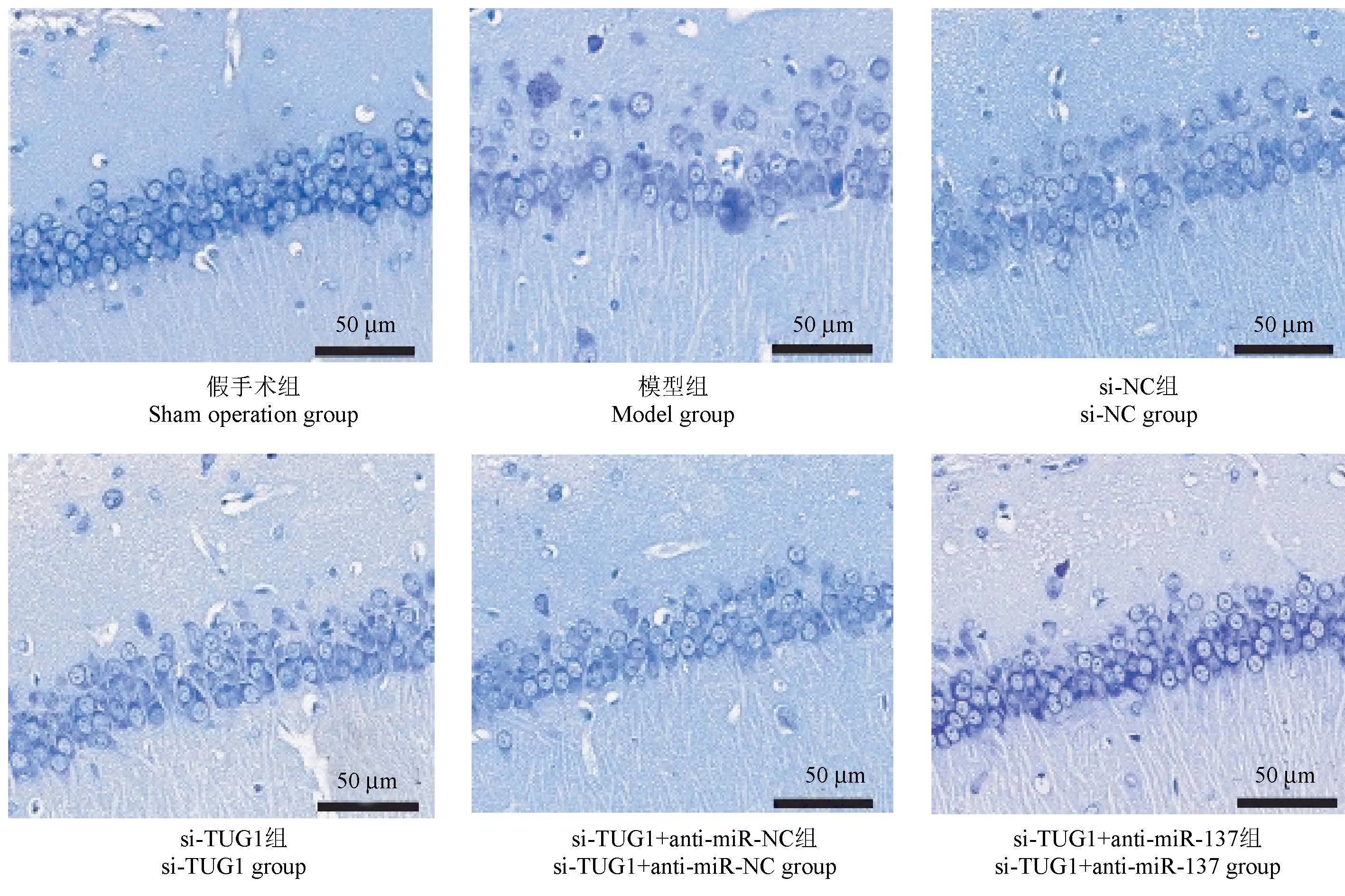
图5 大鼠海马区神经元形态(尼氏染色)Figure 5 Neuronal morphology in the hippocampus of rats (Nissl staining)
2.6 各组海马区JAK1、STAT1、BCL2、BAX、caspase3蛋白表达情况
与假手术组相比,模型组、si-NC组、si-TUG1+anti-miR-137组海马区BCL2蛋白水平降低,JAK1、STAT1、BAX、caspase3蛋白水平升高(P<0.05),si-TUG1组、si-TUG1+anti-miR-NC组海马区JAK1、STAT1、caspase3蛋白水平升高(P<0.05);分别与模型组、si-NC组相比,si-TUG1组、si-TUG1+anti-miRNC组海马区BCL2蛋白水平升高,JAK1、STAT1、BAX、caspase3蛋白水平降低(P<0.05),si-TUG1+anti-miR-137 组海马区JAK1、STAT1、caspase3 蛋白水平降低(P<0.05);分别与si-TUG1 组、si-TUG1+anti-miR-NC 组相比,si-TUG1+anti-miR-137 组海马区BCL2 蛋 白 水 平 降 低, JAK1、 STAT1、 BAX、caspase3 蛋白水平升高(P<0.05)。 见图6A、6B、6C、6D。
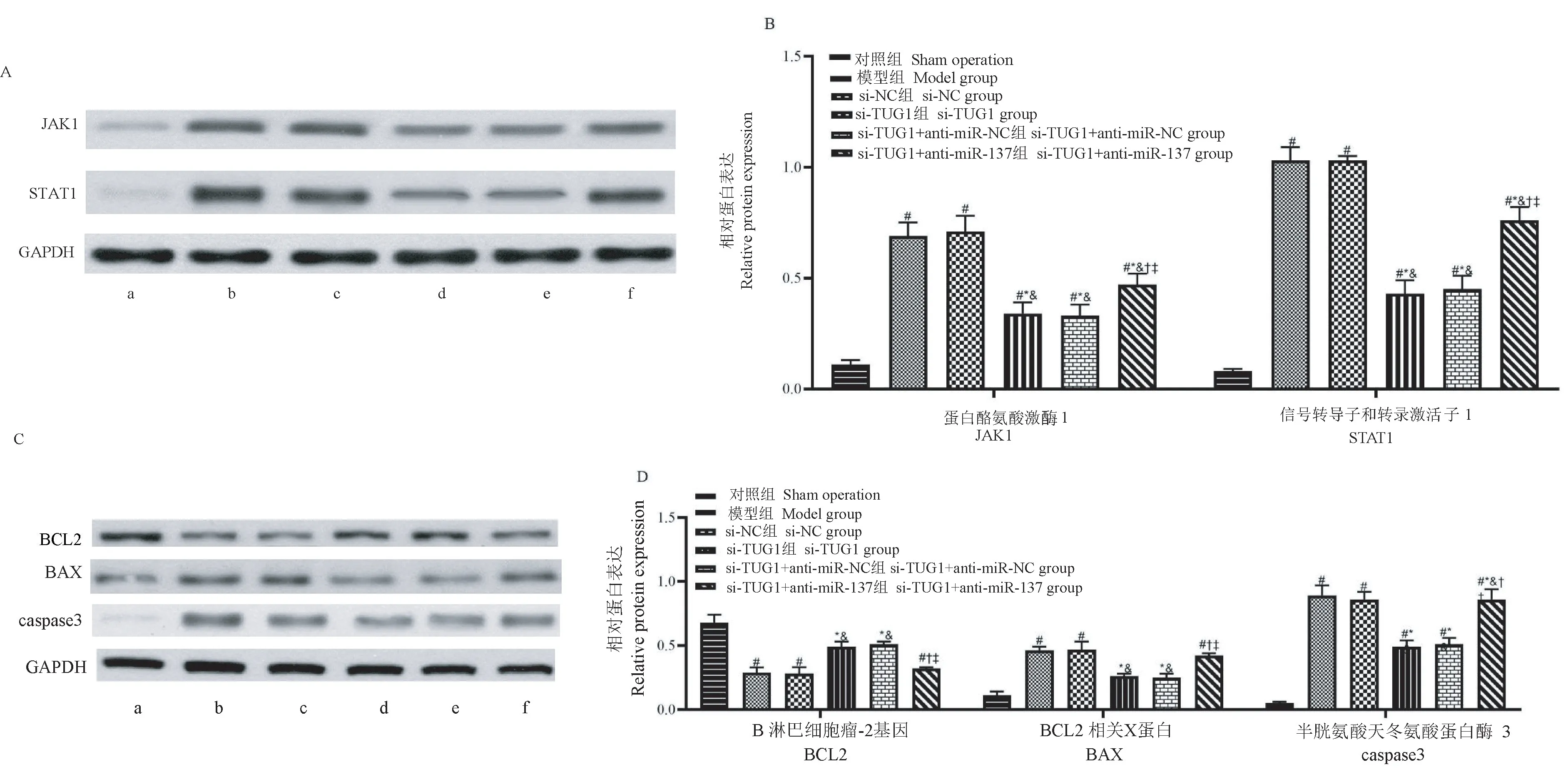
图6 海马区JAK1、STAT1、BCL2、BAX、caspase3 蛋白表达情况(±s,n=6)Figure 6 JAK1, STAT1, BCL2, BAX and caspase3 protein expression in hippocampus
3 讨论
缺血性脑卒中中脑组织血液动力学、能量代谢、离子均发生变化,导致细胞毒素积累,导致炎症反应、细胞凋亡等,导致多种神经功能损伤,出现后遗症包括语言障碍、肢体偏瘫、认知功能障碍等,好发于中老年人,在青年人中发病呈上升趋势[9-10]。本研究Longa 线栓法建立局灶性脑缺血大鼠模型,TTC 染色发现,脑组织脑梗死体积升高;HE 染色、尼氏染色检测大鼠海马区神经元发现,海马区神经元排列紊乱、神经元数量减少、间隙变大、部分出现神经元胞核固缩或溶解、核仁消失明显,提示局灶性脑缺血后大鼠海马区神经元损伤明显。
缺血性脑卒中为医学上研究热点,但目前尚无特效药物治疗[11]。 基因层面直到蛋白层面均参与缺血性脑卒中病理生理过程,且大部分基因转录为非编码蛋白RNA,其中LncRNA 为长度超过200 nt的RNA 分子,在脑缺血后卒中发病机制、再灌注损伤等都具有重要作用,有望成为治疗卒中的新靶点和思路[12]。 TUG1 作为首次在小鼠视网膜细胞中发现的LncRNA,在缺血性脑卒中中高表达,可以损伤细胞[13];TUG1 可通过靶向miR-221-3p/SPRED2 轴逆转LPS 诱导的细胞凋亡和巨噬细胞炎症,在细胞凋亡和炎症反应中发挥作用[14];TUG1 过表达促进心肌细胞凋亡并预测心肌梗死的预后不良[15]。 本研究发现,与假手术组相比,模型组海马区TUG1 水平升高,神经元损伤现象明显,提示TUG1 在缺血性脑卒中中表达升高,可能促进神经元损伤从而影响疾病。 且TUG1 与miR-137 存在靶位点,本文干扰TUG1,在干扰TUG1 的基础上抗miR-137,观察抗miR-137 对TUG1 的影响。
miRNA 属于非编码RNA 中小非编码RNA,长度为18~25 nt,广泛存在于真核生物中,通过一系列过程转化为成熟RNA,miRNA 具有高度保守性、时序性、组织特异性,具有作为生物标记物的潜在优势[16]。 miR-137 在缺血性脑卒中表达下调,且BCL2 等作为miR-137 的靶基因,参与卒中后抑郁过程[17]。 BCL2、BAX、caspase3 作为影响细胞凋亡的基因,其中BCL2 作为抑制凋亡基因;BAX 具有促凋亡作用;caspase3 是细胞凋亡的关键执行因子,通过水解天冬氨酸残基C 末端的肽键,激活下游caspase酶或分解细胞内相关底物蛋白,导致BCL2 等抗凋亡蛋白酶解、凋亡蛋白BAX 等细胞外基质和细胞骨架等的修复,促使细胞凋亡[18]。 本研究发现,与假手术组相比,模型组海马区miR-137 水平降低;与模型组相比,si-TUG1 组海马区miR-137 水平升高、脑梗死体积降低、神经元形态有所缓解,提示缺血性脑卒中干扰TUG1 后可以升高miR-137 的表达,缓解神经元状态,实现对疾病的保护。 进一步验证JAK1/STAT1 通路的作用发现,模型组JAK1/STAT1通路蛋白处于激活状态,而miR-137 通过调节JAK1/STAT1 信号通路减轻大鼠局灶性脑缺血损伤[19];线粒体途径细胞凋亡受JAK1/STAT1 信号通路的调控,活化的STAT1 可以调节凋亡途径关键因子BCL2、BAX 的表达[20]。 激活后的STAT1 抑制BCL2 的表达、促进BAX 的表达从而促进神经元凋亡。 干扰TUG1 后JAK1、STAT1 蛋白表达水平降低,提示干扰TUG1 后促进miR-137 的表达从而抑制JAK1/STAT1 通路蛋白活化,使JAK1/STAT1 通路蛋白对BCL2、BAX 的作用降低,神经元凋亡得以缓解。 在si-TUG1 的基础上抑制miR-137 表达可逆转si-TUG1 的效果。
综上所述,干扰TUG1 后可上调miR-137,从而缓解局灶性脑缺血大鼠神经元形态及凋亡,缓解神经损伤。 本研究首次验证TUG1 与miR-137 在神经元中的关系,但LncRNA 与miRNA 之间关系复杂,亦可能通过别的miRNA 发挥作用,是本研究接下来研究重点。
