改良后Hulth法和Ⅱ型胶原酶注射法建立兔膝骨关节炎模型的比较研究
2022-03-25欧宝芳别亚男陈千晴陈柏羽许佳欢谢水林吴少瑜
欧宝芳,别亚男,陈千晴,陈柏羽,许佳欢,谢水林,吴少瑜∗
(1.南方医科大学药学院,广州 510515;2.广东药科大学生命科学与生物制药学院,广州 5114362;3.华南理工大学生物科学与工程学院,广州 510006)
膝骨关节炎(KOA)是一种常见的以关节软骨退变为特征的致残性疾病[1],2000年1月至2019年12月我国40岁及以上人群膝骨关节炎患病率为20.50%[2]。炎症引起的软骨细胞紊乱、细胞外基质分解及关节不稳定是KOA发生的主要诱因[3]。目前大部分治疗方法只能缓解疾病症状,未能修复关节软骨组织,因此建立KOA动物模型对研究其发病机制及治疗方式具有重要意义。
目前常用的KOA造模方法有Hulth法[4]、改良后Hulth法[5]、ACLT[6]、关节腔内注射药物(包括胶原酶[7]、碘乙酸盐[8]、木瓜蛋白酶[9])、关节制动[10]等。KOA造模常用的动物载体有大鼠、小鼠、家兔、豚鼠、犬、猪等[11]。改良后Hulth法和关节腔内注射Ⅱ型胶原酶法两种方法都较为常用,但尚未有研究报道比较两种造模方法之间的差异。本研究旨在分析比较两种造模方法之间的异同点,为不同类型膝骨关节炎动物模型的选择提供参考。
1 材料和方法
1.1 实验动物
清洁级健康成年新西兰雄性大白兔9只,6月龄,体重2.5~2.7kg,由南方医科大学实验动物中心提供[SCXK(粤)2016-0041]。所有新西兰大白兔购入后饲养于广州华腾生物医药科技有限公司[SYXK(粤)2020-0237],分笼独立饲养,动物可自由进食及饮水,环境温度维持在20℃~25℃,湿度维持在40%~60%,模拟自然光照12h/d。动物实验及研究过程遵循3R原则,给予动物人道主义关怀,并得到了广州华腾生物医药科技有限公司实验动物伦理委员会的批准(HTSW201003)。
1.2 主要试剂与仪器
速眠新Ⅱ(敦化市圣达动物药品有限公司,20210301);Ⅱ型胶原酶(美国Sigma公司);EDTA脱钙液(北京索莱宝科技有限公司);苏木素(美国Sigma公司);伊红染液(天津光复精细化工有限公司);番红O-固绿染液(武汉赛维尔生物科技有限公司);兔TNF-α酶联免疫分析试剂盒(CUSABIO,武汉华美生物工程有限公司);兔IL-1β酶联免疫分析试剂盒(H002,南京建成生物工程研究所有限公司)。C型臂X射线仪(GE9900,美国通用电气公司);微计算机断层扫描(Micro-CT80476,荷兰MILabs公司);组织切片机(RM2245,上海徕卡Leica公司);光学显微镜(舜宇光学科技(集团)有限公司)。
1.3 实验方法
1.3.1 兔膝骨关节炎模型分组及构建
9只新西兰大白兔随机均分为以下3组:空白组、改良后Hulth组、Ⅱ型胶原酶组。术后1周开始驱赶各组动物进行运动,每天30min。
改良后Hulth组:采用改良后Hulth法[12]构建兔膝骨关节炎模型。固定家兔后,0.1mL/kg速眠新Ⅱ(生理盐水1∶1稀释)臀部肌肉注射镇静,再3%戊巴比妥钠30mg/kg耳缘静脉麻醉。将兔仰卧位固定在无菌手术台上,备皮消毒铺巾,沿髌韧带内侧做长约3cm纵行切口,逐层切开皮肤、筋膜层和关节囊,将髌骨外翻,将兔右腿屈膝45°后切断内侧副韧带和前交叉韧带,剔除内侧半月板,行抽屉试验确认前交叉韧带完全断裂。用生理盐水清洗关节腔后复位髌骨,可吸收缝线逐层缝合。术后予青霉素臀部肌肉注射预防感染,连续3d,每次80万单位。
Ⅱ型胶原酶组:于实验第1、4天按上述方法麻醉兔后进行备皮消毒,将兔膝关节屈曲45°,于髌韧带内侧凹陷处进针,当出现落空感时,表明已进入关节腔内,注射0.5mL(4mg/mL)Ⅱ型胶原酶溶液(经0.22μm无菌过滤器过滤)。注射结束后用棉球压住注射针眼处并再次屈伸膝关节使Ⅱ型胶原酶溶液充分浸润至整个关节腔内。注射过程严格按照无菌操作要求。
1.3.2 Lequesne MG评分
术后1周开始用国际骨关节炎Lequesne MG指数[13]作为模型评定标准之一,每周进行2次Lequesne MG评分,持续6周。包括疼痛刺激反应程度、步态、关节活动范围和关节肿胀程度4个方面,每部分分为4个等级,Ⅰ级为0分,Ⅱ级为1分,Ⅲ级为2分,Ⅳ级为3分,总分大于等于3分为造模成功。
1.3.3 X-ray
使用C型臂X射线仪(GE9900)对术后6周的各组兔进行影像学评估,透视千伏电压和管电流分别设置为54kVp,1.04mA。兔麻醉后仰卧位放置于手术台上,右膝关节伸直位拍摄正位片,即腓骨小头横径1/3~2/3与胫骨重叠;屈膝30°拍摄膝关节侧位片,即股骨内侧髁与外侧髁重叠,边缘间距小于1.5cm[14]。
1.3.4 Micro-CT
使用Micro-CT对术后6周各组兔的膝关节进行断层扫描,通过重建三维图像来显示骨组织在空间的分布,扫描电压和电流分别设置为100kV和200μA,扫描后进行重建,重建的图像分辨率为16 μm。对兔实行安乐死后,在兔膝关节上下3cm处用锐利器械切断,将股骨髁和胫骨平台取下,4%多聚甲醛内固定48h后拍摄Micro-CT。
1.3.5 兔膝关节大体观察及Pelletier评分
各组兔于术后6周安乐死后,按构模手术入路切开膝关节囊,肉眼大体观察右后膝关节软骨并采用Pelletier评分[15]评估软骨损伤情况:(1)0分:关节面完整,色泽如常;(2)1分:关节面粗糙,有小的裂隙且色泽灰暗;(3)2分:关节面糜烂,软骨缺损深达软骨表中层;(4)3分:关节面溃疡形成,缺损深达软骨深层;(5)4分:软骨剥脱,软骨下骨质暴露。
1.3.6 HE染色观察关节软骨组织形态变化
兔膝关节4%多聚甲醛中固定48h,EDTA脱钙液37℃脱钙3周后,取股骨内髁、股骨外髁、胫骨内髁和胫骨外髁的软骨中央区继续脱钙1周,经脱水,石蜡纵向包埋后切成2μm的切片,并用苏木素和伊红染液进行染色,光学显微镜下观察病变情况。
1.3.7 番红O-固绿染色 及Mankin评分
兔膝关节石蜡切片后经番红O和固绿染液染色,光学显微镜下观察病变情况,并对番红O-固绿染色结果进行Mankin评分[16],包括软骨结构、软骨细胞、基质染色、潮线完整性4个方面。
1.3.8 ELISA检测兔血清炎性因子水平
各组兔于术后6周耳缘静脉采血,收集于促凝管中,4℃静置30min后,3000r/min离心10min收集上清。根据试剂盒说明书检测血清中TNF-α和IL-1β的含量。
1.4 统计学方法
实验数据应用IBM SPSS25.0进行分析。正态或近似正态分布的计量资料使用平均数±标准差(±s)进行统计描述,偏态资料使用中位数(四分位间距)[M(IQR)]进行统计描述。采用单因素方差分析、重复测量方差分析和Kruskal-Wallis H检验进行组间差异分析,采用LSD-t检验、Dunn’s检验进行组间多重比较。结果均以P<0.05为差异有统计学意义。
2 结果
2.1 3组兔膝关节一般情况观察
改良后Hulth法模型组的右侧膝关节内侧伴有骨性突出,质地坚硬;胶原酶模型组右侧膝关节处未发现骨性变化,但伴有肌肉松弛的情况(图1A)。两种造模方法患肢均出现奔跑时轻度跛行,膝关节轻度肿胀,骨性标记变浅,Lequesne MG评分都显著高于空白组(P<0.01),改良后Hulth法模型组评分高于胶原酶模型组(P<0.01)(图1B)。

图1 3组兔膝关节外观形态及Lequesne MG评分结果(n=3)Figure1 Appearance and Lequesne MG score results of the knee joint in three groups
2.2 3组兔膝关节影像学情况观察
X-ray显示改良后Hulth法模型组的膝关节间隙变窄,膝关节内侧有骨赘形成,未见游离体生成;胶原酶模型组X-ray征象则并不明显(图2A)。Micro-CT评估软骨下骨质的微小变化(图2B),Micro-CT平扫显示,相比于空白组,两组模型组均出现软骨下骨硬化,主要表现为骨小梁增粗增多,三维重建结果显示两组模型组均存在骨重建,骨畸形,改良后Hulth法模型组有明显的骨赘增生和骨刺形成。

图2 3组兔膝关节X-ray和Micro-CT结果Figure2 X-ray and Micro-CT results of the knee joint in three groups
2.3 3组兔膝关节软骨大体观察
空白组的软骨表层光滑平整,呈透亮有光泽的蓝白色,无裂纹及缺损。改良后Hulth法模型组显示在软骨的中央区,关节软骨面异常粗糙,软骨表面缺损并伴有骨赘形成,关节腔可见淡黄色积液。胶原酶模型组软骨表面缺损粗糙,无光泽,磨损严重,但未见骨赘生成(图3A)。与空白组相比,两种方法建立的模型组的Pelletier评分显著升高(P<0.05),但两组模型组相比Pelletier评分无统计学差异(P>0.05)(图3B)。

图3 3组兔膝关节软骨大体观察及Pelletier评分结果(n=3)Figure3 General observation and Pelletier score results of knee cartilage in three groups
2.4 3组兔膝关节病理切片观察软骨组织形态
HE染色结果显示,空白组关节软骨表面平整光滑,表面区、移行区、辐射区和矿化区四层结构清晰,排列规律,细胞分布及染色均匀,潮线完整,无血管通过。改良后Hulth法模型组关节软骨表面损毁严重,软骨层脱落,各结构层次紊乱。股骨内外髁裂隙深达辐射区,可见大量软骨细胞克隆,细胞分布及排列不规律,总数减少,潮线扭曲前移并且伴有血管长入。胶原酶模型组软骨表面较平整少裂隙,软骨细胞排列紊乱,数量减少,大量炎性细胞浸润,并伴随大量血管通过(图4)。
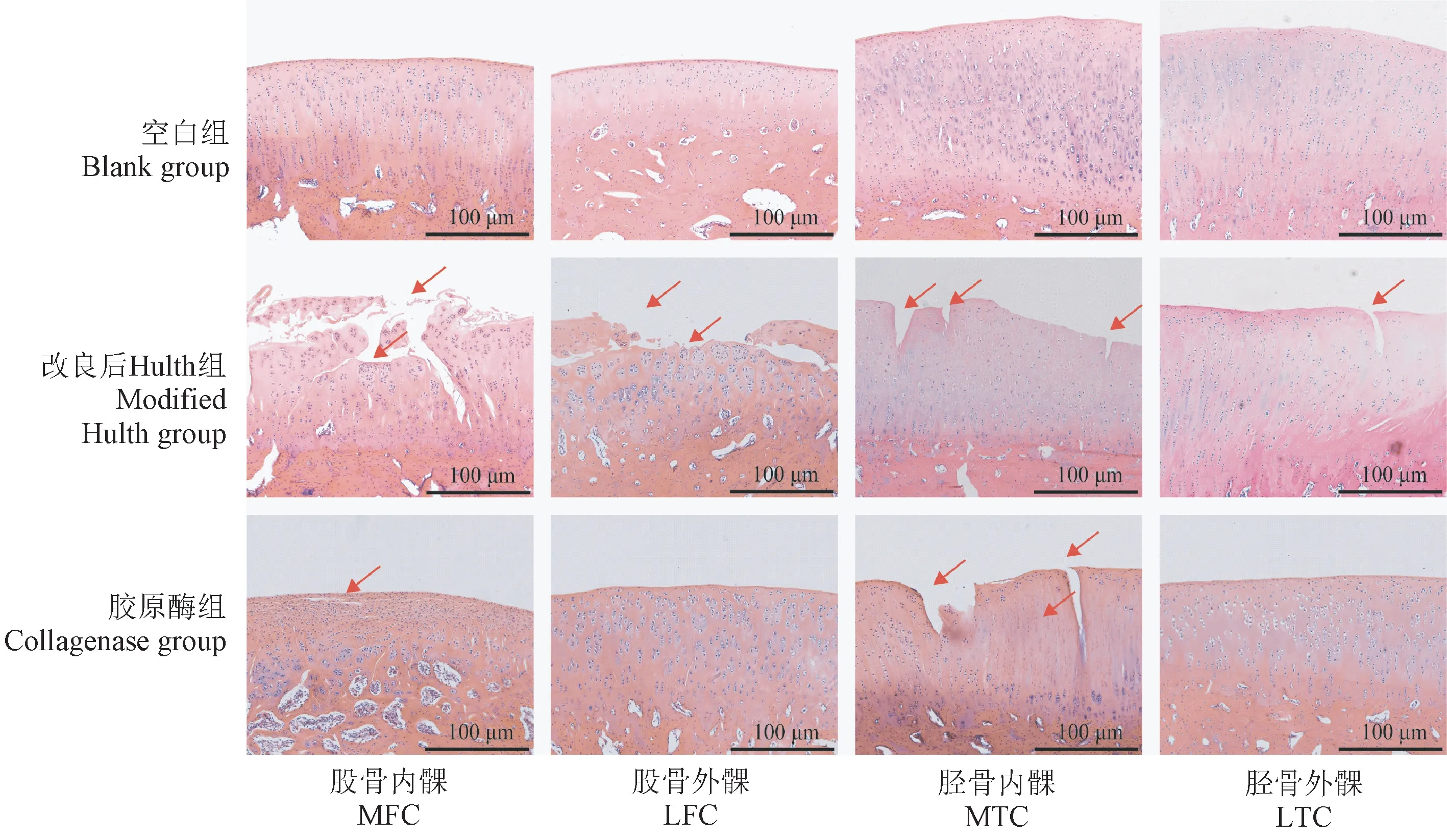
图4 三组兔膝关节软骨HE染色Figure4 HE staining of knee cartilage in three groups
番红O-固绿染色结果与HE染色结果一致,空白组关节软骨基质呈红色,细胞核和胶原纤维呈绿色,潮线清晰规律,软骨和软骨下骨界限清晰,红绿色对比明显。两组模型组软骨基质区均出现番红O染色减退甚至染色丢失,固绿染色明显,局部出现细胞成簇现象(图5)。

图5 三组兔膝关节软骨番红O-固绿染色Figure5 Safranin O-Fast Green staining of knee cartilage in three groups
与空白组相比,两组模型组软骨Mankin评分较高(P<0.01)。改良后Hulth法模型组Mankin评分从胫骨到股骨,外侧到内侧逐渐升高,显示股骨区软骨退变更严重。胶原酶模型组则胫骨区软骨退变更严重(图6)。
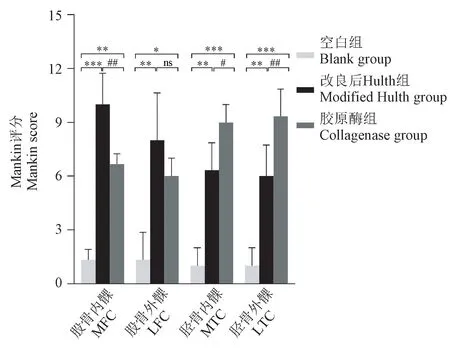
图6 Mankin评分结果(n=3)Figure6 Mankin score results of knee cartilage in three groups
2.5 3组兔血清中TNF-α和IL-1β的表达水平比较
ELISA检测结果显示,两组模型组的TNF-α和IL-1β水平均高于空白组(图7和表1,P<0.05),胶原酶模型组的TNF-α水平高于改良后Hulth法模型组(图7A)。

图7 三组兔血清中TNF-α和IL-1β表达水平结果(n=3)Figure7 Results of TNF-α and IL-1β expression level in serum of three groups of rabbits

表1 三组兔血清中TNF-α和IL-1β的表达水平比较Table1 Comparison of the expression levels of TNF-α and IL-1β in three groups of rabbit serum
3 讨论
疾病动物模型是重大疾病机制研究、新型治疗方式开发、药物筛选与评价不可或缺的支撑条件[17]。理想的疾病动物模型至少需满足与人类疾病相似的3个一致性特征:疾病发病机理同源性、行为表象一致性、药物治疗反应性[18]。目前用作KOA模型的动物载体有大小鼠、兔、猪和非人灵长类动物。其中家兔的关节结构与人类似,关节腔体积较小鼠更大,关节和组织更易提取[19],是早期骨关节炎模型的适宜载体。构建兔KOA模型的方法也多种多样,主要有:(1)手术造模法;(2)自发性骨关节炎模型;(3)关节腔药物诱导法;(4)关节制动法。
改良后的Hulth法[20]是最常用的关节内手术造模法之一,通过将膝关节韧带等维持稳定的组织切断或切除,使关节出现不同程度的稳态失衡,其在传统的Hulth法的基础上进行改良,即切断前交叉韧带、内侧副韧带和切除内侧半月板,减小对动物的损伤,能较好地观察KOA周围组织早中期的病理表现,是KOA研究中最常用到的手术类模型。
关节腔药物诱导法是直接在关节腔内注射能诱导炎症的化合物或药物,造成关节软骨、半月板或韧带的局部损伤。这种KOA模型具有实验周期短、重复性好、创伤性小、便于操作的优点,能避免手术法易造成的感染问题[21]。
本研究成功构建了使用改良后的Hulth法或关节腔注射胶原酶诱导的兔KOA模型,并通过多种实验检测方法比较两种造模方法的异同点。两种造模方法的动物体重在术后均出现降低,1周后体重恢复稳步增长趋势。Pelletier评分主要反映关节软骨表面的退变程度[15],如关节面磨损、缺损的程度。两种造模方法的兔关节软骨均出现一定程度的粗糙和缺损,这与Ge等[22]的结果一致。改良后Hulth法模型组可见膝关节内侧伴有骨性突出,X线及Micro-CT可见明显的骨赘形成。胶原酶组肉眼未见骨性突出,患侧肌肉松弛和萎缩并不在Lequesne MG评分标准内,故其评分稍低于改良后的Hulth组,且胶原酶以诱导软骨退变为主,故X线及Micro-CT未见明显变化。
软骨组织病理学是评价KOA模型是否成功的主要指标[23]。在组织形态学方面多使用光学显微镜进行观察,HE为常规的染色手段,另外还有针对于软骨基质的特殊染色[24]。本研究利用番红O-固绿染色结合Mankin软骨组织形态学评分对关节软骨进行病理学评估,结果显示改良后Hulth法的病理损伤主要在股骨髁部,表现为严重的软骨脱落和软骨基质丢失,其原因应与手术造成的关节内侧联合不稳定有关[25];胶原酶法的病理损伤主要在胫骨平台,主要表现为软骨细胞凋亡和软骨基质丢失,这与关节腔内注射时的进针位点有关[26]。
在KOA发展中,炎性因子参与破坏关节内微环境的稳态[27]。TNF-α是一种多功能炎性因子,是诱导KOA软骨细胞凋亡的主要细胞因子[28],能刺激细胞生成PGE2和IL-1β,引起关节疼痛和抑制软骨蛋白多糖合成[29]。
综上,改良后Hulth法构建的KOA模型主要表现为骨赘生成、股骨髁部软骨脱落和大量软骨细胞克隆形成,软骨损伤程度更为严重;关节腔注射胶原酶诱导的KOA模型主要表现为软骨表面缺损,胫骨平台软骨基质丢失和炎性因子升高,相比于改良后的Hulth法更为简便,创伤性小,更接近人的KOA进程与发病机制,研究者可根据实验的具体要求,采用最合适的造模方法。
