秋水仙碱缓释微丸对痛风性关节炎急性发作的预防作用研究*
2022-03-24韦业娟雷雅然杨国宝丁雅宁王玉丽高春生
韦业娟,吕 白,雷雅然,杨国宝,丁雅宁,王玉丽△,高春生,焦 杨
(1.广西医科大学药学院,南宁 530000;2.军事科学院军事医学研究院毒物药物研究所,北京 100850;3.齐齐哈尔医学院药学院,齐齐哈尔 161006;4.沈阳药科大学制药工程学院,沈阳 117004)
痛风是一种由骨关节、肾脏、皮下和其他各种组织中单钠尿酸盐(MSU)晶体沉淀引起的急性或慢性炎症和组织损伤的疾病[1]。我国痛风发病率为1%~3%,呈逐年上升的趋势,且男性发病率比女性高约38%[2]。痛风的反复发作会造成痛风石沉积和痛风肾病。
秋水仙碱,又名秋水仙素,是从百合科植物丽江山慈菇球茎中提取的一种三环类生物碱。作为治疗和预防急性痛风的经典药物,秋水仙碱通过抑制中性粒细胞的聚集、黏附和吞噬作用,减少单核细胞和中性粒细胞释放前列腺素和白三烯发挥抗炎镇痛作用[3]。《中国高尿酸血症与痛风诊疗指南(2019)》指出,使用小剂量(0.5~1.0 mg/d)秋水仙碱3~6个月可预防痛风发作[4-5]。虽然秋水仙碱在常规剂量下耐受性良好,但其治疗窗很窄,有效剂量和中毒剂量十分接近。据报道,临床上单次剂量低至7 mg 即可致死[6]。秋水仙碱毒性较大,往往产生一定的副作用,临床最常见的不良反应有恶心、呕吐、食欲减退、腹泻、体重下降等。因此,如何提高疗效、减少不良反应成为秋水仙碱使用的主要问题[7]。然而,秋水仙碱在国内上市的剂型仅为片剂,在FDA 批准上市的剂型中除片剂和口服液体制剂也未见其他。
相较于普通片剂,缓释微丸作为一种多单位制剂具有许多显著优势,其体积小,与胃肠道的接触面积增加,受食物节律的影响减小,单位制剂的缺陷不会影响药效的发挥[8-10]。因此,本研究采用流化床包衣法制备了秋水仙碱缓释微丸,考察其对尿酸钠诱导的大鼠痛风性关节炎急性发作的预防效果,为秋水仙碱缓释制剂的研发提供参考。
1 材料与方法
1.1 实验动物 SD 雄性大鼠,SPF 级,体重(300±20)g,购自北京斯贝福生物技术有限公司,动物许可证号:SCXK(京)2019-0010。所有大鼠自由摄食、饮水,适应性喂养1周后进行实验。
1.2 药物和主要试剂 秋水仙碱(HPLC 测定纯度98%以上,山西玉宁生物科技有限公司);秋水仙碱片(西双版纳版纳药业有限责任公司);空白丸芯(杭州高成生物营养技术有限公司)。白细胞介素(IL)-1β酶联免疫吸附试验(ELISA)检测试剂盒(杭州联科生物技术股份有限公司);肿瘤坏死因子(TNF)-α ELISA 试剂盒(北京索莱宝科技有限公司);谷丙转氨酶(ALT)、谷草转氨酶(AST)、肌酐(Cr)测定试剂盒(南京建成生物工程研究所);尿酸钠(北京英华锦程生物科技有限公司);聚乙烯吡咯烷酮(PVP)(美国ISP Technologies 公司);乙基纤维素(EC,上海卡乐康包衣技术有限公司);羟丙基纤维素(HPC,美国亚什兰公司)。
1.3 秋水仙碱缓释微丸的制备 将30 g PVP-K30溶于500 g 蒸馏水中,60 ℃水浴下搅拌至全部溶解后加入6 g秋水仙碱原料药,继续搅拌至全部溶解,即得含药包衣液。在流化床中将上药液底喷于1 000 g空白微丸,干燥5 min后过筛称重,得到载药微丸。称取50 g HPC 缓慢加入2 000 mL 95%乙醇中,60 ℃水浴持续搅拌至其全部溶解后,缓慢加入175 g EC,继续搅拌至全部溶解,即得缓释包衣液。在流化床中将缓释包衣液底喷于500 g 载药微丸,干燥20 min后过筛称重,得到缓释微丸。
1.4 微观形态学观察 取少量缓释微丸,将部分微丸进行球心纵切得到横截面,为待观察样品。将待观察样品于真空中进行喷雾镀金,然后在15 keV的加速电压下进行电镜扫描观察。
1.5 体外溶出试验 按照《中华人民共和国药典》2020版四部,通则0931第二法(浆法),以500 mL水作为溶出介质,温度(37.0±0.5)℃,转速75 r/min,依法操作。每隔一定时间自动取样5 mL(同时补加等体积等温度的溶出介质)经0.45 μm 的微孔滤膜过滤,取续滤液于高效液相色谱仪中检测峰面积[色谱柱:Waters Symmetry®C8(4.6 mm×250 mm,5 μm);流动相:甲醇—水(47∶53,V/V);流速:1.0 mL/min;检测波长:254 nm;柱温:25 ℃;进样量:20 μL],并计算各时间点的累积释放百分率。
1.6 实验分组、给药及痛风性关节炎模型的建立 将24 只大鼠随机分为4 组(n=6),分别为正常组、模型组、片剂组、缓释微丸组。片剂组将秋水仙碱片研磨成粉,水溶后灌胃给药,缓释微丸组为保证微丸的完整性,通过特制的灌胃器灌胃给药,给药剂量均为1.2 mg/(kg.d);正常组和模型组灌胃等量的生理盐水,1次/d,连续灌胃14 d。第14天给药1 h 后,正常组大鼠右后踝关节腔注射0.2 mL 生理盐水,其余各组大鼠同部位注射0.2 mL 尿酸钠(25 mg/mL)混悬液,建立痛风性关节炎急性发作模型[11],注射尿酸钠后观察到大鼠关节囊对侧鼓起,则可判断造模成功[12]。
1.7 关节肿胀度测定 分别于造模前及造模后6 h、12 h、24 h、48 h,将大鼠固定,使用无弹性棉线,用记号笔标记测量起始点,用棉线绕大鼠造模踝关节1 周,以不挤压皮肤为准,标记测量终止点,测量起始点至终止点的长度,即为大鼠关节周长,以测量3 次关节周长的平均值作为最终结果[13]。肿胀度/%=[(造模后关节周长-造模前关节周长)/造模前关节周长]×100%
1.8 血清IL-1β 和TNF-α 含量测定 造模后48 h,大鼠常规麻醉后开腹,取腹主动脉血4 mL,静置30 min后,4℃、3 000 r/min离心10 min,取上清液,采用ELISA 法检测大鼠血清中IL-1β 和TNF-α 含量。检测过程严格按照试剂盒说明书进行检测。
1.9 踝关节炎性病理情况观察 取血后处死大鼠,以其右后踝关节为中心上、下0.5 cm剪断,去皮,固定于4%多聚甲醛溶液48 h。将踝关节放入10%EDTA液中脱钙2周,使用梯度乙醇脱水,二甲苯透明,石蜡包埋,切片(5 μm厚),置于65 ℃烤箱中烘烤1 h,行苏木精—伊红(HE)染色,倒置显微镜下观察踝关节炎性病变[14]。
1.10 不良反应评价(1)实验期间观察并记录各组大鼠的腹泻情况。(2)比较给药前(0 d)、给药14 d后大鼠的摄食量,当日摄食量=前1 d给食量-当日剩余食量;给药前及给药期间每2 d 称1 次大鼠体重,以对用药过程中产生的胃肠道不良反应进行评估。(3)给药14 d后,通过大鼠眼眶静脉丛穿刺采集血样,离心,取血清,检测血清中AST、ALT 和Cr 水平,以评价药物对大鼠肝、肾功能的影响。
1.11 统计学方法 采用SPSS 26.0 统计软件对实验数据进行处理,计量资料以均数±标准差()表示。多组间差异比较采用单因素方差分析,组间两两比较采用LSD-t检验;计数资料以频数或百分率(%)表示,组间比较采用Fisher’s 确切概率法。以P<0.05为差异有统计学意义。
2 结果
2.1 微丸的表观形态 所制缓释微丸表面较光滑,剖面可见完整的包衣膜、载药层及空白丸芯,见图1。

图1 缓释微丸表面及截面扫描电镜图(×200)
2.2 体外溶出结果 体外溶出曲线显示,市售普通片剂中的秋水仙碱成分在15 min 内快速释放且体外累积释放率达到80%以上,而自制缓释微丸中的秋水仙碱成分缓慢释放,在6 h 内的体外累积释放率达到80%以上,见图2。
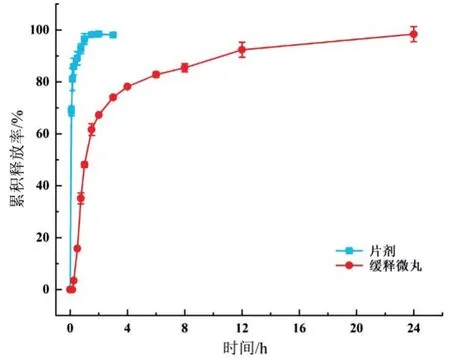
图2 秋水仙碱片剂和缓释微丸的体外溶出曲线
2.3 大鼠关节肿胀情况 模型组大鼠受试关节出现明显发红肿胀,给药组大鼠关节红肿情况得到不同程度的改善,见图3。与正常组比较,模型组大鼠关节肿胀度明显升高(P<0.001),在12 h 时达到峰值,24 h后逐渐下降,符合痛风性关节炎急性发作的变化规律;与模型组比较,造模后各时间点缓释微丸组关节肿胀度显著降低(P<0.01),片剂组肿胀度显著降低(P<0.05);造模后48 h,缓释微丸组大鼠关节肿胀度较片剂组明显下降(P<0.05),见图4。
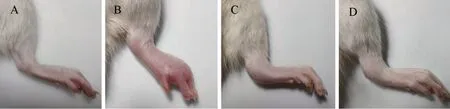
图3 4组大鼠造模后12 h的踝关节对比
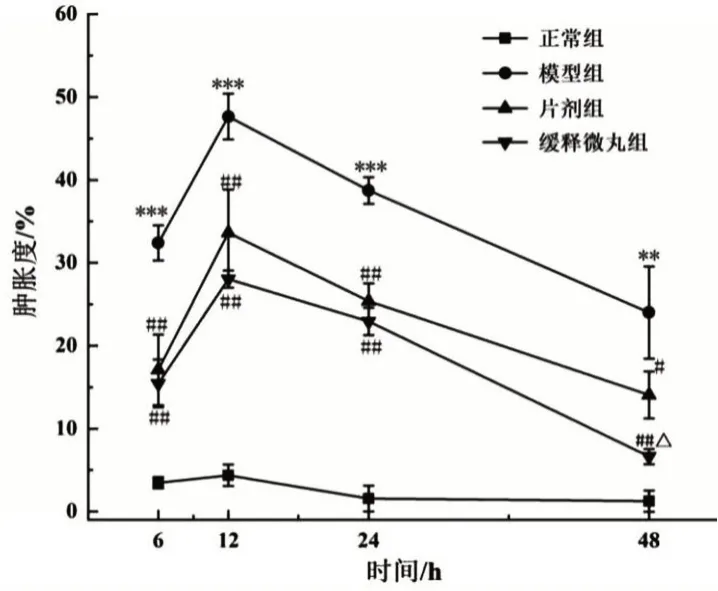
图4 秋水仙碱缓释微丸对痛风性关节炎模型大鼠关节肿胀度的影响
2.4 大鼠血清中IL-1β和TNF-α含量比较 与模型组比较,片剂组、缓释微丸组血清中IL-1β 和TNF-α含量显著降低(P<0.05),且缓释微丸组大鼠血清中IL-1β 和TNF-α 含量显著低于片剂组(P<0.05),见表1。
表1 4组大鼠血清中IL-1β和TNF-α含量比较 pg/mL,,n=6

表1 4组大鼠血清中IL-1β和TNF-α含量比较 pg/mL,,n=6
与正常组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与片剂组比较,△P<0.05。
2.5 大鼠踝关节组织病理变化 正常组大鼠关节滑膜及周围组织结构正常,未见明显炎性细胞浸润;模型组关节软骨面粗糙不平,关节腔内有明显的滑膜组织增生,炎性细胞在其中密集分布,导致关节腔间隙缩小。与模型组比较,片剂组和缓释微丸组大鼠炎性病变明显改善,其中缓释微丸组的关节腔中无明显滑膜组织增生,炎性细胞明显减少,较片剂组炎性病变改善更为明显,见图5。
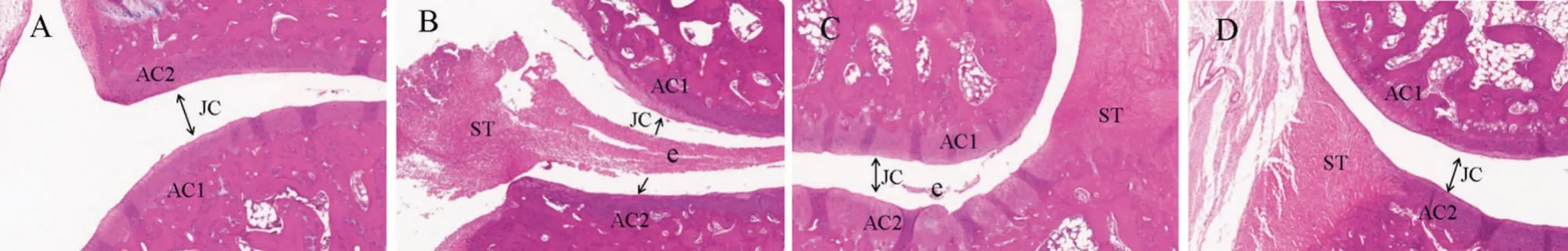
图5 踝关节组织HE染色图(×100)
2.6 大鼠腹泻情况及体重变化 给药期间,片剂组中4 只大鼠出现腹泻,缓释微丸组中1 只大鼠出现腹泻,两组比较无明显差异(P>0.05);正常组、模型组大鼠均未出现腹泻。
给药前,4 组大鼠体重比较无明显差异(P>0.05);给药14 d后,与正常组比较,片剂组大鼠体重显著下降(P<0.05),而缓释微丸组体重无明显差异(P>0.05),与片剂组比较,缓释微丸组大鼠的体重明显增加(P<0.05),见图6。
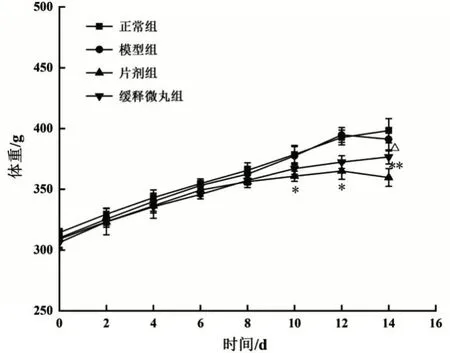
图6 4组大鼠体重变化
2.7 大鼠摄食量及肝、肾功能指标比较 给药前,各组大鼠摄食量比较无明显差异(P>0.05);给药14 d后,与片剂组比较,缓释微丸组大鼠的摄食量明显增加(P<0.05),4 组大鼠血清AST、ALT、Cr 水平比较无明显差异(P>0.05),见表2。
表2 4组大鼠摄食量及血清AST、ALT和Cr水平比较 ,n=6
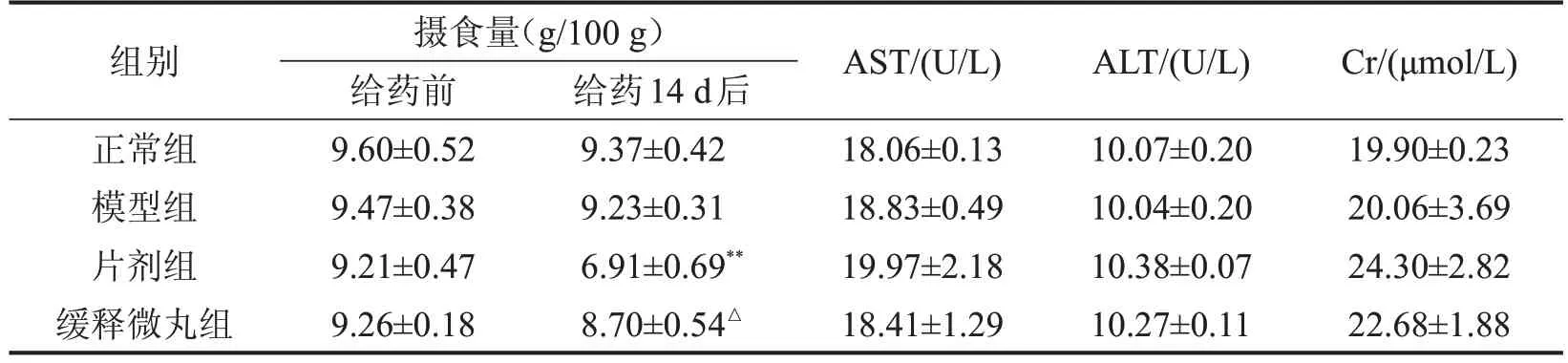
表2 4组大鼠摄食量及血清AST、ALT和Cr水平比较 ,n=6
与正常组比较,**P<0.01;与片剂组比较,△P<0.05。
3 讨论
MSU 沉积于关节腔会引起包括IL-1β、TNF-α在内的炎症因子的产生,抑制体内IL-1β、TNF-α 的含量可缓解痛风性关节炎的炎症症状[15-16]。关节腔内注射尿酸钠诱导大鼠痛风性关节炎急性发作模型具有与痛风性关节炎急性发作相同的症状,该方法已被广泛用来评估抗炎药物的抗炎作用及抗炎机制研究[17]。尿酸钠形成结晶后在关节腔中沉积可引起炎症细胞在关节及周围组织中积聚和浸润,同时引起滑膜组织增生和肥厚,关节液量增加,导致关节肿胀[18]。根据痛风的分子机制研究,尿酸钠结晶可直接刺激巨噬细胞释放TNF-α[19],TNF-α 不仅可以介导炎症反应,它的产生还可增强多形核白细胞释放IL-1β的活性,使炎症反应进一步扩大,因此抑制TNF-α和IL-1β的产生是抗痛风性关节炎的一个重要途径[20-21]。
本研究中药效学实验结果表明,秋水仙碱普通片剂和缓释微丸均可显著抑制模型大鼠关节的肿胀度,显著降低IL-1β、TNF-α的含量水平,并改善炎性病理情况,与片剂组比较,缓释微丸降低肿胀度和IL-1β、TNF-α 含量的效果更显著(P<0.05)。秋水仙碱作为一个历史久远的治疗及预防痛风发作的药物,能够抑制中性粒细胞吞噬尿酸钠的作用,阻断TNF-α 和IL-1β 的释放,减少中性粒细胞流入关节腔中[22],消除痛风性关节炎发作时的关节红肿及炎性症状[23]。根据文献报道,缓释微丸在体外具有稳定的释药行为和速率,在体内可缓慢稳定的释放药物,血药浓度峰谷波动小,生物利用度及安全性可高于普通片剂[24]。我们经过处方筛选得到致孔剂为22%,增重35%的秋水仙碱缓释微丸,其外观光滑圆整具有良好的形态特征,并可在体外缓慢溶出(6 h 内溶出80%以上),具有较合适的释放速率,可避免药物突释对胃肠道的刺激,同时不会因为释放过缓而影响药效的发挥。因此,综合以前和本研究的实验结果,本研究中秋水仙碱缓释微丸对痛风性关节炎的预防效果比普通片剂更显著可能与以上原因有关。同时,我们考察了秋水仙碱缓释微丸在大鼠体内产生的不良反应,结果显示,缓释微丸组大鼠给药前和给药14 d后的摄食量无明显变化,给药期间体重增长较正常;与片剂组比较,缓释微丸组的摄食量及体重显著增加(均P<0.05),提示缓释微丸的胃肠道不良反应更低,与缓释微丸组比较,片剂组腹泻大鼠的数量增加,但可能是由于样本数不足,两组间无显著差异(P>0.05)。血清中AST、ALT的含量水平是反映肝功能的主要指标,Cr是反映肾功能的主要指标,肝肾受损会伴随三者水平升高[25]。AST、ALT、Cr 试剂盒的检测结果显示,缓释微丸对大鼠的肝肾功能无明显影响,进一步证实秋水仙碱缓释微丸具有良好的安全性。
本实验中,由于不能破坏缓释微丸的包衣层以影响缓释效果的发挥,所以采用大鼠整体微丸灌胃的方式,操作过程中要采取比较特殊的方式和特制的灌胃针,给药相对比较困难,而且对大鼠的食道有一定的损伤,因此采取预先给药14 d然后造模的方式,14 d 的观察时间略偏短,但由于剂量较大(给药剂量在预实验的基础上确定),因此相对于模型组效果还是比较明显。
