小窝蛋白-1对N-甲基-D天冬氨酸诱导的脑微血管内皮细胞紧密连接蛋白带状闭合蛋白1的破坏作用研究*
2022-03-24毛凤萍农伟东劳大媛龚卓伟
毛凤萍,黄 芳,农伟东,劳大媛,龚卓伟,黄 文
(广西医科大学第一附属医院神经内科,南宁 530021)
血脑屏障由脑血管内皮细胞、周细胞、星形胶质细胞和神经元组成,被称为“神经血管单元”。脑血管内皮细胞通过紧密连接蛋白复合物连接在一起,形成一个选择性屏障,将外周循环与中枢神经系统隔离,从而维持大脑稳态和神经元功能[1]。血脑屏障完整性的丧失导致血管通透性增加,使血液来源的毒性分子、细胞和微生物进入大脑,参与炎症和免疫反应[2]。部分神经系统疾病伴有血脑屏障功能障碍,如中风、癫痫、创伤性脑损伤和神经退行性疾病等[3-6]。但这些疾病中血脑屏障功能障碍的机制尚不完全清楚。
带状闭合蛋白1(ZO-1)是构成内皮细胞紧密连接重要成分之一,其表达下调或在内皮细胞中重分布都会影响细胞间紧密连接的形成[7]。N-甲基-D天冬氨酸(N-methyl-D aspartic acid,NMDA)是一种谷氨酸类似物,可以激活NMDA 受体(NMDA receptor,NMDAR)。在中枢神经系统中,NMDAR 主要分布于前额叶皮质、海马、杏仁核和下丘脑,它们不仅参与调节神经元的存活和神经元树突、轴突的发育,还参与突触可塑性的形成和学习、记忆、情绪等较高的神经活动[8]。过量的谷氨酸释放通过激活NMDAR 增加大鼠大脑皮层血管的通透性[9]。最近的研究也表明,NMDA与脑血管内皮细胞功能障碍有关[10]。然而,NMDA损伤脑血管内皮细胞的分子信号调节机制尚不完全清楚。小窝蛋白(Caveolin-1,Cav-1)是小窝的主要结构蛋白,广泛表达于各种组织中,它包含一个脚手架结构域,可以与多种信号蛋白结合。Cav-1的中间跨膜区形成一个发夹状结构,允许Cav-1嵌入膜中,使其成为信号转导的关键调节器[11]。有证据表明,Cav-1与许多信号分子相互作用,如丝裂原活化蛋白激酶(MAPK)[12]。通常,根据所研究的细胞类型和特定的细胞信号通路,Cav-1 可作为细胞信号负或正调节因子[13-15]。既往的研究发现,Cav-1在人脑微血管内皮细胞(HBEC-5i)上表达,沉默Cav-1 可有效地保护HIV Tat 诱导的HBEC-5i 中紧密连接蛋白occludin 表达减少[16]。然而,Cav-1在NMDA诱导的紧密连接蛋白ZO-1和血脑屏障完整性破坏之间的相互作用机制尚不完全清楚。本研究旨在探讨Cav-1 在NMDA 诱导的紧密连接蛋白ZO-1 和血脑屏障完整性破坏中的作用。
1 材料和方法
1.1 实验材料
1.1.1 实验试剂 DMEM:F12 培养基(ATCC,美国);胎牛血清(FBS)(Gibco,美国);内皮细胞生长因子(ECGS,ATCC);青霉素100 U/mL 和链霉素0.1 mg/mL(碧云天,中国);NMDA、MK801(Sigma,美国);Daidzein(MCE,中国);CCK-8试剂盒(同仁化学研究所,日本);兔抗GAPDH 单克隆抗体(Proteintech,中国);兔抗ZO-1 单克隆抗体,兔抗NMDAR单克隆抗体(Abcam,美国);兔抗Cav-1单克隆抗体、兔抗p-Cav-1 多克隆抗体(CST,美国);山羊抗兔荧光二抗(LI-COR Biosciences;美国);TRIzol、TaqPCR MasterMix kit、逆转录试剂盒(Takara,日本)。
1.1.2 主要试剂配制 置NMDA、MK801于纯水中溶解,分别制成100 mmol/L、10 mmol/L 储存液,于-20 ℃冰箱保存。含10%FBS DMEM:F12 培养基中加入0.8%ECGS、1%青霉素—链霉素,配置成DMEM:F12完全培养基[16]。
1.2 实验方法
1.2.1 细胞培养瓶预处理 用0.1%明胶溶液将T25培养瓶进行包被,包被后放置于37 ℃,含5%CO2培养箱45 min备用[16]。
1.2.2 细胞培养 HBEC-5i 培养于盛有3~5 mL DMEM:F12 完全培养基且用胶包被的T25 培养瓶中,置于37 ℃,含5%CO2培养箱孵育,视细胞生长情况2~3 d换液。当细胞融合率达80%~90%时,可对细胞进行传代。
1.2.3 NMDA对HBEC-5i细胞活力的影响 CCK-8法检测细胞的活力。将HBEC-5i接种在96孔板上,浓度梯度设4 个复孔,置于培养箱中培养24 h。分别用含有0 mmol/L、0.1 mmol/L、0.5 mmol/L、1 mmol/L、2.5 mmol/L、5 mmol/L、7.5 mmol/L 或10 mmol/L NMDA 的完全培养基孵育24 h,每孔加入10 μL CCK-8 溶液,37 ℃孵育2 h,用酶标仪测量吸光度值(波长450 nm)。
1.2.4 实验分组及处理 将HBEC-5i 接种在12 孔板transwell 小室的上室,每天用电阻仪Millicell ERS Volt-Ohm meter(World Precision Instruments,美国)测量并记录跨内皮细胞膜电阻(TEER)值。计算TEER值:(实验组TEER-空白对照组TEER)×1.11(cm2)[17-18]。当TEER值达平稳期时,根据不同的实验目的分组干预。为了探索内皮细胞NMDAR在ZO-1破坏中的作用,分为以下实验组:对照组(完全培养基)、NMDA组(2.5 mmol/L NMDA)、MK801组(10 μmol/L MK801)、MK801+NMDA组(10 μmol/L MK801预处理2 h+2.5 mmol/L NMDA)。为了进一步研究Cav-1在NMDA诱导的ZO-1破坏中的作用,分为以下实验组:对照组(完全培养基)、NMDA 组(2.5 mmol/L NMDA)、Daidzein 组(10 μmmol/L Daidzein)、Daidzein+NMDA 组(10 μmol/L Daidzein 预处理2 h+2.5 mmol/L NMDA)。24 h 后测量各组TEER值,并收集细胞以备后续实验使用。
1.2.5 蛋白免疫印记(western blotting)分析 细胞用药物处理后,PBS洗涤3次,冰上细胞组织快速裂解液裂解30 min,4 ℃12 000 r/min 离心15 min,取上清液。BCA 蛋白检测试剂盒测定蛋白浓度。用8%~10%SDS-PAGE 分离蛋白并转移到PVDF 膜上,室温下5%脱脂牛奶封闭1h,用下列一抗4°C冰箱孵育过夜:ZO-1(1∶400),Cav-1(1∶1 000),p-Cav-1(1∶1 000),GAPDH(1∶5 000)。第2 天加荧光二抗(1∶20 000)室温孵育1 h 后用荧光扫膜仪扫膜,利用ImageJ软件分析条带灰度值。以ZO-1灰度值与内参GAPDH 灰度值的比值反映ZO-1 蛋白相对表达量;以p-Cav-1灰度值与Cav-1灰度值的比值反映p-Cav-1蛋白相对表达量。
1.2.6 实时荧光定量PCR(qRT-PCR)法检测ZO-1 mRNA表达 药物干预后收集细胞,使用TRIzol试剂提取总RNA。逆转录试剂盒合成cDNA 后,经Step One Plus Real-Time PCR 系统按试剂盒说明书扩增。以2-ΔΔCT法计算ZO-1 mRNA相对表达量,每个样品使用GAPDH 作为内参使目标基因标准化。引物设计参照之前的研究[19]。
1.3 统计学方法
采用SPSS 17.0 统计软件对数据进行统计分析。计量资料以均数±标准差()表示,数据均来自每组至少3次独立实验。各组间的差异通过单因素方差分析(ANOVA)进行对比,组间两两比较采用SNK-q检验,以P<0.05为差异有统计学意义。
2 结果
2.1 不同浓度NMDA对HBEC-5i活力的影响
不同浓度NMDA孵育HBEC-5i 24 h,以0 mmol/L组为对照,NMDA 大于2.5 mmol/L 时,对HBEC-5i的活力有明显的抑制作用(P<0.001)。且随着NMDA浓度升高,其对HBEC-5i活力的抑制作用明显增强。因此,在后续实验中选用NMDA 不影响HBEC-5i活力的2.5 mmol/L作为处理浓度,见图1。
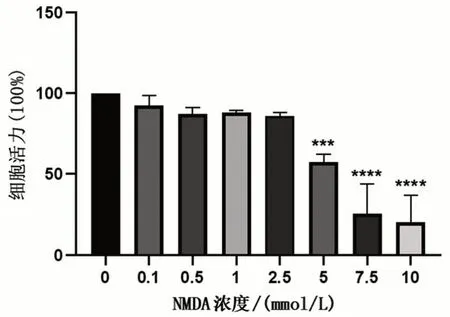
图1 CCK-8法检测不同浓度NMDA对HBEC-5i活力的影响
2.2 NMDAR 的激活增加HBEC-5i 中紧密连接蛋白ZO-1的破坏
与对照组相比,NMDA 组ZO-1 的蛋白(0.32±0.14)和mRNA(0.57±0.09)水平均显著降低(均P<0.01)。然而,HBEC-5i 用MK801(10 μmol/L)预处理2 h后再用NMDA(2.5 mmol/L)孵育24 h,结果显示,MK801 预处理逆转了NMDA 诱导的ZO-1 蛋白和mRNA的下调(均P<0.05),见图2。
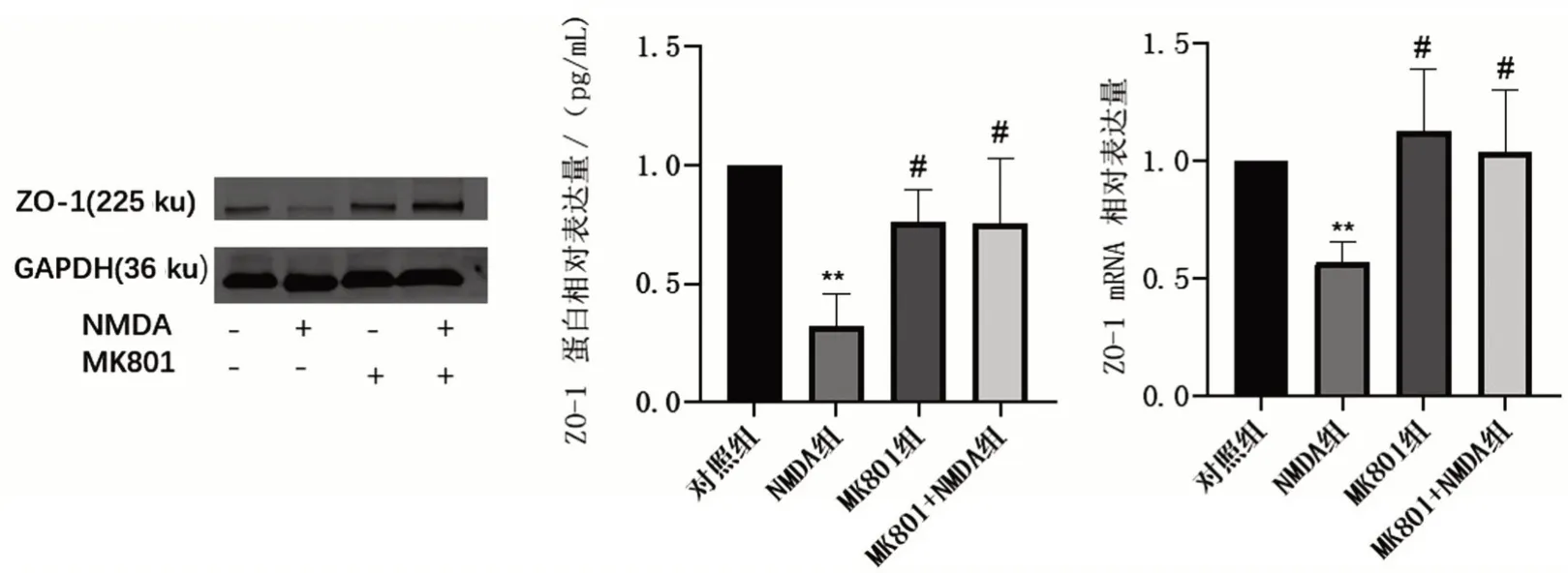
图2 Western blotting和RT-qPCR分别检测MK801预处理后HBEC-5i ZO-1蛋白和mRNA水平
2.3 Cav-1 在NMDA 诱导的紧密连接蛋白ZO-1 破坏中的作用
与对照组相比,NMDA 组p-Cav-1 蛋白表达水平明显升高(P<0.05),ZO-1 蛋白水平下调(P<0.01)。然而,在NMDA 孵育前先用Cav-1 抑制剂Daidzein 预处理2 h,结果显示,与NMDA 组相比,Daidzein 预处理组不仅下调了p-Cav-1 蛋白表达水平(P<0.05),而且保护了NMDA 诱导的ZO-1 蛋白(P<0.05)和mRNA(P<0.000 1)的下调,见图3。
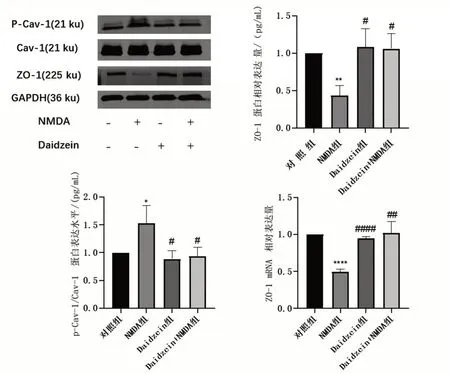
图3 Cav-1抑制剂Daidzein预处理后检测HBEC-5i ZO-1蛋白和mRNA水平
2.4 药物干预后各组TEER值的测定
2.5 mmol/L NMDA 孵育24 h 后,HBEC-5i 血脑屏障模型的TEER 值显著降低(P<0.001),说明HBEC-5i构建的紧密连接屏障的完整性被破坏。然而,MK801(10 μmol/L)阻止了NMDA 诱导的紧密连接屏障完整性破坏(P<0.001)。此外,Daidzein预处理可阻断HBEC-5i血脑屏障模型TEER值的降低(P<0.001),表明Cav-1 可能参与了NMDA 诱导的紧密连接屏障完整性破坏的调节,见图4。

图4 MK801、Daidzein预处理后血脑屏障模型TEER值测定
3 讨论
Mehra 等[20]发现NMDAR 激活与脑血管内皮细胞功能障碍有关。NMDA 降低了脑微血管内皮细胞中紧密连接蛋白的表达,增加了血脑屏障的通透性[10-11]。然而,NMDA 如何诱导脑微血管内皮细胞中紧密连接蛋白的破坏,增加血脑屏障的通透性,目前尚不完全清楚。NMDAR过度激活导致兴奋性毒性神经元丢失[21-22]。过去的体外或体内实验均表明,脑缺血部位释放谷氨酸通过激活NMDAR 增加血管通透性,但NMDAR拮抗剂(MK801)可保护脑缺血部位的血管通透性的降低[9,23]。因此,NMDAR激活引起的兴奋性毒性在脑微血管内皮细胞紧密连接蛋白的破坏和血脑屏障功能障碍中起着重要作用。
过量的谷氨酸降低了脑血管内皮细胞紧密连接蛋白occludin 的表达和减少TEER 值[23]。Andras等[24]发现MK-801 对NMDAR 的抑制可部分保护谷氨酸诱导的紧密连接蛋白occludin磷酸化并减少血管内皮细胞损伤。ZO-1 是构成紧密连接的最主要成分之一,在维持血脑屏障的完整性方面发挥着重要作用[7]。本研究表明,暴露于NMDA 可降低脑微血管内皮细胞紧密连接蛋白ZO-1 的表达和减少血脑屏障模型的TEER值。然而,MK-801预处理可拮抗NMDAR活化诱导的紧密连接蛋白ZO-1的减少,从而减少血管内皮细胞的损伤(P<0.05)。这些结果表明,激活HBEC-5i 中的NMDAR 可诱导脑微血管内皮细胞紧密连接蛋白的破坏,从而增加血脑屏障的通透性。
小泡是一种特殊类型的脂筏,主要存在于人体的上皮细胞、内皮细胞、脂肪细胞和成纤维细胞中。本课题组之前的研究表明,Cav-1 在HBEC-5i的质膜中表达,并在HIV-1 Tat介导的紧密连接蛋白破坏中发挥重要的调节作用[16]。然而,Cav-1是否参与了NMDA诱导的HBEC-5i中紧密连接蛋白ZO-1的破坏尚不清楚。在本研究中,用Cav-1 抑制剂Daidzein抑制HBEC-5i中Cav-1的表达,评估Cav-1在NMDA 诱导的紧密连接蛋白破坏中的作用。结果支持之前的研究,证实Cav-1 在HBEC-5i 质膜中表达[16]。此外,本研究还发现,HBEC-5i 在暴露于NMDA 24 h后,其Cav-1磷酸化蛋白水平显著升高,且在使用Cav-1抑制剂Daidzein抑制HBEC-5i细胞中Cav-1 的表达后,与NMDA 组相比,Daidzein +NMDA组Cav-1磷酸化蛋白水平降低。同时,Daidzein 可以有效地防止NMDA 诱导的ZO-1 表达的减少和HBEC-5i 血脑屏障模型TEER 值的降低(P<0.05)。这些结果进一步表明,Cav-1 可能参与调节NMDA 诱导的脑微血管内皮细胞紧密连接蛋白ZO-1的表达和血脑屏障的完整性的维持。
综上所述,NMDAR拮抗剂MK801、Cav-1抑制剂Daidzein 预处理对NMDA 诱导的HBEC-5i 中ZO-1 表达下降和血脑屏障模型TEER 值降低具有显著的保护作用。这些发现,阐明了NMDA诱导的脑微血管内皮细胞紧密连接蛋白破坏的可能机制。MK801 对NMDA 诱导的紧密连接屏障功能障碍具有潜在的保护作用。靶向研究Cav-1相关信号可能是治疗血脑屏障功能障碍的神经系统疾病的一种有前景的方法。
