过继经母牛分枝杆菌雾化免疫后的γδT细胞对哮喘小鼠模型的影响及其机制*
2022-03-24黄仲辰陈晓菊姚意恩李超乾
黄仲辰,陈晓菊,姚意恩,李超乾△
(广西医科大学 1.第一附属医院呼吸内科;2.附属肿瘤医院综合内科,南宁 530021)
哮喘的机制尚未完全阐明,本课题组前期研究证实,γδT细胞参与哮喘的致病过程并存在Th1/Th2细胞模式失衡[1],证实雾化吸入灭活草分枝杆菌可以使哮喘体内Th1/Th2 失衡得以纠正,从而使γδT细胞内Th1/Th2 失衡也得以恢复[2-3],进而使肺部炎症病变减轻[4];也证实了哮喘小鼠中γδT 细胞Th17/Treg的失衡可能与卵清蛋白(ovalbumin,OVA)诱发哮喘的发病机制有关[5]。另外,本课题组前期实验证明雾化吸入灭活草分枝杆菌可以减轻哮喘小鼠气道炎症,原理可能是上调T-bet mRNA表达而下调GATA-3 mRNA 等转录因子的表达,最终Th2 细胞因子分泌调节转录因子水平的作用受到抑制[6]。本研究旨在观察过继经母牛分枝杆菌雾化免疫后的γδT 细胞对哮喘小鼠模型的干预作用,并进一步探讨母牛分枝杆菌对T-bet、GATA3 以及白介素(IL)-13、IL-5表达的影响,为临床雾化吸入灭活分枝杆菌防治哮喘提供理论依据。
1 材料与方法
1.1 材料
1.1.1 试剂 OVA(美国sigma 公司)、氢氧化铝凝胶、母牛分枝杆菌22.5 μg 注射液(安徽智飞龙科马生物制药有限公司),小鼠IL-13、IL-5 ELISA 试剂盒。
1.1.2 仪器 酶标仪、超声雾化器WH-2000、病理图像分析系统(日本Olympus公司)、NanoDrop 2000超微量分光光度计5810R 高速低温离心机,肺功能仪NAM 系统(美国DSI 公司),FACS CantoⅡ型流式仪。
1.1.3 OVA 试剂配制 OVA 混悬液配制:取25 mg OVA 溶于高压灭菌的10 mL PBS 溶液中,取100 μL到4 mL EP管中,再加入1 650 μL的PBS溶液,放置4 ℃冰箱保存,使用时每管加入250 μL 的氢氧化铝凝胶,现配现用。每只小鼠使用25 μg OVA+1 mg氢氧化铝凝胶,注射0.2 mL;OVA雾化激发溶液配制:OVA粉末溶于PBS溶液中,配制成2%浓度的溶液,放置4 ℃冰箱保存。
1.1.4 γδT细胞制取 40只SPF级雄性TCR-β-/-小鼠(该种小鼠没有T 细胞,不会排斥同种异体移植物)购于北京百奥赛图基因生物技术公司,6~8 周龄,体重(20±2)g。将这些小鼠随机分为对照组和母牛分枝杆菌雾化组,每组20 只,两组各置于雾化器内并分别予生理盐水、母牛分枝杆菌雾化。雾化时,母牛分枝杆菌组用10 mL生理盐水稀释1支注射用母牛分枝杆菌注射液(22.5 μg/mL),雾化30 min,每天1 次,连续雾化5 d;对照组予以10 mL 生理盐水代替雾化。末次雾化后用10%水合氯醛麻醉小鼠,将小鼠左侧卧位并固定好,剪开小鼠左上腹皮肤,取出脾脏,制备脾单细胞悬液,随后用磁珠分选法分选γδT 细胞,最后用流式细胞术检测分选γδT 细胞的纯度,如果纯度大于80%,即可用于鼠尾静脉注射。
1.2 动物分组与模型建立
32 只SPF 级健康雄性Balb/c 小鼠(该种小鼠常用于哮喘模型制作效果较好[7]),6~8 周龄,体质量(20±2)g,由广西医科大学动物实验中心提供。将32 只SPF 级雄性Bal b/c 小鼠随机分为4 组,对照组(A组)、哮喘模型组(B组)、TCR-β-/-小鼠经生理盐水雾化后提取的γδT细胞过继组(C组)、TCR-β-/-小鼠经母牛分枝杆菌雾化后提取γδT细胞过继组(D组)。B 组、C 组和D 组用鸡卵清蛋白(OVA)PBS 溶液致敏激发制备哮喘小鼠模型(普遍公认的制模方法[8]);C 组在第1 次腹腔注射OVA 氢氧化铝PBS 溶液前10 min 及第1 次雾化OVA PBS 溶液激发前10 min,经鼠尾静脉注射过继输入TCR-β-/-小鼠经生理盐水雾化后提取的γδT细胞,每次鼠尾注射1×106个γδT 细胞;D 组在第1 次腹腔注射OVA 氢氧化铝PBS 溶液前10 min 及第1 次雾化OVA PBS 溶液激发前10 min,经鼠尾静脉注射过继TCR-β-/-小鼠经母牛分枝杆菌雾化后提取的γδT 细胞,每次鼠尾静脉注射1×106个γδT细胞,溶于1 mL生理盐水中;对照组腹腔注射及雾化均用等量PBS代替,鼠尾注射用等量生理盐水代替;每组每只小鼠共计注射5 次。最后1 次雾化后24 h 内检测气道反应性,用10%水合氯醛0.1 mL 腹腔注射麻醉后处死小鼠,该操作符合动物伦理学标准,收集肺泡灌洗液(bronchoalveolar lavage fluid,BALF),酶联免疫吸附测定实验(enzyme linked immunosorbent assay,ELISA)检 测BALF 的IL-13 和IL-5 的水平。取肺组织、固定、切片、染色,观察肺内炎症浸润的病理情况;然后用免疫组化法检测肺组织中T-bet/GATA3的表达水平。
1.3 小鼠气道反应性测定
打开电脑以及肺功能仪,校准仪器,检测肺功能仪密闭舱环境状态,设定相关参数:设置小鼠ID,将它们分到相应的A 组、B 组、C 组、D 组中;用PBS和6.25 mg/mL、12.5 mg/mL、25 mg/mL、50 mg/mL 4 个乙酰甲胆碱的浓度雾化激发,雾化量为20 μL,小鼠在肺功能仪密闭舱内适应时间为5 min;雾化,记录时间为3 min,下一步雾化前,小鼠恢复时间为4 min;把小鼠装入肺功能仪密闭舱内,为防止小鼠窒息死亡打开密闭舱气流阀通气,之后开始测量;小鼠检测完,导出数据,分析小鼠气道反应性。小鼠的气道反应性是以乙酰甲胆碱相应浓度激发下的特殊气道阻力(specific resistance airway,sRaw)平均值与PBS 激发下的特殊气道阻力平均值来反应的。公式:sRaw 值=Mch SRAW 值-PBS SRAW值,单位:cmH2O/(L·s)。
1.4 标本采集
小鼠经10%水合氯醛麻醉后气管插管,用预冷至4 ℃的PBS 0.5 mL 灌洗,缓慢注入气管,缓慢回收BALF,重复2 次,回收率>85%,在-80 ℃冰箱保存。取小鼠左肺组织,用4%多聚甲醛浸泡固定,脱水、包埋,切片约4 μm,进行苏木精—伊红(hematoxylin-eosin,HE)和过碘酸—雪夫(periodic acid Schiff,PAS)染色,余肺叶放置-80 ℃保存备用。
1.5 肺部病理组织学检查
取左肺组织,固定,石蜡包埋、切片,做HE 和PAS染色,光镜下观察肺部炎症情况。
1.6 ELISA法检测BALF 中IL-13、IL-5 水平
按照说明书提供的方法操作,酶标仪检测450 nm 光密度值,绘制标准曲线,根据标准曲线计算出细胞因子IL-13、IL-5浓度。
1.7 免疫组化
脱蜡脱水,自来水冲洗,重复2 次,切片放在架子,浸泡至0.01 mol/L(pH=6.0)枸橼酸缓冲液盒中,放入高压锅高压10 min修复。至修复完成,缓慢放气开盖,梯度冷却,PBS 洗涤5 min,重复2 次,置于3%双氧水中浸泡10 min,PBS冲洗5 min,重复2次,5%BSA 封闭液浸泡10 min;甩干破片上液体,按说明书推荐浓度将一抗加到组织上,4 ℃冰箱过夜;次日,室温条件下30 min以上放置,PBS冲洗5 min,重复2次,甩干组织上液体,按说明书推荐量将二抗滴在组织上,孵育在37 ℃恒温箱中15 min,PBS 冲洗5 min,重复2次;甩掉组织上液体,按照说明书推荐量加DAB 显色剂浸泡5 min。冲洗自来水,苏木精浸泡1 min,自来水洗涤3 min,1%盐水酒精浸泡3 s分化,自来水冲洗3 min。自来水浸泡10 min反蓝,晾干封片,显微镜下观察肺组织并用Image J软件分析。
1.8 统计学方法
采用SPSS 22.0 软件处理数据,Prism 5.0 软件处理图表。计量资料采用均数±标准差()表示,数据先做方差齐性检验,结果符合正态分布及方差齐用One-way ANOVA 比较组间差异,两两比较采用LSD-t检验,用Pearson相关性检验进行相关性分析。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠气道反应性
B 组小鼠在12.5 mg/mL、25 mg/mL、50 mg/mL浓度下经Mch激发的气道反应性高于A组,sRaw增长值差异具有统计学意义(P<0.05);相比于B 组,D 组sRaw 增长值降低(P<0.05),而与C 组比较差异不明显(P>0.05)(图1)。

图1 小鼠肺功能比较
2.2 肺部病理表现
B组可见支气管及血管周围炎性细胞浸润较明显,支气管管腔狭窄,管壁增厚;经鼠尾过继注入γδT 后,D 组与B 组对比气道炎症水平下降,支气管及血管周围淋巴细胞浸润明显减轻。PAS 染色显示:A组小鼠支气管气道上皮无杯状细胞增生,无黏液渗出;B 组可见明显杯状细胞增生,黏液渗出较多;D 组与B 组对比,支气管管腔内杯状细胞减少,腔内黏液渗出减轻;C 组相比B 组差异不明显(图2)。提示过继经母牛分枝杆菌化免疫后的γδT细胞对哮喘小鼠模型可能具有预防作用。
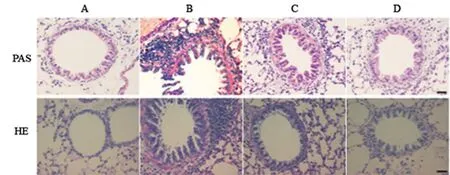
图2 小鼠肺组织HE(×200)和PAS染色(×400)
2.3 肺组织中T-bet/GATA3表达情况
B组肺组织T-bet表达水平低于A组,而GATA3表达水平高于A组,差异具有统计学意义(P<0.05);D组肺组织T-bet表达水平高于B组,GATA3表达水平低于B 组,差异具有统计学意义(P<0.05);C 组与B 组无明显差异(P>0.05),见图3。提示过继经母牛分枝杆菌化免疫后的γδT细胞可调节哮喘小鼠模型T-bet/GATA3表达。
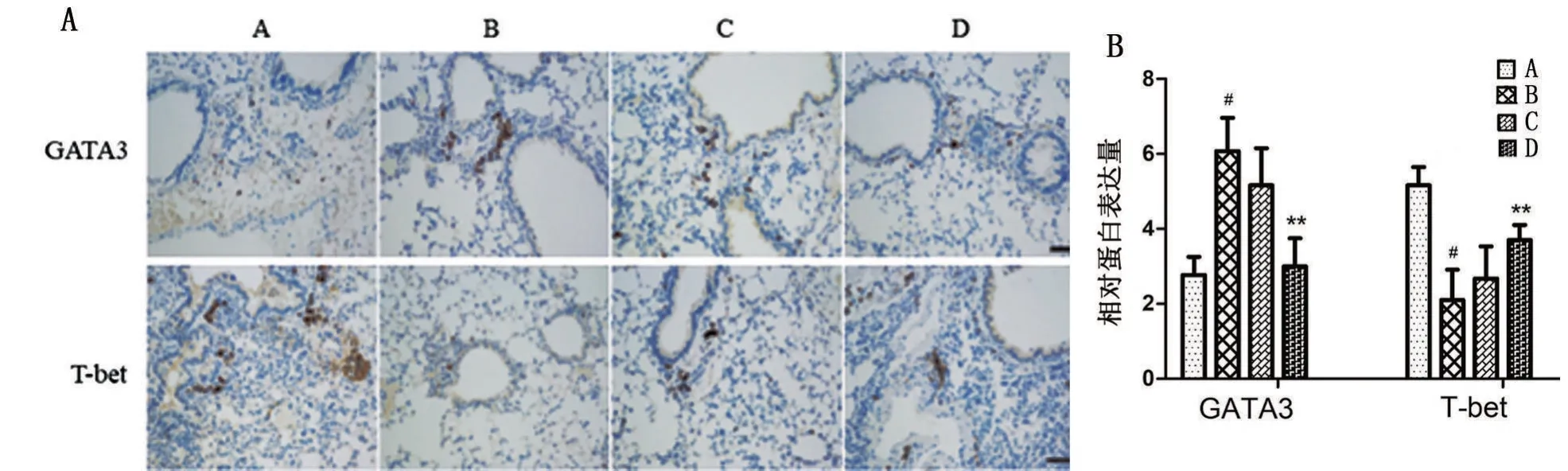
图3 免疫组化法检测肺组织中T-bet、GATA3的表达水平
2.4 BALF 中IL-13、IL-5表达水平
B 组BALF 中IL-13、IL-5 水平高于A 组(P<0.05);D组BALF 中IL-13、IL-5水平低于B组(P<0.05);C组与B组间差异无统计学意义(P>0.05),见图4 和图5。提示过继经母牛分枝杆菌化免疫后的γδT细胞可调节哮喘小鼠模型的IL-13、IL-5的表达。

图4 小鼠BALF中IL-13表达水平

图5 小鼠BALF中IL-5表达水平
3 讨论
哮喘病因比较复杂,多种细胞和细胞因子都可能是哮喘发病的关键因素。IL-5 和IL-13 与过敏性哮喘有着紧密的联系[9],临床研究发现IL-13、IL-5参与哮喘炎症反应[10],哮喘患者的肺组织、痰和血清中IL-5 和IL-13 水平明显高于正常人,并且其水平与病情的严重程度成正相关。已经有研究表明,γδT 细胞参与了哮喘的发生发展过程[11]。γδT 细胞主要分布在皮肤、黏膜等表面组织,同时也是参与炎症反应的关键细胞[12]。γδT 细胞在胸腺发育,在胎儿时期已经具备免疫效应,出生之后γδT 细胞逐渐向皮肤,肺部,舌,消化道黏膜等部位转移[13]。此外,转录因子T-bet/GATA3 与Th1/Th2 失衡有着密切联系[14]。Th1 细胞和Th2 效应细胞均是由Th0 细胞分化而来[15],该过程受到T-bet/GATA3的调控[16],而且GATA3只在Th2中表达[17]。本研究针对γδT细胞的黏膜免疫特点,通过雾化吸入途径制备母牛分枝杆菌免疫后的γδT 细胞,再过继(鼠尾静脉注射)干预哮喘小鼠模型的形成(主要以气道反应性、支气管肺病理改变以及哮喘相关细胞因子为评价指标,判定干预效果),并进一步探讨了母牛分枝杆菌对T-bet/GATA3以及IL-13、IL-5表达的影响。
雾化吸入灭活草分枝杆菌可以调节气道炎症反应,缓解哮喘症状[18]。母牛分枝杆菌与灭活草分枝杆菌同属于分枝杆菌属,有着相似的免疫调节作用,基于药品的来源,本实验使用“注射用母牛分枝杆菌”。结果表明,D组相比于B组及C组气道反应性明显降低;支气管及肺组织炎性细胞浸润较轻,杯状细胞及黏液渗出减少;肺组织T-bet蛋白表达升高、GATA3表达下降;BALF的IL-13、IL-5水平显著下降。进一步证明了雾化吸入分枝杆菌疫苗对哮喘模型形成的预防作用,γδT 细胞在哮喘发病机制中发挥重要作用,同时也提示其与T-bet/GATA3 以及IL-13、IL-5有一定相关性。
(本实验于广西医科大学医学科学实验中心完成,感谢实验室老师的指导和帮助!)
