肝细胞肝癌中CCAAT/增强子结合蛋白-α的表达及其临床意义*
2022-03-24赵子璇郭新燕冯振博
赵子璇,郭新燕,冯振博
(1.广西医科大学第一临床医学院病理科,南宁 530021;2.广西壮族自治区昭平县人民医院病理科,昭平 546800)
肝细胞肝癌(hepatocellular carcinoma,HCC)是常见的恶性肿瘤,在中国地区高发[1]。迄今为止,HCC患者可以采用的治疗策略包含外科手术、射频消融、肝动脉化学栓塞和免疫治疗等,由于HCC 发病机制极其复杂,上述治疗手段对部分HCC患者收效甚微,以至于其5 年生存率仅为12%至15%[2]。改善术后高复发率,提高放化疗敏感性以及如何对HCC 患者做出早期诊断等仍是目前HCC 研究领域的重点。基于以上问题,深入研究HCC发生发展机制,有助于寻求新的诊断和治疗策略以改善HCC患者的总体预后。
CCAAT/增强子结合蛋白(C/EBP)转录因子家族参与多种细胞过程,包括细胞增殖、分化、代谢和免疫反应。这个家族中第一个被发现的成员被命名为CCAAT/增强子结合蛋白α 基因(CCAAT/enhancer binding proteinα,CEBPA)[3]。CEBPA 是一种转录调节因子,在正常生理过程和疾病发生中起正、负转录调节作用,在肝、肺、外周血单核细胞和胎盘中高度表达[4]。CEBPA 通常作为肿瘤抑制因子,参与调节肿瘤细胞分化、增殖、凋亡和代谢。在几种类型的癌细胞中发现了CEBPA 的低表达[5]。最近的研究表明,CEBPA广泛参与多种肿瘤的侵袭和转移,包括胃癌、乳腺癌、肝癌和膀胱癌[6-9]。CEBPA 在多种恶性肿瘤中具有潜在的临床价值。本研究是首次结合癌症基因组图谱(The Cancer Genome Atlas,TCGA)和基因表达综合数据库(Gene Expression Omnibus,GEO)等数据库的样本进行全面分析,初步验证CEBPA mRNA在HCC中的表达,随后采用RT-qPCR 验证CEBPA 在HCC 细胞系Huh7 中mRNA 的表达,并通过免疫组化技术验证CEBPA蛋白水平的表达及其与HCC患者临床病理参数之间的关系。
1 材料和方法
1.1 基于mRNA和芯片数据的获取与分析
整合TCGA和GTEx中肝细胞癌和邻近非癌组织的mRNA 数据集,包括371 例肝细胞癌和225 例非癌对照的基因表达数据。随后,于GEO中检索肝细胞癌相关高通量数据,收集9 个平台中与肝细胞癌相关的67 个mRNA 芯片,包括3 356 例癌样本和2 979 例非癌样本。使用R 语言和Perl 语言对不同平台合并,并且去除平台间批次效应。所有数据处理前,对原始表达数据标准化,对表达值进行log2处理。
1.2 实时定量逆转录聚合酶链反应
选择一种肝细胞癌细胞系(Huh7)和一种正常人肝细胞(L02)进行总RNA的提取。其中,总RNA采用Mini BEST Universal RNA extraction KIT(Ta-KaRa)纯化,cDNA 采用Prime-Script RT Master Mix(TaKaRa)进行逆转录合成。在7500 系统中进行RT-qPCR。每个实验的样本进行分析一式3份。本研究使用的引物序列如下:CEBPA-F 5'-GTGGCAGGAGGAGGGCTCAG-3';CEBPA-R 5'-TTCTAAGACAGGCGTGGAGGAG-3'。
1.3 免疫组织化学技术(immunohistochemical,IHC)
1.3.1 标本收集 收集2020年9月至2021年3月在广西医科大学第一附属医院经病理科确诊为HCC患者的石蜡标本,包括90例癌组织石蜡标本及对应癌旁组织石蜡标本作为对照组,同时收集患者的临床资料。纳入标准:原发性肝细胞癌患者;术前未接受放疗、化疗以及内分泌治疗等辅助治疗的患者。
1.3.2 免疫组化实验主要试剂和方法 兔抗人CEBPA多克隆抗体(购自abclonal抗体官方网站,货号A0904,浓度1∶50)、通用二步法检测试剂盒、EDTA 抗原修复液、DAB 显色试剂盒。将组织石蜡块按照切片、抗原修复、阻断内源性过氧化物酶、抗原抗体反应、显色、复染、脱水、透明、封片的步骤,采用免疫组化EnVision法和DAB进行显色。
1.3.3 染色结果评估 在高倍镜视野中记录蛋白的表达。无颜色、淡黄色、棕褐色、深褐色分别代表0分、1分、2分、3分。染色细胞百分率分为0个染色点<5%,1 个染色点为5%~24%,2 个染色点为25%~49%,3个染色点为50%~75%,4个染色点为>75%。总分数计为染色强度分数和染色点数的乘积,最高12 分。结果低表达为0~7 分,高表达为8~12分。
1.4 HCC中CEBPA上调的可能机制
使用Robust rank aggregation(RRA)结合人工ranking 的方式,筛选出CEBPA 相关基因。通过测序数据筛选出HCC 的差异表达基因(DEGs),在(http://cistrome.org/db/)下载CEBPA 预测的靶基因。如果CEBPA共表达基因、差异基因和靶基因也在HCC 的癌变过程中发挥作用,那么它们与CEBPA的协同或拮抗作用对HCC的生物学功能产生影响的可能性更大。因此,取CEBPA 相关基因、靶基因与HCC 测序的DEGs 的交集,筛选出交叉基因,使用R 包clusterProfiler 将交叉基因进行gene ontology(GO)和Kyoto Encyclopedia of Genes Genomes(KEGG)分析,并绘制气泡图将富集分析可视化。使用STRING 数据库(https://string-db.org/)进行蛋白互作网络(PPI)分析,将KEGG 通路分析中主要通路的基因输入网站中,通过蛋白—蛋白相互作用(PPI)分析,构建了PPI网络。PPI网络中,节点表示蛋白质,直线表示蛋白质之间的相互作用。
1.5 统计学方法
采用SPSS 21.0 统计软件分析数据。计量资料以均数±标准差()表示,组间比较采用t检验。计数资料以百分率(%)表示,组间比较采用χ2检验。在随机效应模型中,采用STATA 12.0生成综合的总标准化均数差(SMD)和95%可信区间(CI)的森林图和summary ROC(SROC)曲线。以P<0.05为差异有统计学意义。
2 结果
2.1 基于数据库的CEBPA mRNA表达的验证
GEO芯片数据与TCGA序列数据合并进行meta 分析,结果表明:CEBPA 在HCC 组织中的mRNA表达水平显著高于正常组织(SMD=0.51;95%CI:0.14~0.87;I2=95.8%)(图1B);集成SROC曲线下面积(AUC)为0.79(95%CI:0.75~0.82)(图1A)。CEBPA 的合并的敏感性为0.66(图2A),合并的特异性为0.64(图2B),合并的阳性似然比(PLR)为2.05(图2C),合并的阴性似然比(NLR)为0.42(图2D)和合并的诊断优势比(DOR)为6.01(图2E)。经过全面综合分析显示,CEBPA 在HCC 中是高表达的。提示HCC中CEBPA mRNA的表达可能是一种很有前景的生物标志物。
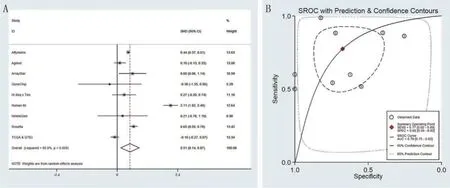
图1 TCGA序列数据和GEO芯片数据综合分析结果
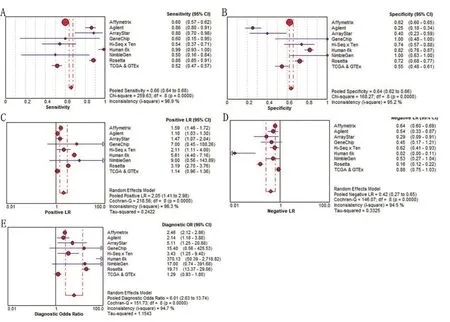
图2 集成所有数据集的诊断价值
2.2 实时定量逆转录聚合酶链反应结果
检测HCC细胞系Huh7及正常肝细胞系L02中CEBPA的表达。内参及CEBPA在扩增过程中均无非特异性扩增和引物二聚体。根据CT 值计算出Huh7 与L02 的相对表达量。结果显示:CEBPA 在HCC细胞系Huh7中的表达明显高于正常肝细胞系L02,差异有统计学意义(P<0.01)(图3)。
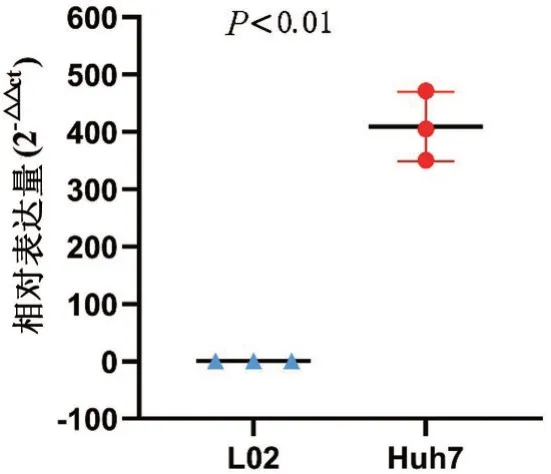
图3 CEBPA 在HCC 细胞系HuH7 和正常肝细胞系L02 中的表达(P<0.01)。
2.3 免疫组化实验结果
2.3.1 CEBPA 蛋白在HCC 组织及癌旁肝组织中的表达
在HCC 组织中,CEBPA 蛋白定位于细胞核。CEBPA 蛋白分别在癌组织及癌旁组织中阳性表达及阴性表达的情况(图4)。在肝细胞癌组织中,67例高表达(74.4%),23 例低表达(25.6%);在癌旁肝组织中,仅37 例CEBPA 蛋白高表达(41.1%),53 例CEBPA 蛋白低表达(58.9%)。结果表明,相对于癌旁肝组织,CEBPA 蛋白在HCC 组织中显著高表达(P<0.01),见表1。
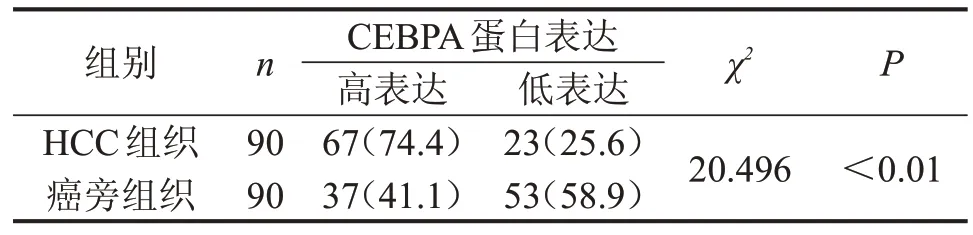
表1 CEBPA蛋白在肝细胞癌组织及癌旁肝组织中的表达 n(%)
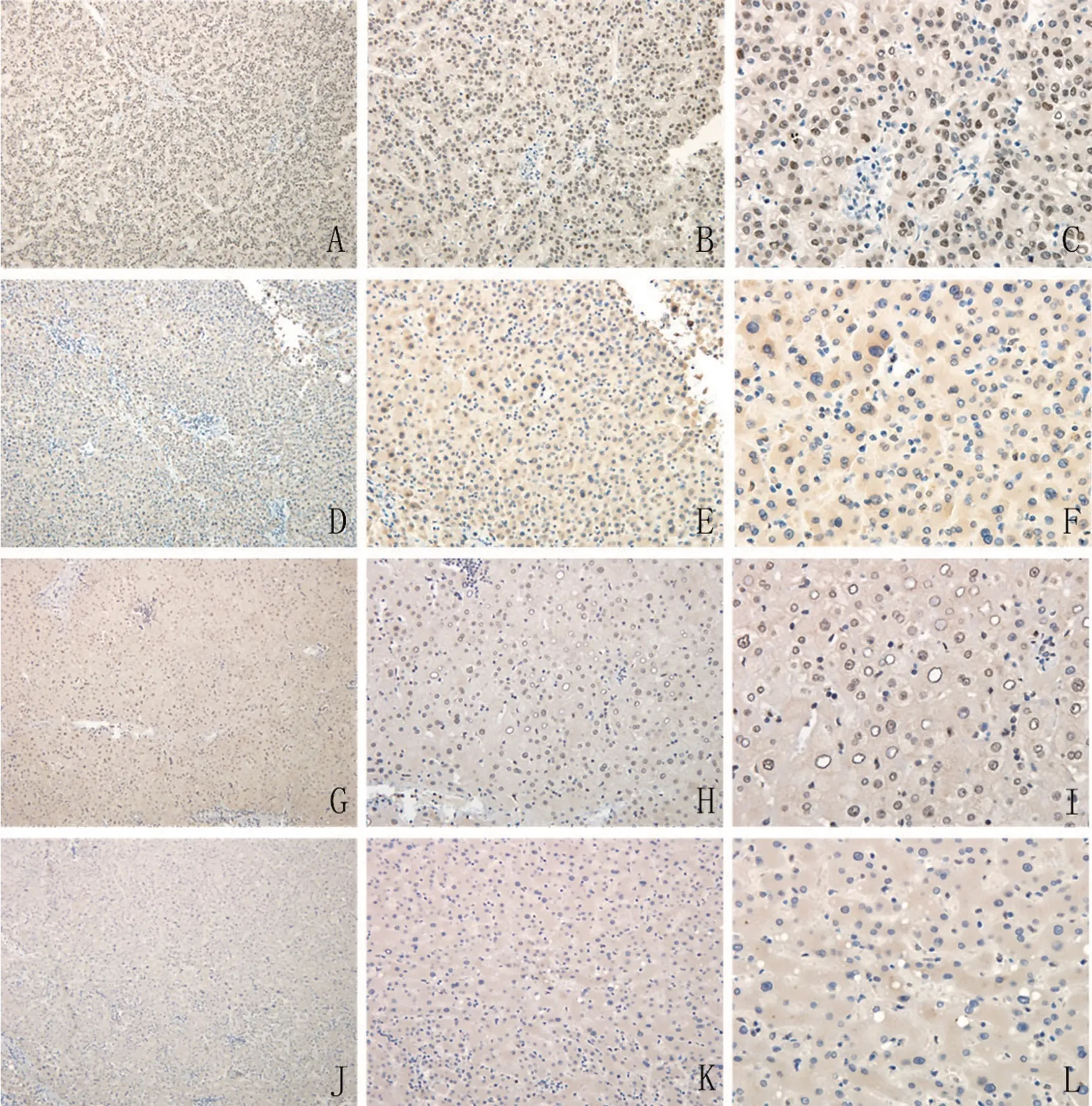
图4 免疫组化染色结果(EnVision 法和DAB进行显色(A、D、G、J 为×100;B、E、H、K为×200;C、F、I、L为×400)
2.3.2 CEBPA 蛋白表达与肝细胞癌患者临床病理参数之间的关系
HCC 患者的临床病理参数包括年龄、性别、肿瘤大小、肿瘤数量、肝炎病史情况、肝硬化情况、血AFP 值、病理观察微血管侵犯情况及卫星结节形成。评估90 例患者切片的免疫组化结果,发现CEBPA蛋白的差异表达在患者病理分级(P=0.024)及TNM分期中的T分期(P=0.023)差异有统计学意义(P<0.05),见表2。
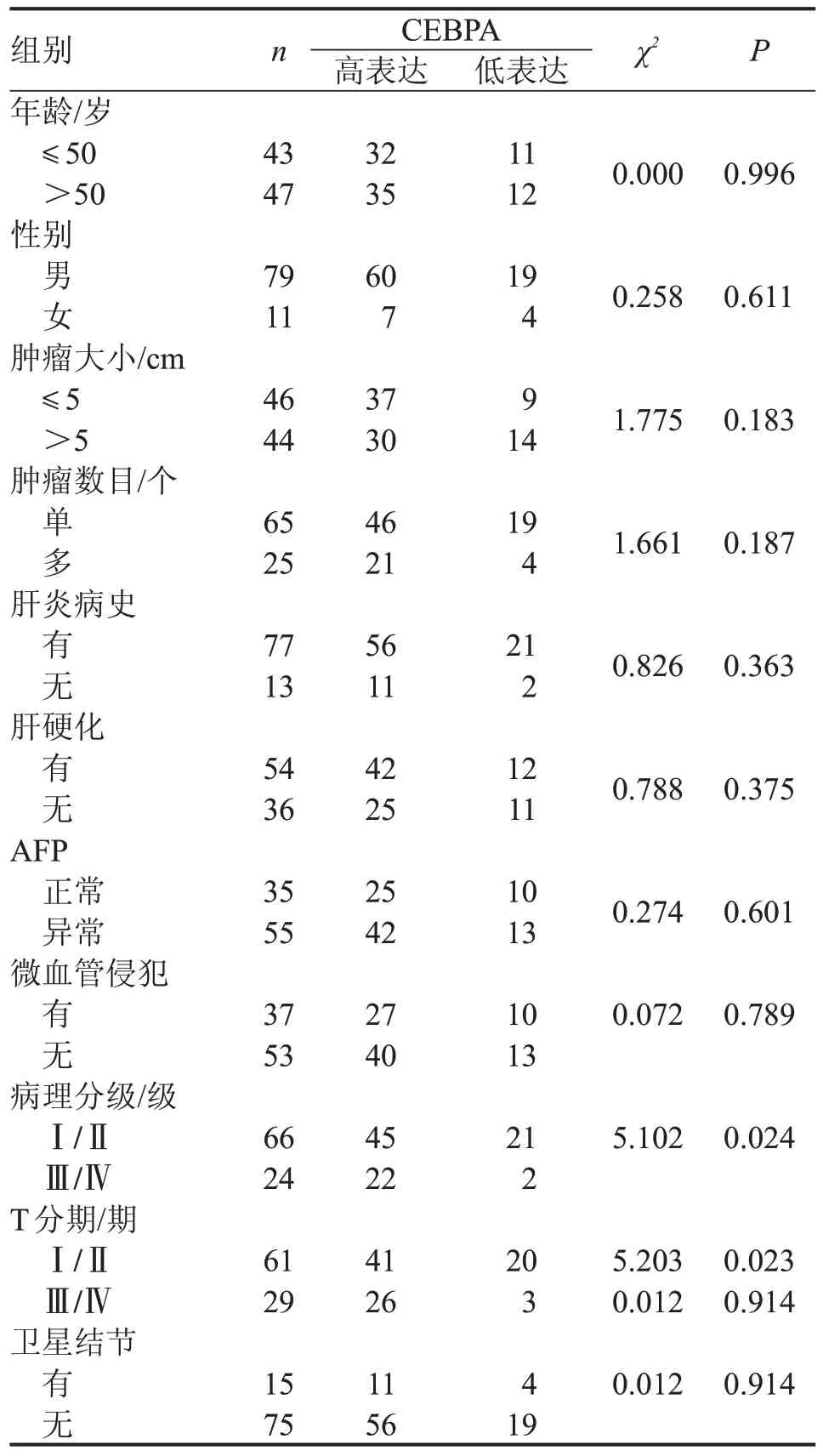
表2 CEBPA 蛋白表达与肝细胞癌患者临床病理参数之间的关系
2.3.3 CEBPA在HCC中的潜在功能和途径
使用R筛选出每个数据集的4 535个CEBPA共基因。通过测序数据筛选出至少出现9次的差异基因。在Cistrome网站中筛选CEBPA的靶基因,将共表达基因、差异基因和靶基因取交集得到277 个交叉基因进行GO和KEGG分析。交叉基因主要集中在染色体区域(图5A);核分裂是最主要的生物学过程(图5B),与蛋白质C-末端结合等分子功能有关(图5C)。KEGG结果表明,交叉基因主要集中在细胞周期信号通路中(图5D)。考虑到蛋白质很少单独发挥作用,用富集在该通路的基因进行PPI 网络分析,结果显示CDC20 在CEBPA 靶标中具有最高蛋白相互作用,可能为其靶基因(图5E)。
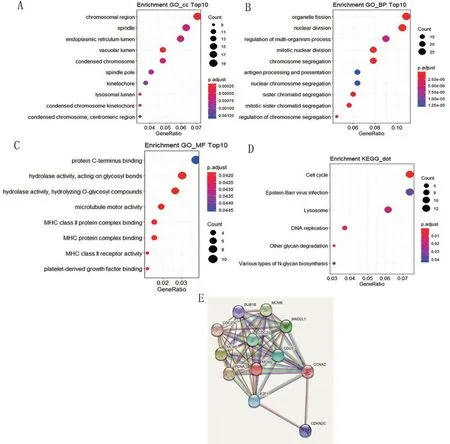
图5 相交基因GO富集分析、KEGG通路的气泡图及富集于细胞周期通路基因的PPI图
3 讨论
第1 个CEBP 蛋 白,即CEBPA 在Steve McKnight 的实验室中被鉴定为大鼠肝核中的热稳定因子[10]。CEBPA是1 个无内含子基因,定位于染色体带19q13.1,具有富含GC 的编码区。它属于碱性粘蛋白拉链(b-ZIP)转录因子家族,由高度同源的C-末端DNA 结合(碱性区)和二聚化(亮氨酸拉链)基序以及两个不太保守的N-末端反式激活域组成,其可以产生两种不同的蛋白质亚型,较长的42 ku 亚型,也称为p42,以及较短的30 ku亚型或p30[11-12]。
本研究首次通过整合芯片和序列数据综合分析研究了CEBPA 的差异表达,同时结合RT-qPCR、IHC 进一步验证CEBPA 在HCC 中的表达情况。在本研究中,通过对芯片数据和序列数据中收集到3 727 例HCC 和3 204 例非癌样本综合分析可知,CEBPA 在HCC组织中的表达水平显著高于非癌组织;RT-qPCR 结果显示CEBPA 在HCC 细胞系Huh7中的表达明显高于正常肝细胞系L02,由于只检测了1株HCC细胞系中CEBPA的表达,有一定的局限性。本实验收集90组肝细胞肝癌和癌旁组织样本,通过IHC 进行蛋白水平的检测,证实了CEBPA 在HCC组织中表达比癌旁组织阳性率高,表明CEBPA在HCC 的鉴别中有一定的价值作用。IHC 结果显示,CEBPA 蛋白主要定位在肿瘤细胞的细胞核中,CEBPA 蛋白的差异表达在HCC 患者病理分级及TNM 分期中的T 分期差异有统计学意义(P<0.05),其中,病理分期Ⅲ~Ⅳ级的患者组织中CEBPA 阳性表达率比Ⅰ~Ⅱ级高。推测CEBPA 可能是HCC的致癌因子,参与HCC的进展和预后,具有一定的临床意义,有望成为肝细胞癌治疗的关键基因之一。通过对CEBPA的共表达基因、差异基因和靶基因取交集基因进行GO 和KEGG 分析,这些基因主要富集在细胞周期等通路。细胞周期的改变在几乎所有的癌症类型中都很常见。CEBPA 通过其协调转录输出和细胞周期进程的能力来控制分化[13],在大部分癌,如在乳腺癌细胞系中恢复CEBPA 表达导致抑制与G0-G1 细胞周期停滞相关的生长[14],在急性髓系白血病中p53-KLF4-CEBPA 调控轴导致细胞周期控制的丧失[15]。这些研究进一步证明了CEBPA 参与肿瘤的发生发展,CEBPA 可能通过细胞周期通路促进HCC的发展。
CEBPA参与正常生理过程和疾病发生发展,在胚胎发生过程中起着重要作用,CEBPA的表达是维持胚胎和成体组织内稳态的基础[16-19]。CEBPA在肝脏、脂肪组织、髓样细胞、皮肤、肺、乳腺、小肠、胰腺、肾上腺、骨骼肌、结肠和前列腺等多种组织和细胞类型中均有表达,但其表达主要见于终末分化细胞[20]。在前列腺癌、B 细胞前体急性淋巴细胞白血病和肝母细胞瘤中,无突变的CEBPA蛋白上调并表现出致癌作用[21-23]。
能量代谢在HCC中具有重要意义,利用癌细胞代谢脆弱的特性寻找相关治疗手段成为肝癌治疗的一种策略,既往研究也证实,CEBPA 也参与HCC中能量代谢,然而,肿瘤的异质性表现出不同的能量代谢需求为肝癌的治疗带来了挑战。C/EBPα 不仅参与肝癌能量代谢,且与肝再生终止的调节和肝大小的调节相关,C/EBPα与C/EBP β相互作用表现出“肝稳态”的复杂现象[24]。本文免疫组化实验结果表明,相对于癌旁肝组织,CEBPA蛋白在HCC组织中显著高表达,既往有研究显示,与HCC 组织微阵列中相邻的非肿瘤肝组织相比,CEBPA蛋白的表达增加,这与本研究结果一致。C/EBPα 将HCC 致癌作用与自噬介导的脂质代谢和对能量饥饿的抵抗联系起来,并且通过分析C/EBPα 在HCC 中的表达预测了患者的预后[8]。研究已经确定实体瘤中C/EBPα 水平调控的多种机制,包括microRNA(miRNA)表达、缺氧和癌基因的转录抑制。寻找C/EBPα上游调控信号通路,以寻找可用药物关键靶点是阻断C/EBPα在肝癌细胞中表达并抑制依赖于其促癌作用的肿瘤生长的有效途径,目前研究显示,miR-182、miR-124、miR-25 等与C/EBPα 表达相关,可能为治疗肝癌提供靶点[25-26]。
综上所述,CEBPA在肝细胞肝癌组织中表达较高,可能参与肝细胞肝癌的发生发展,并作为一种潜在预测因子,为肝细胞肝癌的早期诊断提供新的思路。
