消积通便方对便秘小鼠VIP-cAMP-PKA信号通路的影响
2022-03-19候淑婷
胡 钰,候淑婷
(1.南京中医药大学南通附属医院,江苏 南通 226001;2. 南京中医药大学附属医院,江苏 南京 210029;3. 江苏省儿童呼吸疾病(中医药)重点实验室,江苏 南京 210023)
功能性便秘是儿科常见疾病。Walter等[1]报道斯里兰卡6.5个月~4岁儿童功能性便秘的发病率为8%,陈凌华等[2]报道南充地区0~4岁婴幼儿功能性便秘的发病率为6.2%。白铂亮等[3]综述分析小儿便秘发生率为0.13%~8%,占儿科门诊患儿的3%~5%。功能性便秘的发病原因及发病机制尚不明确,多归结于胃肠动力异常、排便习惯不良、饮食结构不合理等。消积通便方取义于小承气汤,全方由枳实、厚朴、连翘、鸡内金、六神曲、炒决明子、天花粉、胡黄连组成,具有消积导滞、泻热润肠的功效,前期研究显示该方治疗便秘疗效较好[4],但其治疗便秘的具体机制尚不明确。血管活性肠肽(VIP)和一氧化氮(NO)属于抑制性神经递质,可减缓肠道蠕动,参与便秘的发生发展。诱导型一氧化氮合酶(iNOS)与炎症反应有关,其可在相当长时间内稳定合成大量的NO。环磷酸腺苷(cAMP)存在于细胞内,通过与cAMP依赖性的蛋白激酶A(PKA)的结合亚基结合,调节细胞功能活动,发挥相应的生理效应[5-6]。目前研究认为VIP发挥作用与cAMP-PKA信号通路有关[7]。因此,本实验基于VIP-cAMP-PKA信号通路,探讨了消积通便方治疗便秘的可能机制。
1 实验材料与方法
1.1实验动物 SPF级雄性ICR小鼠64只,体重25~28 g,购于杭州医学院实验动物中心,许可证号:SCXK(浙)2019-0002。饲养环境:室温22~24 ℃,相对湿度40%~60%,昼夜节律12 h/12 h。60Co辐照实验鼠维持饲料,自由饮食、饮水,适应性饲养3 d。适应性饲养期间模拟捕捉小鼠,每天1次。本实验经南京中医药大学动物实验伦理委员会审核通过(202010A020)。
1.2实验药物 消积通便方组方:枳实12 g、厚朴10 g、连翘10 g、鸡内金10 g、六神曲10 g、炒决明子10 g、天花粉3 g、胡黄连1 g,药材购于南通市中医院,由重庆三峡学院三峡库区道地药材绿色种植与深加工重庆市工程实验室周浓教授鉴定为合格药材。煎煮方法:加8倍中药量冷水,在锅内浸泡约30 min,大火煎药,待沸腾后文火煎煮30 min后过滤药液;二煎时加6倍量水煎30 min,过滤后将2次药液混合,旋蒸至含生药3 g/mL的溶液,密封于无菌量瓶,-20 ℃储存备用。药物制备符合2020版《中华人民共和国药典(一部)》项下相关标准、规定。盐酸洛哌丁胺(西安杨森制药有限公司,国药准字H0910085)、枸橼酸莫沙必利胶囊(上海新黄河制药有限公司,国药准字H20173152)购自南通市中医院。给药剂量根据《中药药理研究方法学》[8]实验动物与人体临床用药剂量转换公式 (dB是欲求算的B种动物的千克体重剂量、dA是已知A种动物的千克体重剂量;WA和WB是已知动物A,B的体重;RB和RA是A,B动物的体型系数)计算。消积通便方等效剂量即中剂量浓度约为18 g/mL,高剂量组浓度为36 g/mL,低剂量浓度为9 g/mL。洛哌丁胺、莫沙必利等效剂量药物浓度约为10 mg/kg。
1.3试剂和仪器 印度墨水(L17S11G124902,上海源叶生物科技有限公司);小鼠VIP ELISA试剂盒(JEB-12692,全式金生物科技);小鼠iNOS ELISA试剂盒(JEB-12704,全式金生物科技);TRIzol RNA分离试剂(10296028,Thermo scientific公司);EasyScript First-Strand cDNA Synthesis SuperMix(M20427,全式金公司);AceQ Universal SYBR qPCR Master Mix(7E082G6,诺维赞公司);Mouse GAPDH Endogenous Reference Genes Primers,100 μM(B662304-0001,上海生工)。Light cycle 96,混合冷冻混合球磨仪M4M400(德国Retsch公司);Millipore Synergy型超纯水系统(德国Merc公司);Allegra 64R型离心机(美国Beckman Coulter公司);AF103制冰机(美国Scotsman公司);BS224型电子天平(北京塞多利斯仪器系统有限公司);Lightcycle 96 realtime-PCR检测仪(罗氏公司);TaKaRa Thermal Cycler PCR仪(TaKaRa公司)。
1.4实验方法 将64只SPF级雄性ICR小鼠随机分为空白组、模型组、消积通便方低剂量组、消积通便方中剂量组、消积通便方高剂量组、莫沙必利组,每组14只。适应性饲养后,空白组给予0.2 mL/10 g体重生理盐水灌胃,其余各组给予洛哌丁胺10 mg/kg灌胃,均2次/d,共14 d。于实验过程中的第8天开始,消积通便方低、中、高剂量组分别给予9 g/mL、18 g/mL、36 g/mL消积通便方药液灌胃,莫沙必利组给予10 mg/kg莫沙必利灌胃,正常组和模型组给予等量的生理盐水灌胃,灌胃量均为0.2 mL/10 g体重,1次/d,连续7 d。
1.5观察指标及方法
1.5.1一般状态 实验过程中观察各组小鼠毛色、反应灵敏度、精神状态、进食饮水情况、体重等。
1.5.2胃排空率和肠道推进率 各组小鼠于末次灌胃后禁食16 h,自由饮水。每组随机选取6只小鼠灌胃印度墨水,并计时20 min,然后予2%异氟烷吸入诱导麻醉,用颈椎脱臼法处死小鼠,眼底静脉取血后迅速摘除并结扎胃贲门和幽门,取出胃,称量全胃重量,然后沿胃大弯处将胃剖开,PBS液中洗去胃内容物,用滤纸将胃水分吸净,称量空胃重,计算胃排空率[(全胃重-空胃重)/全胃重×100%]。同时迅速取出小肠,无张力拉直后测量印度墨水推进长度(L2),并测量从幽门至盲肠的小肠长度(L1),计算小鼠肠道推进率(L2/L1×100%)。
1.5.3血清VIP和iNOS水平检测 眼底静脉血在室温条件下自然凝固10~20 min,再以3 000 r/min离心20 min左右,分离血清,采用酶联免疫吸附法,按照试剂盒说明书检测血清VIP和iNOS水平。
1.5.4结肠组织HE染色观察 取出结肠后剪取距结肠远端10 mm左右的结肠8~10 mm,将结肠组织放入4%多聚甲醛液中固定24 h以上,然后将结肠组织进行石蜡包埋、切片,常规HE染色,100倍显微镜下观察结肠黏膜上皮的完整情况。
1.5.5结肠组织中PKA和cAMP mRNA表达检测采用RT-PCR法检测:取出-80 ℃保存结肠组织,采用RNA提取试剂盒TRIzol法提取RNA,抽提后稀释RNA,并检测其OD 260/OD 280的比值,比值在1.8~2.2之间即为正常。反转录cDNA:按照PrimeScript RT Reagent Kit with gDNA Eraser(Perfect Real Time)说明书操作,合成cDNA,基因组DNA清除条件:42 ℃,2 min;Store at 4 ℃;反转录条件:42 ℃,15 min;85 ℃,5 s;Store at 4 ℃。将反转录所得的cDNA产物用RNase-free Water稀释10倍后作为模板,配制各组的PCR反应体系(20 μL),GAPDH作为内参,加样完毕后,使用realtime定量PCR仪检测。引物序列:PKA上游引物为5’-CAACAACCGAGTGTGCTTGAT-3’,下游引物为5’-TCATTTGCGATCCGAGTCTGG-3’;cAMP上游引物为5’-GAGCAAGGAACGAGTTACAAAGC-3’;下游引物为5’-TGGACTGTTTCAACGCATCCC-3’。定量PCR条件:95.0 ℃,2 min预变性;95 ℃ 15 s,60 ℃ 34 s,共40个循环。72.0 ℃,30 s获取荧光值。95.0 ℃ 15 s,60.0 ℃ 1 min,95.0 ℃ 15 s,60 s退火。记录CT值,根据文献[9],采用2-ΔΔCT法计算PKA和cAMP mRNA相对表达量。

2 结 果
2.1各组小鼠一般状态 实验过程中,空白组小鼠毛色光亮,反应灵敏,精神状态良好,进食、饮水正常,体重逐步增加。模型组小鼠有不同程度易激惹或倦怠,精神不振,反应迟钝,进食量及饮水量减少,体重增长幅度较小。消积通便方各组及莫沙必利组小鼠精神状态及活动好于模型组,毛色转为光亮顺滑,进食、饮水量渐增,体重增长幅度明显大于模型组小鼠。
2.2各组小鼠胃排空率和肠道推进率比较 与空白组比较,模型组小鼠胃排空率明显增高(P<0.05),肠道推进率明显降低(P<0.05);与模型组比较,消积通便方各组及莫沙必利组小鼠胃排空率均明显降低(P均<0.05),消积通便方中、高剂量组及莫沙必利组小鼠肠道推进率均明显增高(P均<0.05),消积通便方低剂量组小鼠肠道推进率无明显变化(P>0.05)。见图1。
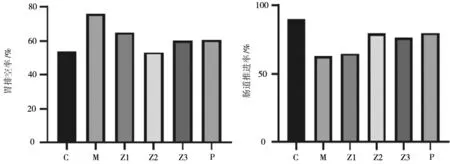
C为正常组;M为模型组;Z1为消积通便方低剂量组;Z2为消积通便方中剂量组;Z3为消积通便方高剂量组;P为莫沙必利组图1 空白组和便秘各组小鼠胃排空率和肠道推进率
2.3各组小鼠血清VIP、iNOS水平比较 与空白组比较,模型组小鼠血清VIP、iNOS水平均明显升高(P均<0.05);与模型组比较,消积通便方各组及莫沙必利组小鼠血清VIP、iNOS水平均明显降低(P均<0.05)。见图2。
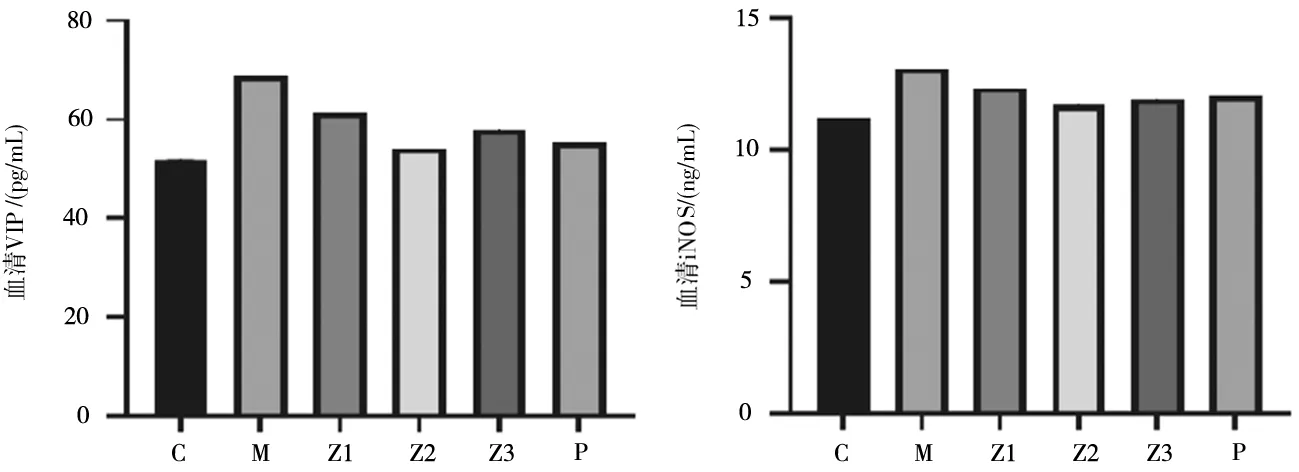
C为正常组;M为模型组;Z1为消积通便方低剂量组;Z2为消积通便方中剂量组;Z3为消积通便方高剂量组;P为莫沙必利组图2 空白组和便秘各组小鼠血清 VIP、iNOS水平
2.4各组小鼠结肠组织HE染色情况 HE染色见模型组小鼠结肠组织黏膜层部分缺失,固有层及黏膜下层可见炎性细胞浸润聚集,肌层明显变薄;消积通便方各组及莫沙必利组小鼠结肠组织黏膜层上皮细胞破损、缺失及固有层、黏膜下层炎性细胞浸润、肌层变薄等情况明显减轻,以消积通便方中、高剂量组改善明显。见图3。

图3 空白组和便秘各组小鼠结肠组织HE染色表现(×100)
2.5各组小鼠结肠组织中PKA和cAMP mRNA表达量比较 与空白组比较,模型组小鼠结肠组织中PKA和cAMP mRNA表达量均明显降低(P均<0.05);与模型组比较,消积通便方高剂量组及莫沙比利组小鼠结肠组织中PKA和cAMP mRNA表达量均明显增高(P均<0.05),消积通便方低、中剂量组变化不明显(P均>0.05)。见图4。

C为正常组;M为模型组;Z1为消积通便方低剂量组;Z2为消积通便方中剂量组;Z3为消积通便方高剂量组;P为莫沙必利组图4 空白组和便秘各组小鼠结肠组织中PKA和cAMP mRNA相对表达量
3 讨 论
随着现代社会饮食结构及生活方式的改变,功能性胃肠道疾病如便秘的发病率不断增高[10]。Saps等[11]应用罗马Ⅳ标准评估拉丁美洲3 567名8~18岁儿童功能性胃肠道疾病的患病率为21.2%,其中排便障碍的比例为10.7%。相关研究显示,抑制性神经递质VIP可以松弛胃肠道平滑肌,抑制胃肠蠕动,降低胃肠道黏膜的分泌功能[12]。NO可舒张肠道平滑肌,减缓肠道运动[13]。VIP常与NO协同发挥抑制胃肠道的作用而引发便秘[14]。
中医认为小儿脾常不足,长期乳食过量,积滞蕴于胃肠,阻碍脾胃气机升降,肠腑糟粕难以排出而发生便秘。在临床诊疗中,食积内热型便秘发生率约占45.16%[15]。赵霞等[4]运用导滞润肠泻热之消积通便方治疗小儿食积内热证便秘疗效满意。消积通便方中枳实、厚朴为君药,枳实味苦、辛,性微寒,功能破气消积、化痰除痞,有调节VIP分泌,增强小肠传导动力的作用[16-17];厚朴味苦、辛,性温,其下气消积之功与调节NO的分泌,促进胃部蠕动有关[18]。臣药连翘清热解毒、消肿散结,具有调节胃肠激素分泌,双向调节胃肠动力的作用[19];臣药炒决明子清肝明目、润肠通便,能够改善小鼠结肠运动功能[20]。佐以天花粉清热泻火、生津止渴、消肿排脓,六神曲、鸡内金健脾和胃、消积导滞,胡黄连清导肠道湿滞。本实验结果显示,模型组小鼠胃排空率及血清VIP、iNOS水平均明显增高,肠道推进率明显降低,HE染色显示结肠黏膜固有层及黏膜下层可见炎性细胞浸润;与模型组比较,消积通便方中、高剂量组及莫沙必利组小鼠胃排空率及血清VIP、iNOS水平均明显降低,消积通便方高剂量组和莫沙必利组小鼠肠道推进率均明显升高,HE染色显示消积通便方中、高剂量组及莫沙必利组小鼠结肠组织损伤明显减轻。推测消积通便方治疗便秘的机制与调节胃肠道神经递质的分泌水平有关。
cAMP为细胞内第二信使,当细胞外第一信使含氮激素的信息传递到细胞内后,cAMP通过与cAMP 依赖性的PKA结合亚基结合转移至细胞核内,从而调节细胞的功能活动[5-6]。目前研究发现,VIP和胃肠道平滑肌细胞表面的特异性VIP受体结合后,将信号传递至胃肠道平滑肌细胞内,激活cAMP-PKA信号通路,使得Ca2+内流相应减少,胃肠道平滑肌舒张,导致便秘的发生[21-22]。本实验结果显示,模型组小鼠结肠组织中PKA mRNA、cAMP mRNA表达量均较空白组明显降低,消积通便方高剂量组和莫沙必利组小鼠结肠组织中PKA mRNA、cAMP mRNA表达量均较模型组明显增高。提示消积通便方可以激活cAMP-PKA通路。
综上所述,消积通便方可能通过下调VIP、iNOS水平及激活cAMP-PKA通路,从而调节肠道平滑肌的活动,促进肠道蠕动,修复受损的结肠组织黏膜,缓解便秘症状。但是消积通便方治疗便秘的分子机制还不清楚,有待进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
