益气化痰活血法对血脂异常痰浊阻遏证小鼠动脉粥样硬化相关炎性因子IL-6、TNF-α表达的影响
2022-03-19薛晓琳赵瑞珍
陈 婧,薛晓琳,叶 超,杨 正,张 珊,马 迪,王 悦,邓 斌,赵瑞珍
(1. 北京中医药大学第三附属医院,北京 100029;2. 北京中医药大学中医学院,北京 100029;3. 北京中医药大学东直门医院,北京 100700)
随着人们生活水平提高,饮食结构发生变化,血脂异常的患病人群在不断增加。血脂异常已成为多种心血管疾病的诱因,脂质水平升高使得脂质沉积于动脉内皮下,与此同时被平滑肌、巨噬细胞等吞噬形成泡沫细胞[1],迁移至内膜下,是动脉粥样硬化形成的首要危险因素[2],可通过诱导局部炎症反应损伤血管内皮细胞等促进动脉粥样硬化的进展[3]。动脉粥样硬化是活跃的炎症过程,其包含了脂质浸润的过程和内皮细胞损伤修复的过程[4]。在炎症过程中,动脉粥样硬化处广泛存在的T淋巴细胞会促进巨噬细胞分泌大量促炎症细胞因子,如白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)[5]。痰浊阻遏证是血脂异常疾病的代表性证候[6],TNF-α水平结合临床症状、血脂检查,有可能成为预测血脂异常痰浊阻遏证患者心脑血管疾病风险的参考指标之一[7]。前期研究发现,益气化痰活血法代表方剂调脂通脉颗粒可通过降低富含三酰甘油脂蛋白残粒的水平,减少细胞黏附分子表达,延缓动脉粥样硬化进展[8]。但该方剂对于血脂异常痰浊阻遏证动脉粥样硬化相关炎性因子IL-6、TNF-α表达是否有干预作用尚未可知,因此本课题组基于前期研究基础,应用ApoE基因敲除小鼠作为研究对象,采用多因素复合建模的方法构建血脂异常-痰浊阻遏证模型,探讨不同浓度的调脂通脉颗粒对IL-6、TNF-α表达的影响,以期为益气化痰活血法抑制血脂异常痰浊阻遏证所致的动脉粥样硬化过程提供实验依据。
1 实验材料与方法
1.1实验动物 ApoE基因敲除雄性小鼠24只, 6周龄,体重(20±5)g,由北京市昌扬西山养殖场提供,动物使用许可证号:SYXK(京)2016-0021。实验过程中对动物的处置方法按照2006年科学技术部发布的《关于善待实验动物的指导性意见》的相关要求。
1.2造模饲料 由北京科澳协力饲料有限公司提供的高脂饲料。
1.3药物及主要试剂 调脂通脉颗粒由太子参、丹参、赤芍、红花、草决明、黄芩、地龙、清半夏、陈皮、茯苓、泽泻、山楂等组成,由北京中医药大学第三附属医院药房制作为颗粒剂,其中4 g/(kg·d)为人鼠剂量换算方法换算的小鼠与60 kg 成人的等效剂量。小鼠IL-6、TNF-α检测ELISA试剂盒(Raybio)。
1.4实验方法 对所有ApoE基因敲除小鼠首先进行1周普通饲料适应性喂养,然后喂养高脂饲料4周完成血脂异常痰浊阻遏证小鼠的模型制作。将造模完成的ApoE基因敲除小鼠随机分为4组,每组6只。参照文献[9]方法,调脂通脉颗粒低、中、高剂量组分别给予2 g/(kg·d)、 4 g/(kg·d)、8 g/(kg·d)的调脂通脉颗粒灌胃,模型组给予等量的生理盐水灌胃,均1次/d,连续灌胃4周[9]。灌胃过程中给予高脂饲料喂养。
1.5检测指标 各组小鼠灌胃4周后,禁食不禁水12 h,腹腔麻醉,摘眼球取血1~2 mL,加入抗凝管中,室温静置2 h,4 ℃下1 500 r/min离心(离心半径8 cm)10 min,分离血清后分装,迅速至-80 ℃冰箱保存。严格按照ELISA试剂盒说明步骤检测血清IL-6、TNF-α水平。
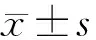
2 结 果
2.1一般情况 本研究纳入的ApoE基因敲除小鼠实验过程中无死亡及脱失。
2.2各组血清IL-6、TNF-α水平比较 各组血清IL-6、TNF-α水平比较差异均有统计学意义(P均<0.05)。随着调脂通脉颗粒剂量的增加,血清IL-6、TNF-α水平依次下降;调脂通脉颗粒高剂量组血清IL-6水平均明显低于模型组、调脂通脉颗粒低剂量组、调脂通脉颗粒中剂量组(P均<0.05),调脂通脉颗粒高剂量组血清TNF-α水平明显低于模型组、调脂通脉颗粒低剂量组(P均<0.05);调脂通脉颗粒低、中剂量组与模型组比较,调脂通脉颗粒低剂量组与调脂通脉颗粒中剂量组比较,血清IL-6和TNF-α水平差异均无统计学意义(P均>0.05)。见表1。
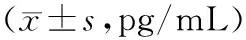
表1 各组血脂异常痰浊阻遏证小鼠血清IL-6、TNF-α水平比较
3 讨 论
血管内皮是血液与血管壁之间的屏障,具有多种功能,如合成和释放血管活性因子、调节血管收缩与舒张等[10]。动脉粥样硬化是动脉壁对内皮细胞损伤的炎症反应,内皮功能损害是一个始动因素[11],炎症处于动脉粥样硬化过程的始终[12],血脂异常是动脉粥样硬化所致内皮功能障碍过程中重要的危险因素。
动脉粥样硬化是血管炎症,多种刺激对于血管内皮的损伤可致内皮功能紊乱,分泌的细胞因子导致泡沫细胞迁移,形成动脉粥样硬化斑块,造成动脉管腔狭窄[13]。其中炎症作用产生依赖于促炎因子的作用,如TNF-α、IL-6等的产生和释放与动脉粥样硬化的形成和进展密切相关[14]。Ross[15]在1999年提出:动脉粥样硬化是慢性炎症性的脂类在血管内皮下沉积的代谢疾病,因此对于血脂异常疾病中相关炎性因子特点的研究,对于防治血脂异常所致的动脉粥样硬化具有重要的意义。
痰浊阻遏证是血脂异常疾病的主要证候之一。痰浊是血脂异常疾病代表性的中医致病因素。嗜甘少动,体肥形胖,痰浊内停,气机郁滞,血脉不畅,凝结脉络,导致动脉粥样硬化。值得关注的是,血脂异常引发动脉粥样硬化过程中可能出现“由痰致瘀”的证候变化。水湿代谢失常,痰浊内生,阻血隔液,瘀血内停,终致痰浊瘀血互结。临床观察发现血瘀证候的出现往往在痰浊证候之后,从另一个角度印证了“久病皆瘀”的理论[16]。由此可知,益气化痰活血法切合该病的核心病机。课题组前期研究发现,血脂异常痰浊阻遏证患者ONOO-浓度可以在一定程度上反映该证候的严重程度[17],ONOO-通过蛋白质氧化反应引起血管内皮的损伤[18]。因此从血管内皮相关指标进行血脂异常痰浊阻遏证的深入研究具有可行性。
调脂通脉颗粒以太子参益气健脾,补而不燥;以丹参、赤芍、红花、山楂清热散瘀,活血通经;以茯苓化痰利水、健脾渗湿;以清半夏、陈皮燥湿化痰,理气和中;以决明子利水通便,以泽泻利湿化浊;全方以益气健脾、化痰降浊、活血化瘀为大法,使得脾气得补,痰浊得化,瘀血得行。既往临床研究发现,应用调脂通脉颗粒对老年高血脂症痰瘀证进行治疗,不仅可改善血脂指标,还能降低动脉硬化指数[19]。动物研究发现,调脂通脉颗粒能降低高脂饲料造模后ApoE基因敲除小鼠血清三酰甘油(TG)及可溶性细胞间黏附分子-1(sICAM-1)、可溶性血管细胞黏附分子-1(sVCAM-1)水平,从而减缓动脉粥样硬化的病变[20]。本研究应用高脂饲料复制血脂异常痰浊阻遏证的病-证动物模型,观察不同浓度调脂通脉颗粒对ApoE基因敲除小鼠血清IL-6、TNF-α水平的影响,深入探讨调脂通脉颗粒对血脂异常痰浊阻遏证小鼠动脉粥样硬化的干预作用。
IL-6为炎症反应的递质,是动脉粥样硬化中的炎症标志物,可由血管内皮细胞产生,参与动脉粥样硬化的形成和发展[21-22],能产生并促进慢性炎症反应[23],其在动脉粥样硬化动物动脉内膜中的浓度高于正常动物[24]。本实验结果显示,应用调脂通脉颗粒灌胃后,随着药物浓度增加,血清IL-6水平逐渐降低,调脂通脉颗粒高剂量组明显低于模型组、调脂通脉颗粒低剂量组、调脂通脉颗粒中剂量组,但调脂通脉颗粒低、中剂量组与模型组比较未见统计学差异。说明高剂量调脂通脉颗粒可明显降低血清IL-6水平,在治疗时,对于血清IL-6水平起到明显作用时需要调高使用剂量。
TNF-α主要由活化的巨噬细胞分泌,能加快内皮细胞损伤,参与动脉粥样硬化炎症,促进动脉粥样硬化进展[25-27]。本实验结果显示,应用调脂通脉颗粒灌胃后,随着药物浓度增加,血清TNF-α水平逐渐降低,调脂通脉颗粒高剂量组明显低于模型组和调脂通脉颗粒低剂量组,但调脂通脉颗粒中剂量组和调脂通脉颗粒高剂量组比较未见明显统计学差异。说明调脂通脉颗粒可降低血清TNF-α水平,但调脂通脉颗粒浓度提高并不会进一步降低血清TNF-α水平。
综上所述,调脂通脉颗粒可抑制血脂异常痰浊阻遏证小鼠血清IL-6、TNF-α表达,可以减轻血管内皮炎症反应;高剂量调脂通脉颗粒可更有效降低血清IL-6水平,而TNF-α水平下降对药物浓度的依赖程度不大。由于本次研究样本量较小、检测指标较少等不足,未能明确调脂通脉颗粒的具体作用机制,有待做进一步研究。
利益冲突:所有作者均声明不存在利益冲突。
