纳达合剂对胆汁反流性胃炎大鼠ROS-NLRP3通路的影响
2022-03-19阙任烨沈艳婷林柳兵
阙任烨,沈艳婷,林柳兵,李 勇
(上海中医药大学附属市中医医院,上海 200071)
胆汁反流性胃炎是由于多种原因导致十二指肠胃反流现象异常增多,引起胃黏膜损伤的一种疾病[1]。纳达合剂是上海中医药大学附属市中医医院余莉芳老中医拟定的经验方,功效为养阴清胃、降逆理气,广泛应用于慢性胃炎患者,包括慢性浅表性胃炎、胆汁反流性胃炎、非溃疡性消化不良等[2]。本课题组前期研究发现纳达合剂不仅具有显著的促胃肠动力作用及免疫调节作用[3-5],还具有显著的胃黏膜保护作用,其机制可能与抑制线粒体损伤引起的胃黏膜细胞凋亡有关[6-7]。不仅如此,纳达合剂亦能够显著抑制炎症因子的合成与分泌,减轻胃黏膜炎症[8],但其作用机制尚不明确。NLRP3炎性体和炎症性疾病的关系已被日益增多的研究所报道,但其在胆汁反流性胃炎中所扮演的角色至今尚未阐明。因此,为了深入探讨纳达合剂抑制胃黏膜炎症的作用机制,本研究通过大鼠胆汁反流性胃炎模型,观察了纳达合剂对活性氧(ROS)及其下游NLRP3炎性体表达的影响。
1 实验材料与方法
1.1实验动物 清洁级雄性SD大鼠60只,体重180~220 g,购自上海实验动物中心。动物合格证号:(20170005031492)。清洁级动物房饲养,恒温(25±2)℃恒湿,人工光照12 h、黑暗12 h,自由进食饮水。
1.2药物、试剂与仪器 纳达合剂(上海市中医医院制剂科提供,由北沙参、玉竹、天花粉、麦冬、制半夏、广木香、枳壳、延胡索、代赭石、黄连、黄芩、蒲公英、芙蓉叶、甘草等组成),麦滋林(日本寿制药株式会社);牛胆酸钠(上海源叶生物科技有限公司),胰酶(国药集团化学试剂有限公司),卵磷脂(国药集团化学试剂有限公司);NLRP3、凋亡相关斑点样蛋白(ASC)抗体(Santa Cruz公司),β-actin、炎性半胱天冬酶-1(Caspase-1)、山羊抗兔HRP标记二抗、山羊抗鼠HRP标记二抗(Cell signaling公司),NLRP3、ASC、Caspase-1引物(上海生工生物公司),TRIzol试剂、反转录试剂盒、SybrGreen Real-time PCR Master Mix(Takara公司),ECL化学发光试剂盒(Millipore公司),蛋白质分子量预染Marker、MitoSOX Red线粒体ROS检测试剂盒(Thermo scientific公司),组织线粒体分离试剂盒(碧云天公司),大鼠白细胞介素-1β (IL-1β)、白细胞介素-18 (IL-18) ELISA试剂盒(上海西唐公司)。Neofuge 15R型台式高速冷冻离心机(Heal force公司),Var10skan Flash荧光酶标仪(Thermo scientific公司),Wellwash 4mk2型洗板机(Labsystems dragon公司),JX-FSTPRP-48型电动匀浆机(上海净信公司),微型垂直电泳、电转移系统、ChemiDocTM XRS+自动显影系统、CFX96TM Real-Time system、S1000TM Thermal cycler(Bio-Rad公司)。
1.3药物配制 ①反流液的配制:将牛胆酸钠5 g、胰酶3 g、卵磷脂0.5 g溶于双蒸水200 mL中,充分搅拌并混匀,现用现配。②纳达合剂的配制:纳达合剂以临床成人用量的5倍、10倍、15倍浓缩成低、中、高剂量,现用现配。③麦滋林的配制:将1袋(0.67 g)麦滋林溶于30 mL生理盐水中,配制成约22 mg/mL的麦滋林药液,现用现配。
1.4实验方法 根据大鼠体重将其随机分为6组,每组10只。对照组给予生理盐水15 mL/kg灌胃8周,模型组和各药物组给予反流液15 mL/kg灌胃8周;从第5周开始,对照组和模型组给予生理盐水15 mL/kg灌胃,纳达低、中、高剂量组分别给予12.75 g生药/kg、25.5 g生药/kg、38.25 g生药/kg纳达合剂灌胃,麦滋林组给予0.33 g/kg麦滋林药液灌胃,均1次/d,连续4周。
1.5检测指标及方法
1.5.1线粒体分离及ROS检测 实验结束后,麻醉处死各组大鼠,剪取50 mg新鲜胃组织(于冰上保存),PBS洗涤后用剪刀剪碎;加入500 μL 4 ℃的含PMSF的线粒体分离试剂A后电动匀浆,60 s/次,共3次;将匀浆于4 ℃下600×g离心5 min后将上清液吸至新的EP管中,再4 ℃下11 000×g离心10 min,取沉淀物;将分离的线粒体重悬于40 μL的线粒体贮存液中;在黑色96孔板中毎孔加入300 μL MitoSOX探针工作液及10 μL重悬的线粒体,37 ℃避光孵育30 min;用HBSS/Ca/Mg溶液洗涤3次,加入适量缓冲液,用荧光酶标仪检测,将激发光与发射光分别设置为510 nm及580 nm波长。
1.5.2胃黏膜组织中NLRP3、ASC、Caspase-1 mRNA表达检测 采用Real-time PCR法检测:取适量大鼠胃黏膜组织,加入TRIzol研磨离心取上清,提取总RNA,Nanodrop2000检测RNA的纯度和浓度,各组取2 μL总RNA,按20 μL总反应体积,反转录为cDNA,然后以cDNA为模板分别进行PCR扩增,引物序列:NLRP3上游5’-CGG TGA CCT TGT GTG TGC TT-3’,下游5’-TCA TGT CCT GAG CCA TGG AAG-3’;ASC上游 5’-AGA CAT GGG CAT ACA GGA GC-3’,下游5’-GCAATGAGT GCT TGC CTG TG-3’;Caspase -1上游5’-GAA CAA AGA AGG TGG CGC AT-3’,下游5’-AGA CGT GTA CGA GTG GGT CT-3’;β-actin上游5’-TTG TAA CCA ACT GGG ACG ATA TGG-3’,下游5’-GAT CTT GAT CTT CAT GGT GCT AGG-3’。采用三步法进行PCR扩增,反应结束后,得到各样本Ct值,然后利用2-△△Ct计算各组基因的相对表达量。
1.6胃黏膜组织中NLRP3、ASC、Caspase-1蛋白表达检测 采用Western blot法检测:取大鼠胃黏膜组织,裂解后提蛋白,使用BCA蛋白试剂盒检测蛋白含量。以SDS-PAGE凝胶(5%浓缩胶,12%分离胶)进行电泳分离胶分离蛋白,并通过半干转法转移至PVDF膜,PVDF膜经5%的脱脂奶粉摇床上慢摇2 h封闭,分别与NLRP3抗体、ASC抗体、Caspase-1抗体、β-actin抗体4 ℃过夜,室温孵育二抗2 h,ECL光化学显色。 最后应用Image J分析软件对扫描条带进行定量分析,计算各蛋白相对表达量。

2 结 果
2.1各组大鼠胃黏膜线粒体ROS含量比较 模型组大鼠胃黏膜线粒体ROS含量显著高于对照组(P<0.05);麦滋林组和纳达低、中、高剂量组大鼠胃黏膜线粒体ROS含量均显著低于模型组(P均<0.05),且纳达各组ROS含量呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见图1。
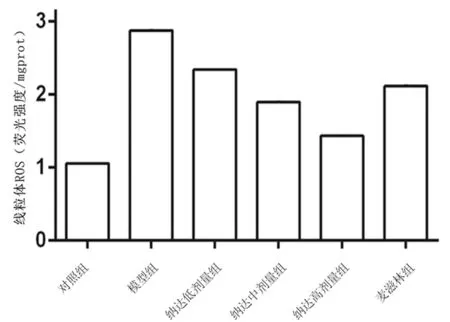
图1 对照组和胆汁反流性胃炎各组大鼠胃黏膜线粒体ROS含量比较(10只/组)
2.2各组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1 mRNA表达量比较 模型组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1 mRNA相对表达量均显著高于对照组(P均<0.05);麦滋林组和纳达低、中、高剂量组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1 mRNA相对表达量均显著低于模型组(P均<0.05),且纳达各组各指标呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见图2。
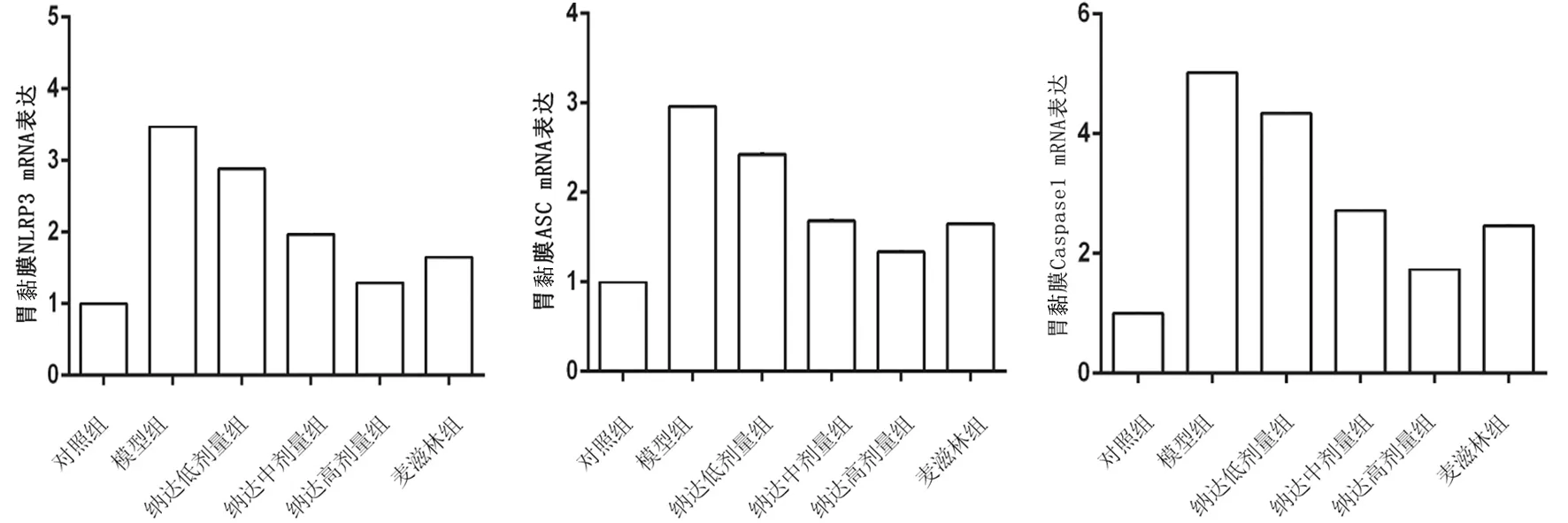
图2 对照组和胆汁反流性胃炎各组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1 mRNA表达情况(10只/组)
2.3各组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1蛋白表达情况 模型组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1蛋白相对表达量均显著高于对照组(P均<0.05);麦滋林组和纳达低、中、高剂量组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1 蛋白相对表达量均显著低于模型组(P均<0.05),且纳达各组各指标呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见图3。
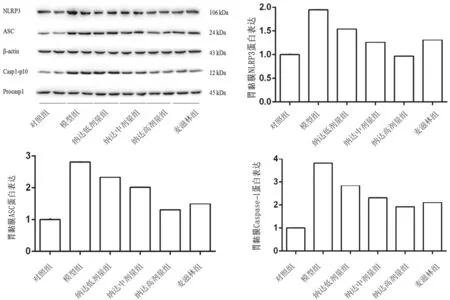
图3 对照组和胆汁反流性胃炎各组大鼠胃黏膜组织中NLRP3、ASC、Caspase-1 蛋白表达情况(10只/组)
2.4各组大鼠胃黏膜组织中IL-1β、IL-18含量比较 模型组大鼠胃黏膜组织中IL-1β、IL-18含量均显著高于对照组(P均<0.05);麦滋林组和纳达低、中、高剂量组大鼠胃黏膜组织中IL-1β、IL-18含量均显著低于模型组(P均<0.05),且纳达各组各指标呈剂量依赖性降低,两两比较差异均有统计学意义(P均<0.05)。见图4。
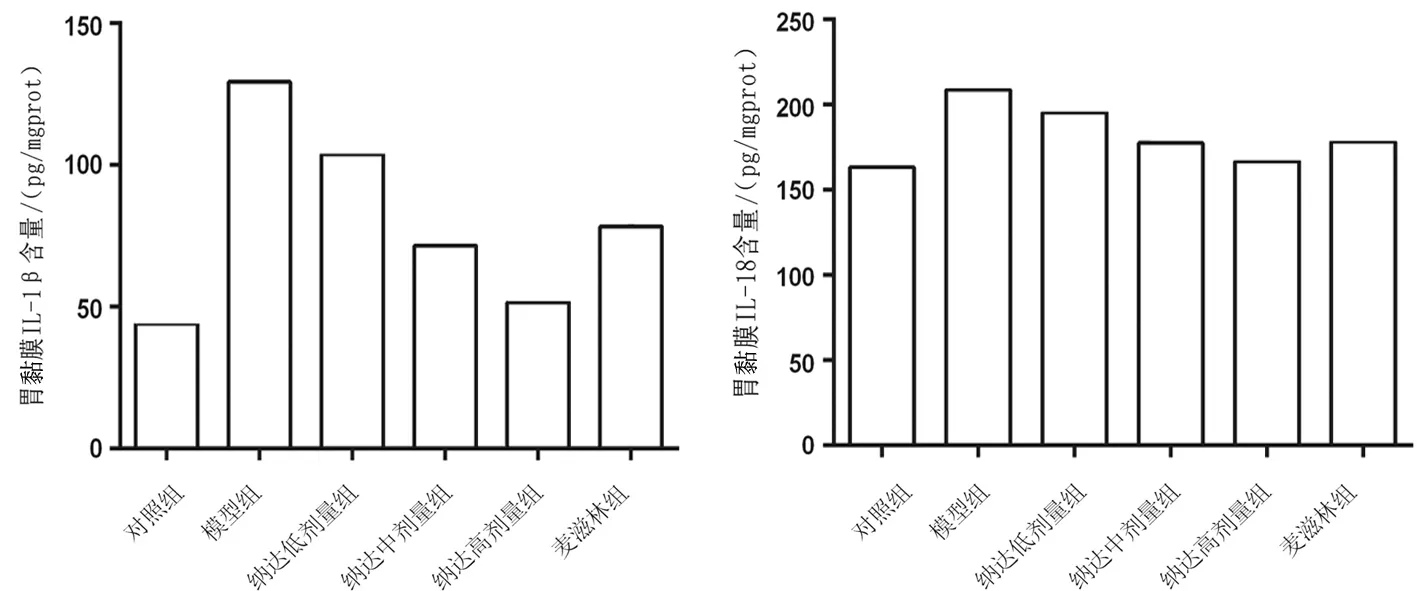
图4 对照组和胆汁反流性胃炎各组大鼠胃黏膜组织中IL-1β、IL-18含量比较(10只/组)
3 讨 论
炎性体由Nod样受体(Nod-like receptors,NLR)家族的部分成员(NLRP1、NLRC4、NLRP3、NAIP5和NLRC5)组成,它通过参与炎症的发生发展及调控细胞存活对机体固有免疫和炎症性疾病发挥十分重要的调节作用,是目前炎症性疾病研究领域的焦点和热点。其中NLRP3炎性体是一类相对分子质量约为70万的大分子蛋白复合体,由NLRP3、ASC和Caspase-1组成,具有感受内外源性伤害性刺激的能力,可对多种理化刺激发生应答,是目前报道最多、最为重要的炎性体之一。NLRP3炎性体通过激活Caspase-1,诱导IL-1β和 IL-18的切割和释放,进而引起一系列生物学反应,参与机体的固有免疫反应,并且介导宿主细胞形成细胞膜微孔,导致细胞肿胀和渗透性溶解,形成一种介于坏死和凋亡之间的细胞死亡形式,称为“pyroptosis”[9]。与凋亡不同,pyroptosis依赖于Caspase-1的激活,其特征为细胞膜上形成微孔和囊泡,细胞肿胀、破裂,分泌促炎症反应细胞因子和释放细胞质成分至细胞外而引起炎症反应,是促炎症反应的细胞死亡方式。
目前提出的NLRP3 炎性体活化途径主要有3种:第一,钾离子的外流。细胞外ATP通过激活质膜上的P2X7嘌呤能受体,诱导与其相关的离子通道开放,促使K+流向膜外,Ca2+流向膜内,开放质膜表面与缝隙连接蛋白Pannexin-1相关的跨膜通道,使相应配体转运至胞质活化NLRP3 炎性体[10]。第二,溶酶体破坏。晶体类成分吞噬入细胞后,可损伤溶酶体,另其中所含的组织蛋白酶B游离至细胞质中,经由一定的方式活化NLRP3炎性体。但是此机制仅对晶体有特异性,ATP与细菌毒素介导的炎性小体激活并不是依赖溶酶体的破坏[11]。第三,线粒体ROS生成。所有已知的NLRP3 炎性体激活剂都能导致ROS 的生成。有研究表明,活化NLRP3炎性体的关键信号ROS是由线粒体损伤后产生的[12]。目前,线粒体ROS激活NLRP3炎性体的过程已被许多动物模型(结肠炎、间质性肾炎)[13-14]及细胞模型(巨噬细胞、支气管上皮细胞)[15-16]所证实,线粒体ROS生成是NLRP3炎性体活化的最主要途径。
目前研究发现,NLRP3炎性体的激活在非酒精性脂肪性肝炎(NASH)、酒精性脂肪性肝炎(ASH)、肝脏缺血再灌注损伤、药物性肝损伤及肝纤维化等急慢性肝脏疾病的发生发展过程中具有关键的作用[17-21]。Cronstein等[22]发现,在痛风发病的过程中,晶体激活NLRP3炎性体,产生IL-1β,导致中性粒细胞向滑膜以及关节液中聚集。Heneka等[23]研究发现,在小鼠阿尔茨海默病(AD)模型中,NLRP3基因敲除后,β-淀粉样蛋白沉积显著减少,小鼠的空间记忆能力得到改善。Parajuli 等[24]报道,AD的发生机制可能与NLRP3活化后引发的炎性反应和脑组织损伤相关。Duewell等[25]报道,动脉粥样硬化(AS)斑块中的胆固醇结晶可诱导NLRP3的激活,导致IL-1β的成熟与分泌,而在AS始动环节中IL-1β具有重要作用。Yang等[26]发现,在2型糖尿病中胰岛淀粉样多肽能直接活化NLRP3 炎性小体,其诱使巨噬细胞释放IL-1β,从而造成炎症反应。Takahashi等[27]发现,受损心肌细胞可以通过释放ATP,进而激活NLRP3炎性小体,促使IL-1β和IL-18的释放,引起心肌的炎性损伤。然而,现阶段线粒体ROS-NLRP3信号通路在胃黏膜炎症中所起的作用仍处于空白阶段。
纳达合剂方中北沙参益胃生津,玉竹滋阴润燥、生津止渴,麦冬滋养胃阴、生津,天花粉清热、生津,四味共用为君药,起濡养阴液、清热养胃之功效;胃以通为顺,故方中用制半夏降逆和胃,代赭石重镇降逆,枳壳理气宽中、行滞消胀,广木香行气止痛、健脾和胃,延胡索疏肝理气、活血止痛,五药共为臣药,达补而不腻之功效;气郁化热,热者寒之,故方选黄连、黄芩、蒲公英等苦寒之物共为佐药,以清胃中郁热;甘草为使,调和诸药。诸药配伍,濡养胃阴、通降气机、清解郁热,集润、行、降、化、清于一炉,临床用于治疗胆汁反流性胃炎效果满意。本研究利用胆汁反流性胃炎大鼠模型,探讨了线粒体ROS-NLRP3信号通路介导的胃黏膜炎症反应机制以及纳达合剂的干预作用,进一步发掘纳达合剂抑制炎症作用的新机制。
本实验结果显示,模型组大鼠胃黏膜线粒体ROS含量,胃黏膜组织中NLRP3、ASC、Caspase-1 mRNA和蛋白表达量,胃黏膜组织中IL-1β、IL-18含量均显著高于对照组,提示ROS-NLRP3通路介导胆汁反流性胃炎的胃黏膜炎症反应;纳达各剂量组上述各指标均显著低于模型组,提示纳达合剂可以显著抑制ROS-NLRP3通路,这可能是其抑制胃黏膜炎症的重要机制。本研究不仅对胆汁反流性胃炎的发病机制作出一定的探索,并且为中药复方纳达合剂的临床应用提供了现代分子生物学基础。
利益冲突:所有作者均声明不存在利益冲突。
