白蛋白结合型紫杉醇联合PD-1抑制剂治疗非小细胞肺癌的效果研究
2022-03-18周爱军王春凤
徐 肖,周爱军,王春凤
(北京市昌平区医院,北京 102200)
肺癌是一种发病率和致死率较高的恶性肿瘤。此病可分为小细胞肺癌和非小细胞肺癌,其中非小细胞肺癌占绝大多数。多数非小细胞肺癌患者的病情在得到确诊时已发展至中晚期,错失了手术治疗的最佳时机,导致其预后不佳。以往临床上对中晚期非小细胞肺癌患者主要是进行化疗、放疗等。对此病患者进行化疗或放疗虽然能在一定程度上延长其生存期,但其不良反应较多,痛苦较大,可影响其对治疗的依从性及生存质量[1]。近年来,临床上对非小细胞肺癌患者进行细胞免疫治疗,取得了较好的疗效。对此病患者进行细胞免疫治疗可激活其机体的免疫系统,稳定免疫内环境,有利于延长其带瘤生存的时间[2]。白蛋白结合型紫杉醇是利用先进的纳米技术制成的一种新型的紫杉醇类化疗药物。应用此药时,无需使用助溶剂蓖麻油,在用药前无需进行相应的预处理,能显著减少患者用药后的不良反应,且有利于肿瘤细胞摄取白蛋白,使肿瘤细胞内的药物浓度显著提高[3-4]。本文主要是探讨用白蛋白结合型紫杉醇联合程序性死亡受体1(PD-1)抑制剂治疗非小细胞肺癌的效果及对患者细胞免疫指标及血清炎性因子水平的影响。
1 资料与方法
1.1 一般资料
选择我院2019 年1 月至2020 年4 月收治的40 例非小细胞肺癌患者作为研究对象。其纳入标准是[5]:进行肺部影像学检查提示肺部存在占位性病变,经病理学检查被证实患有中晚期非小细胞肺癌;预计的生存期≥6 个月;存在不同程度的咳嗽、咳痰、胸闷、乏力等表现;沟通能力正常,无认知功能异常或精神障碍;自愿参与本研究。其排除标准是:存在严重的肝肾功能障碍;合并有慢性或急性炎症性疾病、病毒性肝炎、自身免疫性疾病、艾滋病或其他恶性肿瘤;合并有肺结核、肺部感染等其他肺部疾病;存在精神障碍或认知功能异常;同期参与其他临床试验;对本研究不配合或中途退出本研究。按照随机排列法将其分为单一组(n=20)和联合组(n=20)。在单一组患者中,有男12 例,女8 例;其年龄为39 ~68 岁,平均年龄为(55.64±4.23)岁;其中,肺鳞状细胞癌(鳞癌)、肺腺癌患者分别有12 例、8 例;接受过一线化疗、二线化疗的患者分别有9例、11 例。在联合组患者中,有男9 例,女11 例;其年龄为40 ~69 岁,平均年龄为(55.66±4.35)岁;其中,肺鳞癌、肺腺癌患者分别有9 例、11 例;接受过一线化疗、二线化疗的患者分别有13 例、7 例。两组患者的一般资料相比,差异无统计学意义(P>0.05)。本研究已通过我院医学伦理委员会的批准(审批号:IRB-2020-289)。
1.2 方法
用白蛋白结合型紫杉醇(生产厂家:石药集团欧意药业有限公司;批准文号:国药准字H20183044 ;规格:100 mg/ 支)对单一组患者进行治疗,方法是:每21 d 为1 个化疗周期,在每个化疗周期的第1 天、第8 天及第15 天,分别为患者静脉滴注100 mg/m2的此药,在30 min 内滴注完毕,共治疗2 个周期。用白蛋白结合型紫杉醇(其药品信息及用法同上)联合PD-1 抑制剂对联合组患者进行治疗。本研究所用的PD-1 抑制剂为信迪利单抗注射液(生产厂家:信达生物制药有限公司;批准文号:国药准字S20180016 ;规格:100 mg/ 支),其用法是:静脉滴注,每次用药200 mg,每3 周用药1 次(为1 个治疗周期),共治疗2 个周期。
1.3 观察指标与疗效判定标准
治疗前后,比较两组患者的细胞免疫指标,包括CD3+T 淋巴细胞、CD4+T 淋巴细胞和CD8+T淋巴细胞。上述指标的检测方法是:采集患者的外周静脉血2 mL,对血液标本进行离心处理,分离出血清。采用艾森生物(杭州)有限公司生产的NovoCyte D1040 型流式细胞仪测定血清中CD3+T 淋巴细胞、CD4+T 淋巴细胞和CD8+T 淋巴细胞的水平。治疗前后,比较两组患者血清炎性因子的水平。炎性因子包括白细胞介素-6(IL-6)和肿瘤坏死因子(TNF-α),其检测方法是:采集患者的外周静脉血2 mL,对血液标本进行离心处理,分离出血清。采用酶联免疫吸附双抗体夹心法测定血清中IL-6、TNF-α 的水平。比较两组患者的近期疗效及用药后发生不良反应(如骨髓抑制、白细胞减少、恶心呕吐等)的情况。用完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)评估患者的近期疗效。CR :治疗后患者的病灶消失,且该疗效持续的时间>3 周。PR :治疗后患者的病灶缩小>30%,且该疗效持续的时间>3 周。SD :治疗后患者的病灶缩小≤30%、增大<20%,且该疗效持续的时间>3 周。PD :治疗后患者的病灶增大≥20%。总有效率=(CR 例数+PR 例数)/ 总例数×100%[6]。
1.4 统计学方法
用SPSS 19.0 软件处理本研究中的数据,计量资料用±s表示,用t检验,计数资料用% 表示,用χ² 检验,P<0.05 表示差异有统计学意义。
2 结果
2.1 对比治疗前后两组患者的细胞免疫指标
治疗前,两组患者血清CD3+T 淋巴细胞、CD4+T 淋巴细胞及CD8+T 淋巴细胞的水平相比,差异无统计学意义(P>0.05)。治疗后,联合组患者血清CD3+T 淋巴细胞和CD4+T 淋巴细胞的水平均高于单一组患者,其血清CD8+T 淋巴细胞的水平低于单一组患者,差异有统计学意义(P<0.05)。详见表1。
表1 对比治疗前后两组患者的细胞免疫指标(%,± s)
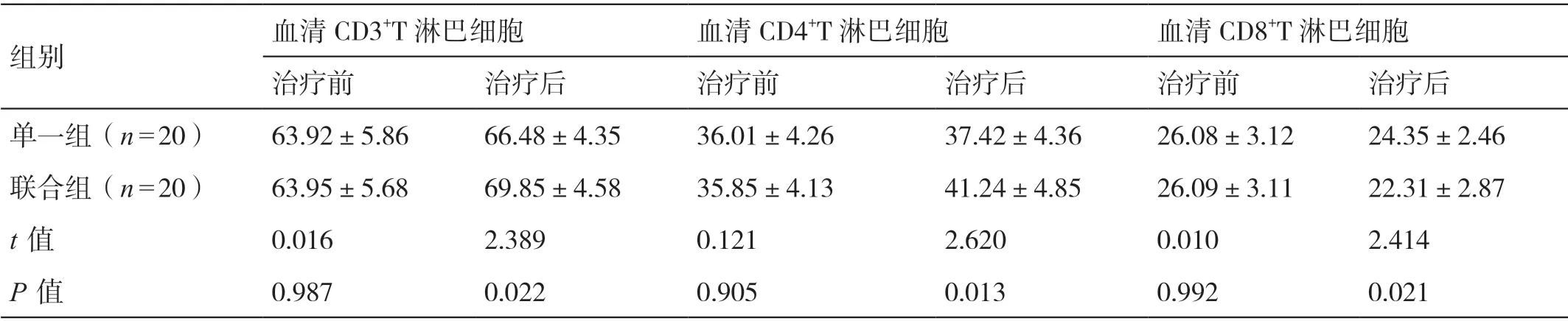
表1 对比治疗前后两组患者的细胞免疫指标(%,± s)
组别血清CD3+T 淋巴细胞血清CD4+T 淋巴细胞血清CD8+T 淋巴细胞治疗前治疗后治疗前治疗后治疗前治疗后单一组(n=20)63.92±5.8666.48±4.3536.01±4.2637.42±4.3626.08±3.1224.35±2.46联合组(n=20)63.95±5.6869.85±4.5835.85±4.1341.24±4.8526.09±3.1122.31±2.87 t 值0.0162.3890.1212.6200.0102.414 P 值0.9870.0220.9050.0130.9920.021
2.2 对比治疗前后两组患者血清炎性因子的水平
治疗前,两组患者血清IL-6、TNF-α 的水平相比,差异无统计学意义(P>0.05)。治疗后,联合组患者血清IL-6、TNF-α 的水平均低于单一组患者,差异有统计学意义(P<0.05)。详见表2。
表2 对比治疗前后两组患者血清炎性因子的水平(± s)
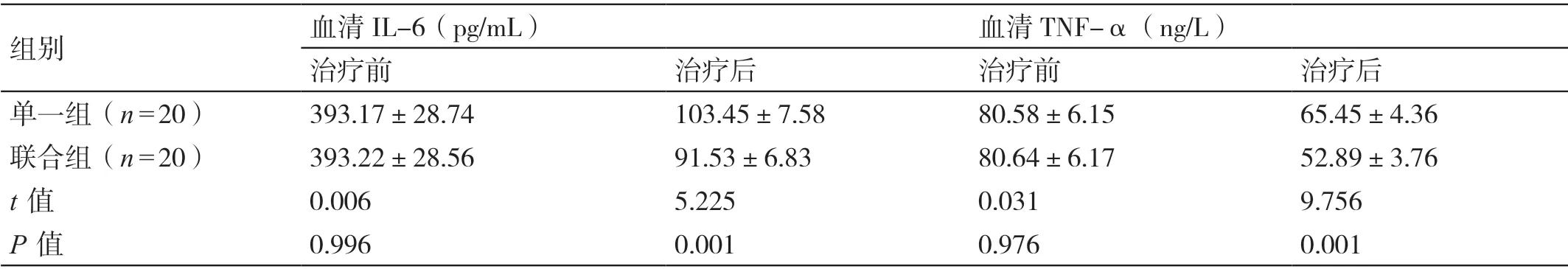
表2 对比治疗前后两组患者血清炎性因子的水平(± s)
组别血清IL-6(pg/mL)血清TNF-α(ng/L)治疗前治疗后治疗前治疗后单一组(n=20)393.17±28.74103.45±7.5880.58±6.1565.45±4.36联合组(n=20)393.22±28.5691.53±6.8380.64±6.1752.89±3.76 t 值0.0065.2250.0319.756 P 值0.9960.0010.9760.001
2.3 对比两组患者的近期疗效
联合组患者治疗的总有效率高于单一组患者,差异有统计学意义(P<0.05)。详见表3。
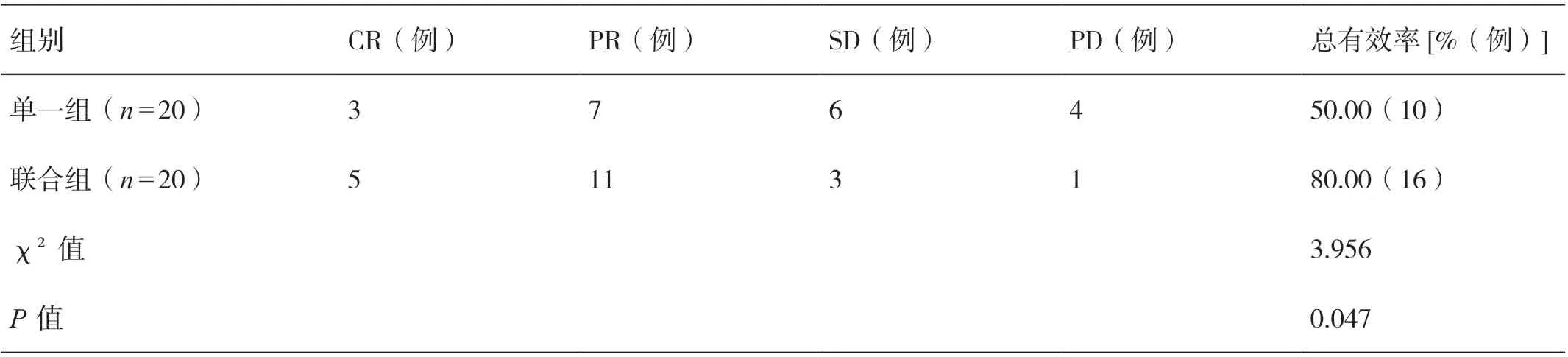
表3 对比两组患者的近期疗效
2.4 对比用药后两组患者不良反应的发生率
用药后,两组患者不良反应的发生率相比,差异无统计学意义(P>0.05)。详见表4。

表4 对比用药后两组患者不良反应的发生率
3 讨论
研究指出,恶性肿瘤的进展与患者免疫系统功能的失衡密切相关[7-8]。非小细胞肺癌的增殖速度较快,加之肿瘤会持续对邻近的器官及组织造成刺激,因此易诱发局部炎症反应。对非小细胞肺癌患者进行化疗虽然可在一定程度上杀灭肿瘤细胞,延长患者的生存期,但会使患者出现多种不良反应,严重影响其生存质量[9]。白蛋白结合型紫杉醇是一种新型的植物碱类抗癌药,其将人血白蛋白作为载体,构成130 nm 大小的紫杉醇颗粒。白蛋白携带的紫杉醇分子可与细胞中的白蛋白受体Gp60 相结合,激活细胞膜上的小窝蛋白,使紫杉醇经由血管内皮细胞向肿瘤细胞内转移,促使肿瘤细胞的微管蛋白二聚体与微管之间丧失稳态,避免微管蛋白解聚,使肿瘤细胞在有丝分裂的过程中无法产生纺锤体及纺锤丝,进而可抑制肿瘤细胞的分裂与增殖,最终导致其凋亡。另外,白蛋白结合型紫杉醇在使用前无需进行预处理,输注的时间较短,使用的安全性较高[7]。近年来随着诸多免疫制剂的研发及临床应用,免疫疗法在非小细胞肺癌的治疗中应用越来越广泛。PD-1在肿瘤的进展及肿瘤细胞的免疫逃逸中均起到至关重要的作用。PD-1 能经由PD-1 依赖与非依赖的机制促使T 淋巴细胞的凋亡,使肿瘤细胞出现免疫逃逸效应[10-11]。PD-1 抑制剂可阻断这种免疫逃逸效应,促进T 淋巴细胞功能的恢复,使T淋巴细胞正常发挥杀灭肿瘤细胞的作用[12]。
本研究的结果证实,用白蛋白结合型紫杉醇联合PD-1 抑制剂治疗非小细胞肺癌的效果较为理想,能有效改善患者细胞免疫指标及血清炎性因子的水平,缓解其病情,且治疗的安全性较高。
