血清瘦素及骨转化指标与下肢长骨骨折伴急性脊髓损伤患者骨折愈合的关系
2022-03-17陈游李斌戴携文妙
陈游,李斌,戴携,文妙
(长沙市第四医院 神经脊柱外科,湖南 长沙 410000)
脊髓损伤(spinal cord iniury,SCI)是目前一个长期而紧迫的公共卫生问题,会引起骨代谢的急性改变,造成骨矿化减少和骨骼微结构退化等[1]。例如有文献[2]报道,SCI可能导致各种激素分泌紊乱,进而增高血清骨诱导因子水平,如骨钙素和瘦素等。瘦素最初被发现是一种调节食物摄入和能量消耗的因子,是肥胖基因的循环蛋白产物,由脂肪细胞合成和分泌[3]。作为一个重要的激素调节因子,瘦素不仅影响脂质代谢,还会影响骨代谢过程,包括促进成骨细胞的分化,抑制成骨细胞的凋亡和破骨细胞的形成等[4]。在骨折伴SCI患者中,血清瘦素可能是脂肪组织、神经内分泌系统和骨系统变化之间的重要联系分子。目前,许多研究都支持瘦素对骨折愈合的积极作用[5]。然而关于瘦素在SCI后骨重塑中的作用一直存有争议。故本研究通过收集长骨骨折伴急性SCI患者的临床数据,进一步分析血清瘦素、骨转化指标的变化与骨折愈合的关系,以探讨SCI对骨形成的影响。
1 资料与方法
1.1 一般资料
选取2018年3月至2021年2月我院收治的127例下肢长骨骨折患者为研究对象,SCI的类型和程度由计算机轴向断层扫描和MRI确定,所有患者都通过美国脊髓损伤协会(Aerican Spinal Injury Association,ASIA)评级进行评估。根据是否伴有SCI分为两组,其中SCI组67例,男59例,女8例;年龄26~85岁,平均(63.28±14.41)岁;ASIA评级A级∶B级∶C级∶D级=8∶28∶19∶12。不伴有SCI的骨折患者60例作为骨折组,男51例,女9例;年龄31~87岁,平均(61.60±14.23)岁;所有骨折组患者ASIA评级为E级。纳入标准:经X线、MRI影像学检查等确诊为下肢长骨骨折;心、肝、肾等重要脏器功能正常;无脊柱手术史;临床资料完整;依从性良好,配合程度高。排除标准:合并其他骨相关疾病、先天性脊柱发育畸形、恶性肿瘤、严重器质性疾病、血液系统疾病、急慢性感染、自身免疫性疾病或长期应用免疫抑制剂者;有脊髓或颅脑损伤史者。所有患者均为单纯股骨或胫骨干骨折,均采用闭合顺行扩髓髓内钉技术进行治疗。这些病人在同一个康复中心接受了随访。另外,还纳入了同时期因跌伤或创伤在我院进行检查排除骨折的志愿者60例作为对照组。3组性别、年龄等一般资料比较差异均无统计学意义(P>0.05),具有可比性。参与者年龄均≥18岁,研究获得当地研究伦理委员会的批准。所有参与者或授权的家属均被给予口头和书面信息,然后递交书面同意书。
1.2 血清瘦素和骨转化标志物水平检测
分别于术后1 d、7 d和14 d时采集受检者的空腹静脉血5 ml,静置30 min后以3 000 r·min-1离心10 min,留取血清于-80 ℃超低温保存。采用酶联免疫吸附法检测血清瘦素水平,采用电化学发光免疫法检测骨转化标志物水平,包括Ⅰ型胶原蛋白C末端交联肽(C-terminalcross linked peptide,CTX-1)、骨特异碱性磷酸酶(bone-specific alkaline phosphatase,BALP)、1型胶原蛋白氨基端前胶原肽(type-1 procollagen N-terminal,P1NP)、骨钙素(osteocalcin,OC)。
1.3 骨密度(BMD)测定
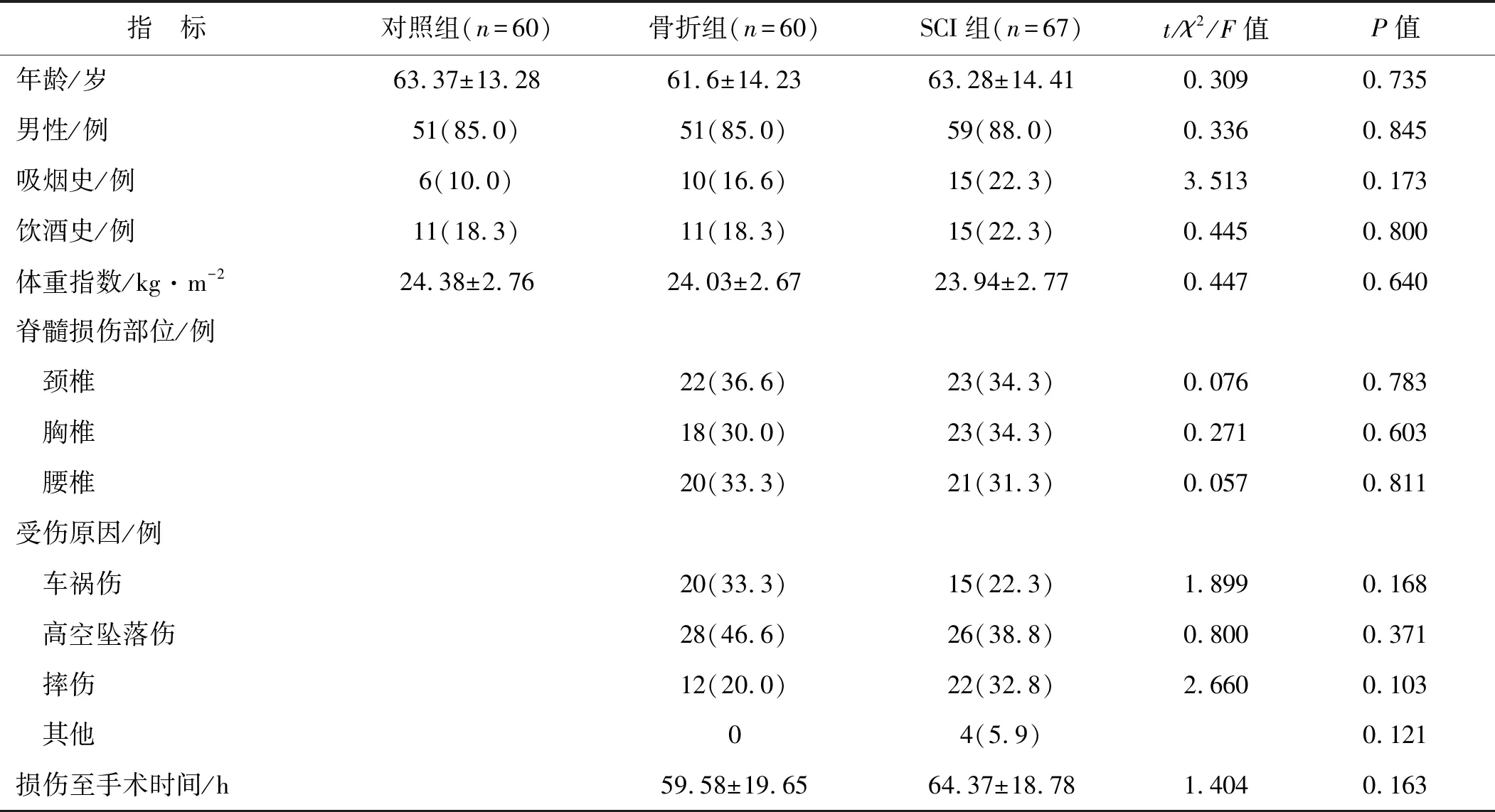
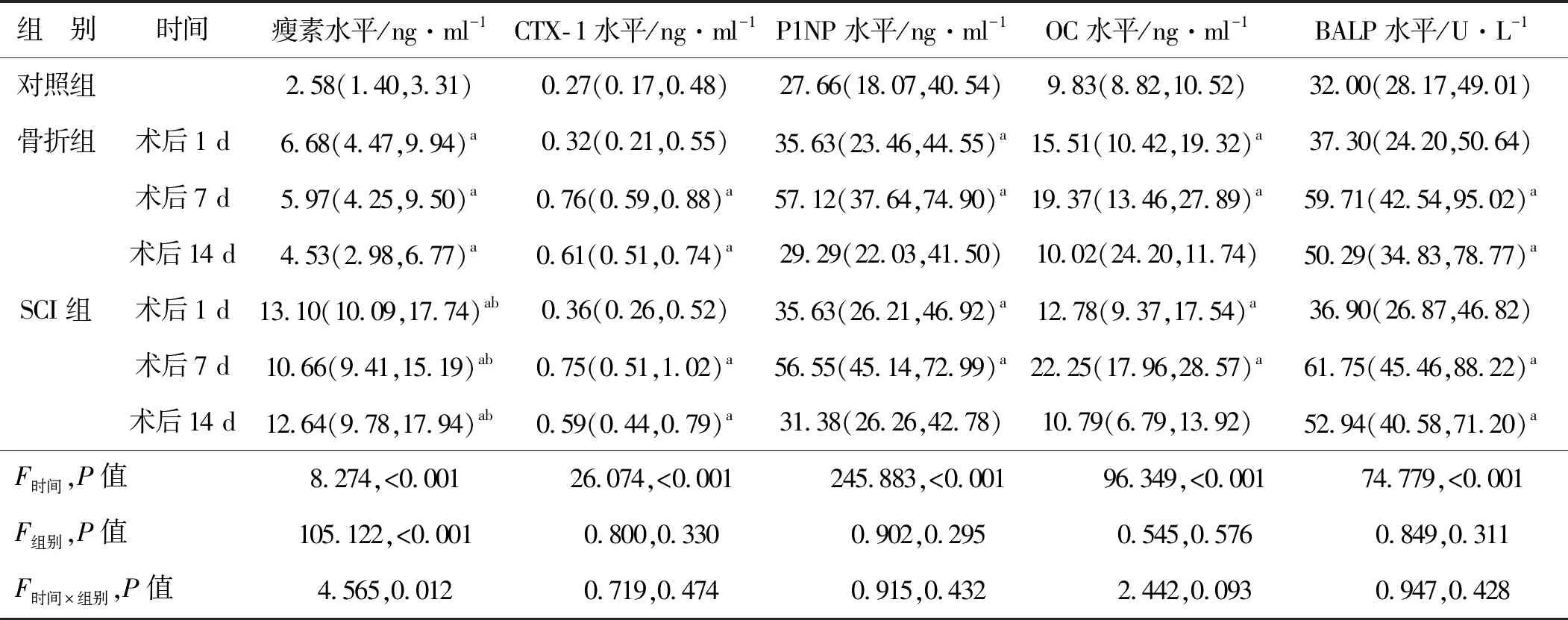
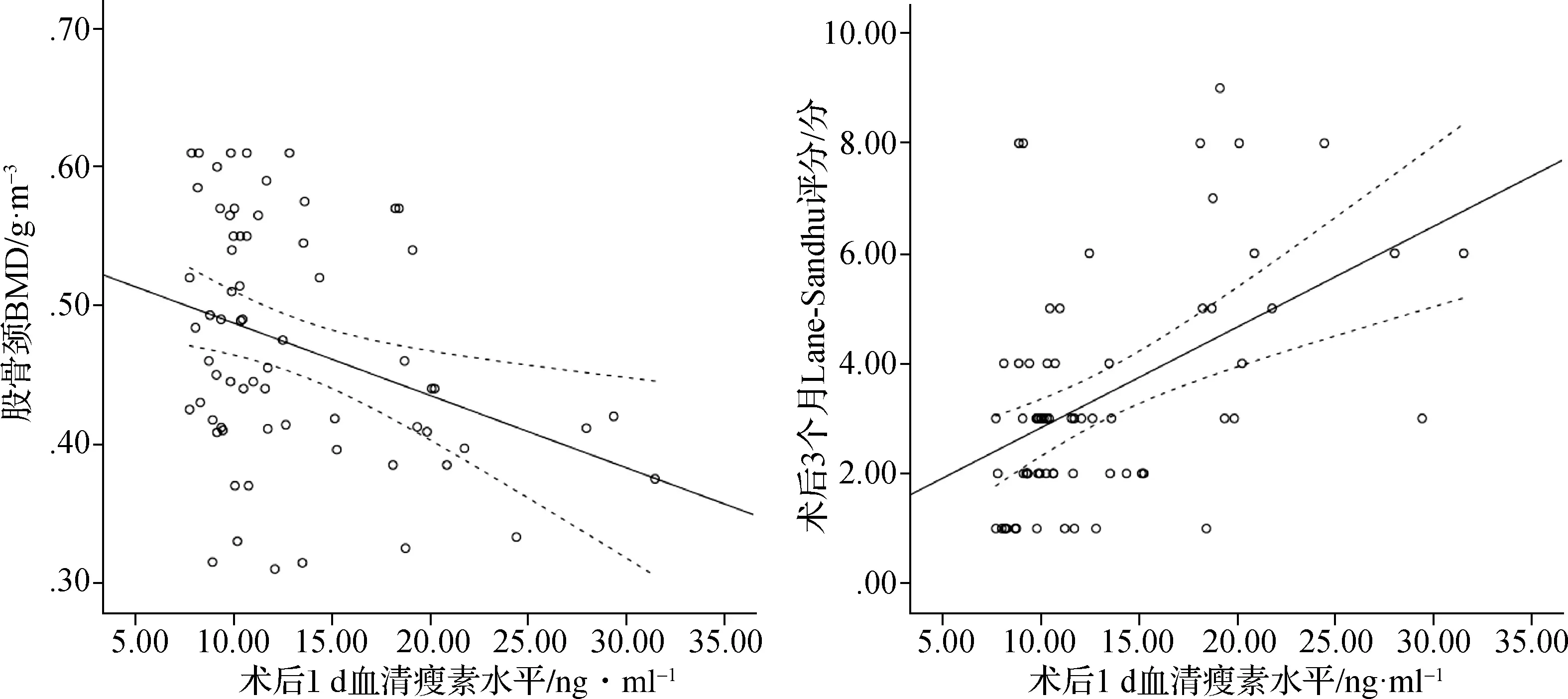
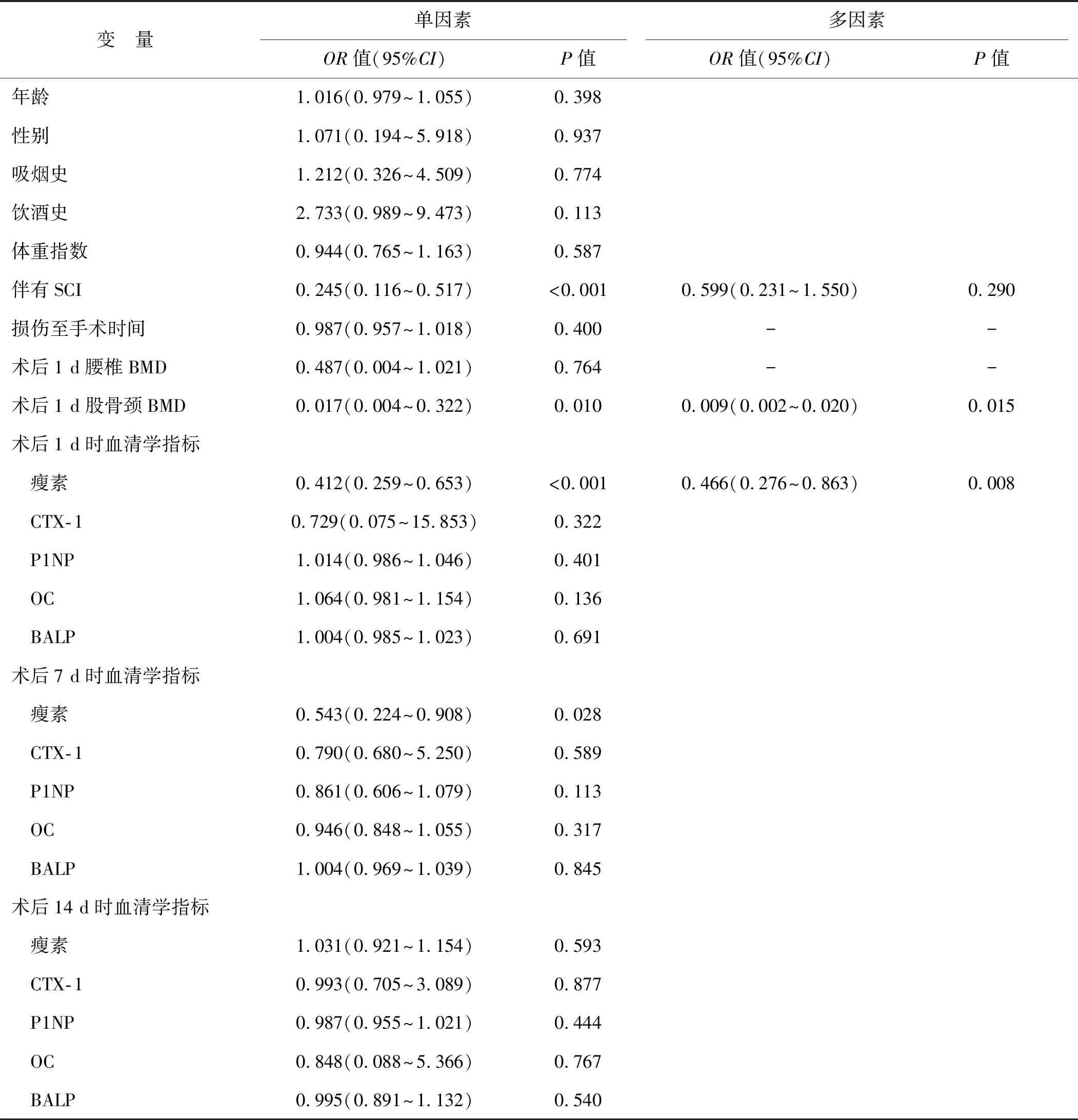
在治疗后1 d、7 d和14 d通过美国迈尔思骨密度检测仪评估BMD。所有扫描均按照标准化程序进行,并记录T值,其中骨质疏松定义为T值≤-2.5,骨质减少定义为-2.5 在术后3个月时,对骨折愈合程度进行临床和放射学评估。在随访检查中,对所有患者拍摄标准的前后位和侧位X光片。此外,由2名未参与研究的放射科医师对骨折实变进行评分,并通过Lane-Sandhu评分对骨形成、骨重塑、骨连接进行评估。骨折愈合延迟判断标准:在术后3个月复查X射线时显示骨痂极少生长或完全不生长,几乎无愈合倾向,断端骨质部分出现硬化、间隙(0分);1~4分者则为骨折愈合正常。 使用SPSS 26.0软件处理所得数据,连续变量先进行正态性检验,若符合正态分布,则以均值±标准差表示,进行单因素方差分析、重复测量方差分析或t检验;否则以中位值(四分位值)表示,进行非参数检验。计数资料以率(%)表示,采用卡方检验。检验标准α=0.05,多组间的检验标准α由Bonferroni 后测法调整。经Logistic回归分析模型分析脊柱骨折伴SCI患者骨折愈合的影响因素,并使用Spearman法评估各指标之间的相关性。 3组受试者年龄、性别构成、吸烟史、饮酒史、体重指数等资料比较,差异无统计学意义(P>0.05),说明3组具有可比性。此外,与骨折组相比,SCI组在SCI部位、受伤原因、损伤至手术时间等方面差异亦无统计学意义(P>0.05)。见表1。 表1 3组一般资料比较Tab 1 Comparisons of the baseline data in three groups 在术后1、7、14 d时,骨折组和SCI组血清瘦素水平均高于对照组(P<0.05);在术后7 d和14 d时血清CTX-1、BALP水平以及在术后1、7 d时血清P1NP和OC水平均高于对照组(P<0.05)。经两因素重复测量方差分析,比较骨折组和SCI组患者血清瘦素、CTX-1、P1NP、OC、BALP水平差异:(1)时间效应:2组不同时间点血清瘦素水平比较差异有统计学意义(F时间=8.274,P<0.001);(2)组别效应:2组血清瘦素水平比较差异有统计学意义(F组别=105.122,P<0.001),在术后1、7、14 d时SCI组患者血清瘦素水平均高于骨折组(P<0.001);(3)组别×时间的交互效应:2组血清瘦素水平在术后1、7、14 d时的变化趋势差异有统计学意义(F时间×组别=4.565,P=0.012)。此外,2组不同时间点血清骨转化标志物CTX-1、P1NP、OC、BALP水平差异有统计学意义(F时间=26.074、245.883、96.349、74.779,P<0.001),但是2组之间血清CTX-1、P1NP、OC、BALP水平及术后1、7、14 d时变化趋势比较差异则无统计学意义(F组别=0.800、0.902、0.545、0.849,P>0.05;F时间×组别=0.719、0.915、2.442、0.947,P>0.05)。见表2。 表2 3组受试者各时间点血清瘦素和骨转化标志物水平比较Tab 2 Comparisons of serum leptin and bone turnover markers at different time points in three groups SCI组和骨折组患者Lane-Sandhu评分分别为3.00(2.00,4.00)和2.00(1.50,3.50),SCI组患者Lane-Sandhu评分高于骨折组,差异有统计学意义(P<0.05)。 经Spearman法分析,SCI组患者术后1 d时血清瘦素水平与股骨颈BMD呈负相关性(rs=-0.492,P<0.05),与Lane-Sandhu评分均呈正相关性(rs=0.724,P<0.05)。未发现同一时间点血清瘦素水平与骨转化标志物之间的关系(P>0.05)。见图1。 图1 术后1 d血清瘦素水平与股骨颈BMD、术后3个月Lane-Sandhu评分的关系Fig 1 Relationship between serum leptin level and femoral neck BMD on the 1st day after operation and Lane-Sandhu score at 3 months after operation 术后3个月X线复查有42例患者Lane-Sandhu评分依然为0分,视为愈合延迟,其中骨折组有24例,SCI组有18例。将术后3个月复查时是否发生骨折愈合作为因变量(骨折愈合延迟=1),将年龄、性别、吸烟史、血清待测指标等作为自变量纳入Logistic回归模型,经单因素分析,伴有SCI损伤、术后1 d时股骨颈BMD和血清瘦素水平及术后3 d时的瘦素水平都是影响术后骨折愈合的临床因素(P<0.05)。由于术后1 d和术后3 d时血清瘦素水平存在一定的关联,因此我们仅纳入术后1 d时的血清瘦素水平,经多因素Logistic回归分析,术后1 d时股骨颈BMD和血清瘦素水平升高是影响术后骨折愈合的独立保护因素(P<0.05)。见表3。 表3 单因素和多因素Logistic回归分析影响患者骨折愈合的临床因素Tab 3 Univariate and multivariate Logistic regression analysis of clinical factors influencing fracture healing 随着社会现代化进程的推进,交通和建筑业的蓬勃发展,我国骨折发病率不断增加[6],而5.6%~44.3%患者会伴发急性SCI[7]。先前有研究[8]表明,SCI可能导致各种激素升高,这些激素显著增加血清骨诱导因子,如骨钙素和瘦素。瘦素是一种肽类激素,主要由脂肪细胞产生并作用于下丘脑,由肥胖基因编码。本研究中我们发现,骨折组和SCI组患者术后血清瘦素、骨转化标志物水平普遍高于对照组,而且SCI组患者血清瘦素水平升高更明显,且在术后14 d内一直保持较高水平;而对于骨折组患者,随着术后恢复时间的延长血清瘦素水平呈下降趋势,在术后7 d时部分患者血清瘦素水平甚至降低至正常水平。此外无论是骨折组还是SCI组患者,术后血清CTX-1、P1NP、OC、BALP水平变化趋势和变化程度基本一致,在术后7 d时升高达峰值,但随后逐渐降低。 骨折愈合是一个多样而复杂的过程,它涉及一系列有序而复杂的事件,从炎症开始,然后是纤维组织和软骨分化,最后是软骨内和膜内骨化[9]。该过程涉及多种因素,例如生长激素、转化生长因子和由骨骼生长和发育的伤口愈合过程组成的细胞外基质[10]。因此,骨愈合归因于骨折部位骨痂的形成和稳定骨折部位的矿化两个主要因素。近年来,大量的体内外研究表明,瘦素通过下丘脑和交感神经系统调节骨量,促进骨矿化,在骨代谢中发挥重要作用[11]。瘦素由脂肪细胞合成和分泌,最初发现作为饱腹感因子调节食物摄入和能量消耗[12]。作为一个重要的激素调节因子,瘦素不仅影响脂质代谢而且还可以调节骨量和促进骨矿化从而调节骨代谢。瘦素对骨骼系统的作用是复杂的,它至少参与2种不同的骨骼控制机制,对骨骼生长有直接刺激作用,通过交感神经系统下丘脑对骨骼形成有间接抑制作用,还能通过作用于下丘脑并增加交感神经输出和成骨细胞表面的β2-肾上腺素能受体,对中枢神经系统发挥抗成骨作用,阻断瘦素的中枢效应刺激骨形成来增加骨量。在本研究中,SCI组患者术后1 d 时血清瘦素水平与股骨颈BMD呈负相关性,说明患者血清瘦素水平在一定程度上反映了BMD。有研究证实,瘦素可限制骨的高转换(骨吸收大于骨形成)而导致的骨丢失,而骨丢失则是影响骨折风险和骨折愈合延迟的独立危险因素[13]。 除此以外,在SCI后通过激活内源性瘦素分泌可导致外周血清瘦素水平迅速升高,并且血清瘦素会维持较长一段时间的高水平,而升高的血清瘦素可诱导骨髓前体细胞分化和成骨细胞增殖,并加速骨折部位骨的矿化。Wang等[14]研究发现,瘦素对大鼠股骨骨折愈合有积极作用。本研究中SCI组患者术后3个月时Lane-Sandhu评分高于骨折组,说明伴有急性SCI的下肢长骨骨折患者骨愈合能力高于单纯骨折组,而且SCI组患者术后血清瘦素一直处于较高水平,且远远高于骨折组,经Spearman法分析,SCI组患者术后血清瘦素水平与Lane-Sandhu评分保持正相关性,而且经单因素和多因素分析,术后1 d时的血清瘦素水平升高与患者术后骨折愈合呈独立正相关性,且不受SCI的影响;说明无论是否伴有SCI,瘦素都是影响骨折愈合的独立保护因素。这可能是由于SCI会导致弥漫性轴索损伤、挫伤、颅内血肿等直接损伤,进而影响下丘脑功能。肾上腺素通过刺激脂肪细胞合成并分泌瘦素,导致SCI组患者在急性期即可观察到血清瘦素水平升高。 骨转化标志物是反映身体内骨转化情况的指标,在体液中的改变相对于BMD而言更早,可以及时反映全身骨骼骨吸收与骨形成的动态变化情况。OC和PINP可作为骨形成标志物,而CTX和TRAP可作为骨吸收的标志物[15]。骨重塑过程中骨代谢标志物的变化已被用于评估骨折愈合情况[16]。OC由成骨细胞、成牙本质细胞和肥大软骨细胞合成,它是成骨细胞活性和骨转换的高度特异性标志物。PINP是一种在肝脏代谢并在Ⅰ型原胶原合成胶原蛋白期间释放的蛋白质,PINP水平直接反映了成骨细胞中胶原蛋白合成的过程和动态。值得强调的是,PINP被认为是早期成骨细胞的标志物,当这些骨细胞已经成熟并完全分化时,更好的标志物是OC[17]。本研究中骨折组和SCI组患者在术后7 d时血清CTX-1、P1NP、OC、BALP水平均较对照组普遍升高,但2组之间比较差异则无统计学意义。而且随着术后恢复时间的延长,2组患者血清骨转化标志物水平下降趋势一致,说明SCI在急性期时对于骨代谢指标的影响可能不显著。 综上所述,对于伴有急性SCI的下肢长骨骨折患者,在术后14 d内血清瘦素一直保持较高水平,这可能是加速SCI组患者骨折愈合速度的主要因素之一。此外血清CTX-1、P1NP水平较低也与SCI组患者骨折愈合延迟有关,提示伴有急性SCI的下肢长骨骨折患者骨折愈合不仅受BMD、机械外力等影响,也受较高的血清瘦素、CTX-1、P1NP水平影响。本研究仍存在一定的局限性,例如病例数较少和SCI患者的多样性,仍需要更多的临床研究来进一步证实。1.4 临床和影像学随访
1.5 统计学处理
2 结 果
2.1 一般资料比较
2.2 3组受试者血清瘦素、骨转化标志物水平比较
2.3 两组骨折患者术后3个月Lane- Sandhu评分比较
2.4 SCI组患者术后1 d血清瘦素水平与骨转化标志物、BMD以及术后3个月Lane- Sandhu评分的关系
2.5 单因素和多因素Logistic回归分析影响患者骨折愈合的临床因素
3 讨 论
