GPR120对脂多糖诱导的胰岛β细胞炎症损伤及TLR4/MyD88/NF-κB p65信号通路的影响
2022-03-17吴广飞王星王迪刘波刘俊茹娄东辉刘博伟
吴广飞,王星,王迪,刘波,刘俊茹,娄东辉,刘博伟
(秦皇岛市第一医院 内分泌科,河北 秦皇岛 066000)
胰岛β细胞功能受损是2型糖尿病发病的中心环节,造成胰岛β细胞功能受损的原因主要是脂毒性和糖毒性[1]。深入探讨胰岛β细胞功能受损的分子生物学机制对2型糖尿病的治疗有重要意义。胰岛β细胞功能受损与免疫炎症损伤密切相关[2]。2型糖尿病患者血清中脂多糖(lipopolysaccharide,LPS)表达水平明显升高[3]。既往研究[4-5]表明,LPS可激活Toll样受体4(toll-like receptor 4,TLR4)/髓样分化因子(myeloid differentiation primary response gene 88,MyD88)/核转录因子-κB(nuclear factor-κB,NF-κB)信号通路,参与急慢性炎症的激活,造成胰岛β细胞功能受损。G蛋白偶联受体120(G-protein coupled receptor 120,GPR120)以中长链脂肪酸为配体,在糖脂代谢和胰高血糖素样肽(glucagon like peptide 1,GLP-1)信号转导等过程中发挥重要作用[6]。有研究[7]发现,GPR120可以改善脂肪组织炎症和胰岛素抵抗。GPR120对胰岛β细胞炎症性损伤既往少有报道。本研究通过构建LPS诱导的胰岛β细胞炎症损伤模型,分析GPR120在胰岛β细胞炎症损伤中的作用及可能机制,现报道如下。
1 材料与方法
1.1 材料
胰岛β细胞MIN6细胞株由舜冉(上海)生物科技有限公司提供(货号YB-H0390)。DMEM培养基(货号NS1123)、胰蛋白酶(NS1672)均购自南京生航生物技术有限公司。LPS购自美国Sigma公司(货号L6529-1MG);pcDNA3.1-GPR120由上海吉玛公司提供(货号P14905);BCA蛋白定量检测试剂盒(货号HZ0146)、凝胶快速制备试剂盒(货号HZ00243)、CCK-8试剂盒(货号HZ441423-1)和Annexin-V-FITC/PI凋亡检测试剂盒(货号HZ-00101)均购自上海沪震实业有限公司。IL-6(货号EK0411)、IL-1β(货号EK0394)和TNF-α(货号EK6820)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)试剂盒购自武汉博士德生物科技有限公司。GPR120(货号ab5712)、TLR4(货号ab7778)、MyD88(货号ab1004)、NF-κB p65(货号ab1359)抗体和β-actin内参抗体(货号ab1121)均购自美国Abcam公司。
1.2 细胞培养
MIN6细胞在含10%胎牛血清、100 U·L-1青霉素和100 mg·L-1链霉素的DMEM培养液中进行培养,置于37 ℃、5% CO2培养箱中。当细胞融合度达80%时进行传代,用胰蛋白酶消化,以1∶3传代,每2 d更换1次培养液。
1.3 分组和慢病毒感染
将MIN6细胞分为control组(细胞用无血清培养液进行培养)、LPS组(细胞用含10 μg·ml-1LPS[8]的培养液进行培养)、LPS+control组(感染阴性对照慢病毒的细胞用10 μg·ml-1LPS培养液处理)、LPS+GPR120组(感染pcDNA3.1-GPR120慢病毒的细胞用10 μg·ml-1LPS培养液处理),均干预1 d。当胰岛β细胞密度为40 %时,在细胞中加入慢病毒,培养12 h 后弃去慢病毒液加入新鲜完全培养液,3 d后用嘌呤霉素筛选稳转细胞株,检测GPR120蛋白的表达水平。
1.4 蛋白质印迹法检测GPR120 蛋白的表达水平
在细胞中加入细胞裂解液,冰上裂解20 min后再12 000 r·min-1离心15 min,收集细胞上清液。用BCA法检测蛋白水平。经SDS-PAGE凝胶电泳后将蛋白转移至PVDF膜上,用脱脂奶粉封闭1 h,孵育一抗(GPR120单克隆抗体,1∶500),4 ℃过夜后弃去一抗,TBST洗膜3次。随后室温孵育二抗,2 h后弃去二抗,TBST洗膜3次。以β-actin作为内参,用ECL发光仪对蛋白进行成像,用Image J软件分析灰度值。
1.5 CCK- 8法检测MIN6细胞增殖情况
将对数生长期的MIN6细胞以1×104个·孔-1的密度接种于24孔板中,用CCK-8试剂盒检测细胞活性,操作步骤严格按照试剂盒说明书进行。细胞培养24 h后向每孔中添加10 μl CCK-8,培养4 h。用酶标仪在450 nm波长处读取吸光度。
1.6 Annexin- V- FITC/PI流式细胞术检测MIN6细胞凋亡情况
取对数生长期的MIN6细胞制成1×106个·ml-1的细胞悬液,随后加入5 μl异硫氰酸荧光素,混匀后孵育15 min,再加入2.5 μl碘化丙啶孵育5 min,最后用流式细胞仪检测凋亡率。
1.7 ELISA检测IL- 6、IL- 1β和TNF- α水平
吸取细胞培养液,3 000 r·min-1离心20 min后取上清液,用ELISA试剂盒检测细胞上清液中IL-6、IL-1β和TNF-α的水平,实验步骤严格按照试剂盒说明书进行。
1.8 蛋白质印迹法检测TLR4、MyD88、NF- κB p65蛋白的表达
检测步骤同1.4。实验过程中TLR4、MyD88、NF-κB p65抗体分别稀释500、1 000、500倍。
1.9 统计学处理
应用SPSS 20.0统计软件处理数据。计量资料以平均数±标准差表示,多组间比较用单因素方差分析,两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组GPR120蛋白表达量的比较
LPS组GPR120蛋白相对表达量为0.34±0.06,明显低于control组的1.18±0.12,差异有统计学意义(P<0.05)。LPS+GPR120组GPR120蛋白相对表达量为1.36±0.23,明显高于LPS+control组的0.39±0.09,差异有统计学意义(P<0.05)。见图1。
2.2 各组MIN6细胞增殖活力比较
4组间细胞活力的比较差异有统计学意义(F=23.786,P<0.001),LPS组细胞增殖活力明显低于control组(0.67±0.09vs1.23±0.10,P<0.001),LPS+GPR120组细胞增殖活力明显高于LPS+control组(1.45±0.17vs0.70±0.12,P<0.001),见图2。
2.3 各组MIN6细胞凋亡率比较
4组细胞凋亡率的比较差异有统计学意义(F=68.223,P<0.001),LPS组细胞凋亡率明显高于control组[(16.78±2.31)%vs(6.09±1.23)%,P<0.001],LPS+GPR120组细胞凋亡率明显低于LPS+control组[(6.34±1.55)%vs(20.13±3.98)%,P<0.001],见图3。
2.4 各组细胞上清液IL- 6、IL- 1β和TNF- α水平比较
4组细胞上清液IL-6、IL-1β和TNF-α水平的比较差异均有统计学意义(F值分别为12.090、31.786、19.241,均P<0.001)。LPS组细胞上清液中IL-6、IL-1β和TNF-α水平分别为(96.89±8.76)、(76.00±13.23)、(56.23±8.78)pg·ml-1,均高于control组[(71.89±12.13)、(43.23±10.12)、(35.34±9.56)pg·ml-1,均P<0.001]。LPS+GPR120组IL-6、IL-1β和TNF-α水平分别为(96.89±8.76)、(51.11±9.72)、(40.12±7.09)pg·ml-1,均低于LPS+control组[(100.34±16.23)、(68.34±10.23)、(53.26±10.11)pg·ml-1,均P<0.001]。见图4。

与control组比较,*P<0.05;与LPS+control组比较,#P<0.05图1 各组GPR120蛋白表达量的比较

与control组比较,*P<0.001;与LPS+control组比较,#P<0.001图2 CCK-8法检测各组细胞活力
2.5 各组TLR4/MyD88/NF- κB p65信号通路相关蛋白表达量的比较
4组细胞TLR4、MyD88、NF-κB p65蛋白相对表达量的比较,差异均有统计学意义(F值分别为23.001、18.324、30.181,均P<0.001)。LPS组细胞TLR4、MyD88、NF-κB p65蛋白相对表达量分别为0.60±0.12、0.57±0.09、0.67±0.13,均高于control组(0.23±0.05、0.24±0.08、0.32±0.09,均P<0.001)。LPS+GPR120组TLR4、MyD88、NF-κB p65相对表达量分别为0.31±0.06、0.37±0.04、0.39±0.03,均低于LPS+control组(0.60±0.08、0.63±0.06、0.68±0.09,均P<0.001)。见图5。
3 讨 论
慢性炎症引起的胰岛β细胞损伤在糖尿病的发病中起重要作用[2]。有研究[9]显示,2型糖尿病患者胰岛组织中炎症细胞因子过表达,并且存在免疫细胞浸润、胰岛β细胞凋亡等现象。LPS是诱导炎症发生的重要分子,LPS诱导胰岛β细胞损伤模型是糖尿病体外研究的常用模型。本研究用LPS处理MIN6细胞后,MIN6细胞IL-6、IL-1β和TNF-α水平明显升高,并且细胞增殖能力下降、凋亡率明显增高,这与既往报道[10-12]一致,说明本实验成功建立了LPS诱导的胰岛β细胞损伤模型。
GPR120是脂肪酸受体超家族中新的G蛋白偶联受体成员,以中长链脂肪酸为配体[7]。在小肠内分泌细胞STC1中,中长链脂肪酸与GPR120结合后激活磷脂酶C分解磷脂酰肌醇二磷酸,生成三磷酸肌醇和二酰甘油,而三磷酸肌醇引发细胞内钙信号,进而控制胰高血糖素样肽1的释放,调控胰岛素分泌。另外,中长链脂肪酸与GPR120结合后还可以激活MAPK信号通路,调节细胞生长和功能,同时调控游离脂肪酸引起的细胞凋亡抑制[13]。GPR120还能够启动PI3K-Akt信号通路,诱导细胞增殖,抑制细胞凋亡[13]。GPR120在肠内分泌细胞、味蕾细胞、巨噬细胞、脂肪细胞和胰岛β细胞中表达较多,可参与调解激素分泌、脂质生成和葡萄糖代谢等一系列代谢过程,作为潜在的、治疗多种代谢疾病的靶点备受关注[7,14]。既往研究[15]发现,GPR120可以通过抑制巨噬细胞分泌环氧合酶-2和促进前列腺素E-2分泌等起到抗炎作用,在胰岛素抵抗的发生中起重要作用。
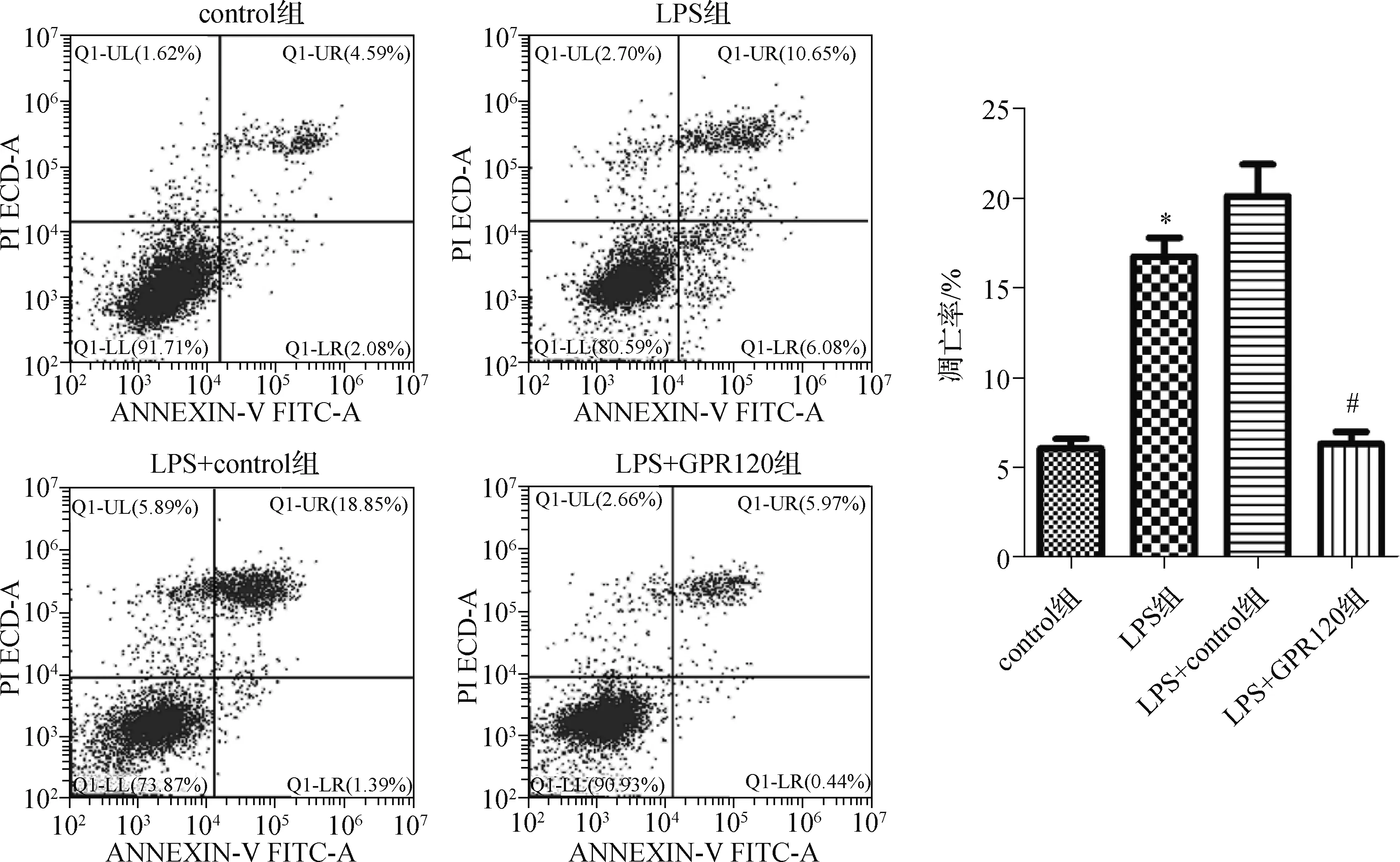
与control组比较,*P<0.001;与LPS+control组比较,#P<0.001图3 Annexin-V-FITC/PI流式细胞术检测各组凋亡率

与control组比较,*P<0.001;与LPS+control组比较,#P<0.001图4 ELISA法检测各组细胞上清液中炎症因子表达水平
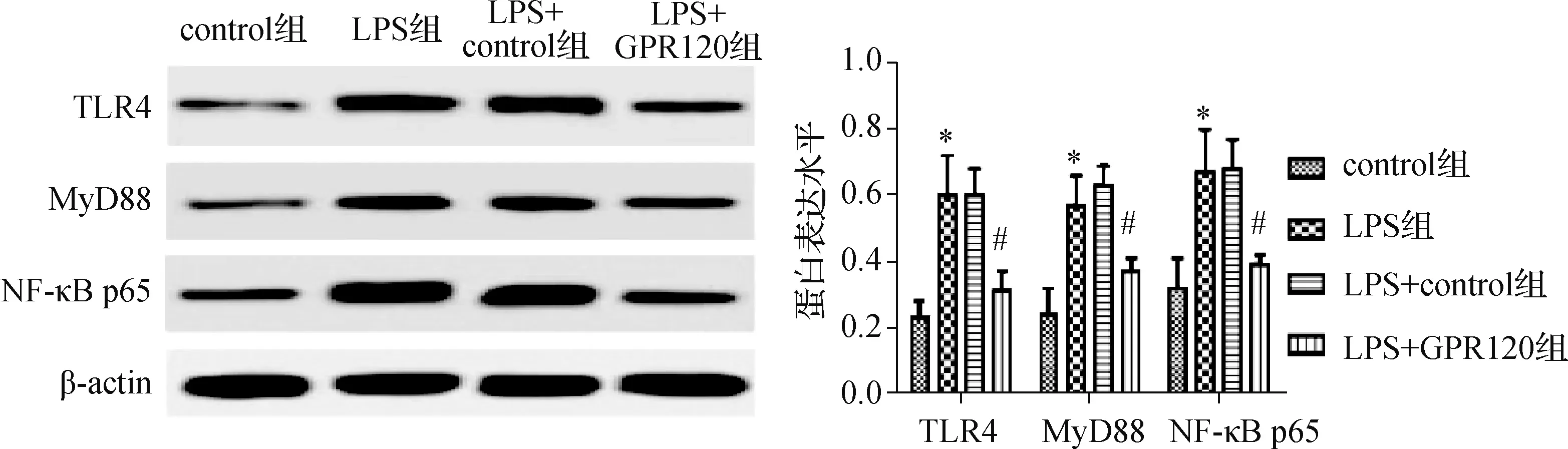
与control组比较,*P<0.001;与LPS+control组比较,#P<0.001图5 蛋白质印迹法检测各组TLR4、MyD88、NF-κB p65蛋白相对表达量
本研究发现,与LPS组相比,转染pcDNA3.1-GPR120慢病毒后MIN6细胞增殖活力明显增高、凋亡率下降,并且IL-6、IL-1β和TNF-α水平也明显下降,说明GPR120可以逆转LPS诱导的胰岛β细胞炎症损伤。类似的是,Wang等[16]发现激动GPR120可以通过胰十二指肠同源盒-1信号通路逆转棕榈酸诱导的MIN6细胞炎症,并且改善了小鼠胰岛β细胞功能。Oh等[17]也发现,GPR120激动剂CpdA可以改善2型糖尿病小鼠的胰岛素抵抗、肝脏脂肪堆积。为了探寻GPR120的可能作用机制,本研究检测了TLR4/MyD88/NF-κB p65信号通路相关蛋白的表达量。TLR4/MyD88/NF-κB p65信号通路是一条经典的炎症信号通路,激活后可以诱导免疫炎症损伤和细胞凋亡的发生,该通路与胰岛β细胞损伤、2型糖尿病的发生和发展密切相关[18-19]。有研究[20]发现,LPS可以通过激活TLR4和p38 MAPK抑制巨噬细胞GPR120的表达。GPR120对TLR4/MyD88/NF-κB p65信号通路的调控作用既往少有报道。有研究[21]发现,GPR120可以通过IκB激酶β抑制NF-κB p65的表达。本研究结果显示,转染pcDNA3.1-GPR120慢病毒可以下调TLR4、MyD88、NF-κB p65蛋白表达,提示GPR120抗LPS诱导胰岛β细胞损伤的机制可能与该通路有关。通过GPR120开发新药可能给糖尿病的治疗带来希望。
综上所述,GPR120在LPS诱导的胰岛β细胞炎症损伤中发挥保护作用,其作用机制可能与抑制TLR4/MyD88/NF-κB p65信号通路、促进细胞增殖和减少细胞凋亡有关。本研究结果提示,靶向GPR120可能会为2型糖尿病的治疗带来曙光。未来需要进一步阐明GPR120对TLR4/MyD88/NF-κB p65信号通路的调控机制。
