4株Ⅰ亚群禽腺病毒分离株对SPF雏鸡的致病性研究
2022-03-17谢梓民曾繁聪傅禹铭姜含雨杨惠湖柯骏鸿梁昭平张雪莲黄淑坚
谢梓民,曾繁聪,傅禹铭,姜含雨,杨惠湖,柯骏鸿,罗 瑞,梁昭平,张雪莲,黄淑坚
(1.佛山科学技术学院生命科学与工程学院,佛山 528225;2.广州华南农大生物药品有限公司,广州 510000)
Ⅰ亚群禽腺病毒(Fowl adenovirus,FAdV)感染后可引起患病动物包涵体肝炎[1-2],主要对雏鸡、鸭、鹅等家禽易感,可通过消化道、呼吸道与直接接触进行传播,但以泄殖腔排毒传播为主[3]。自2015年以来,Ⅰ亚群FAdV的感染率逐渐上升,给中国养禽业造成了一定的经济损失,其中在鸡群中主要流行的血清型为4、8a/b和11型[4-6]。鸡群在感染后主要表现为心包积液-包涵体肝炎综合征[7-8]。同时,禽腺病毒病也是一种免疫抑制性疾病,除了自发症状以外,常常引起其他病原微生物的继发感染导致家禽死亡[9-10],对家禽养殖业造成了巨大的影响。
FAdV是一种无囊膜的双股DNA病毒,根据病毒基因结构与序列长短,可分为Ⅰ、Ⅱ和Ⅲ亚群[11]。其中Ⅰ亚群FAdV又可划分为5个种,共有12个血清型,分别为A(1型)、B(5型)、C(4、10型)、D(2、3、9、11型)、E(6、7、8a、8b型)[11-12]。而Ⅱ与Ⅲ亚群FAdV分别仅有1个血清型[13-14]。目前,Ⅰ亚群FAdV的血清型众多,但其致病机理尚不明确,关于其致病力的研究也存在许多争议[15]。据报道,存在Fiber2基因的FAdV感染力和繁殖力更强[16-17],而在Ⅰ亚群中仅A和C种FAdV存在Fiber2基因。本试验通过探究4株分离株对SPF雏鸡的致病性,揭示FAdV的病理特点及不同血清型之间致病力的差异性,以期为探索FAdV的致病机理和完善其相关的防控措施提供参考。
1 材料与方法
1.1 材料
Ⅰ亚群FAdV分离株GDDL-4(FAdV-4)、GDB3-8a(FAdV-8a)、GDT08-8b(FAdV-8b)、GDWYT-11(FAdV-11)均由广州华南农大生物药品有限公司实验室保存;核酸自动抽提试剂盒购自西安天隆科技有限公司;FAdV-Ⅰ抗体检测试剂盒购自Biochek公司。
1.2 试验动物分组与处理
100只10日龄SPF雏鸡由Boehringer-Ingelheim公司提供。将雏鸡随机分成5组,每组20只。4个攻毒组每组每只鸡经腿部肌肉分别接种0.2 mL 105TCID50的GDDL-4(FAdV-4)、GDB3-8a(FAdV-8a)、GDT08-8b(FAdV-8b)及GDWYT-11(FAdV-11);对照组按相同方法接种0.2 mL PBS。 接种后,连续观察30 d,记录临床症状及死亡数量。
接种后,每周各组采集5只雏鸡血样进行抗体效价分析,抗体检测按照说明书进行。4周后采集完整的心脏、肝脏、脾脏、肺脏、肾脏、法氏囊、十二指肠带胰腺进行称重(mg),计算各器官指数,并进行分析。公式如下:
器官指数=器官重量(mg)/体重(g)
1.3 抗体及排毒量分析
攻毒后每周采血并进行抗体检测,每隔5 d对攻毒组和对照组各采集一次肛拭子进行排毒量分析。将采集的肛拭子加入1 mL PBS,反复冻融3次后抽提核酸。分别设计扩增4株分离株Fiber基因的引物,构建标准品质粒,建立标准曲线。按照Power Up SYBR Green说明书和LightCycler96荧光定量PCR仪的要求进行操作,反应条件为:95 ℃ 15 s;56 ℃ 15 s,72 ℃ 45 s,共40个循环。
1.4 组织病理学观察
取适量肝脏、肾脏、法氏囊组织块,使用4%多聚甲醛固定组织块,24 h后按常规方法制作石蜡切片,经HE染色后进行组织病理学观察。
1.5 各组织病毒载量分析
各取0.1 g心脏、肝脏、脾脏、肺脏、肾脏、十二指肠进行组织研磨,使用自动抽提试剂盒提取核酸,并对各个组织器官进行定量检测,利用实验室建立的标准曲线计算各组织病毒拷贝数。利用GraphPad Prism 8.0统计软件对数据进行分析,以确认病毒在组织中的分布情况。
2 结 果
2.1 临床症状与剖检结果
攻毒3 d后,攻毒组鸡采食量减少、羽毛粗乱、精神萎靡,其中GDDL-4攻毒组雏鸡症状较为明显,可见拉黄绿稀粪症状,第15天开始,攻毒组雏鸡均出现扎堆怕冷的临床症状;对照组鸡30 d内均未见明显的临床症状。GDDL-4组攻毒4 d后死亡17只,存活3只,存活率为15%;GDB3-8a组攻毒6 d后出现死亡现象,存活7只,存活率为35%; GDT08-8b组未出现死亡; GDWYT-11组攻毒5 d后零星死亡, 存活13只, 存活率为65%(图1)。
剖检结果显示,攻毒组雏鸡均出现严重的心包积液;GDDL-4、GDB3-8a、GDWYT-11攻毒组雏鸡肝脏出现严重的刷状出血,部分雏鸡出现肺脏、脾脏、肾脏、十二指肠、腺胃出血,以及法氏囊肿大的病理变化;GDT08-8b攻毒组病理变化不明显,症状较轻,具体剖检病变结果见图2。 统计结果显示,病理变化最严重为心包积液/胶冻样渗出,比例为88.75%(71/80),其次为肝脏刷状出血,比例为61.25%(49/80);其中GDDL-4攻毒组病变数最多(表1)。
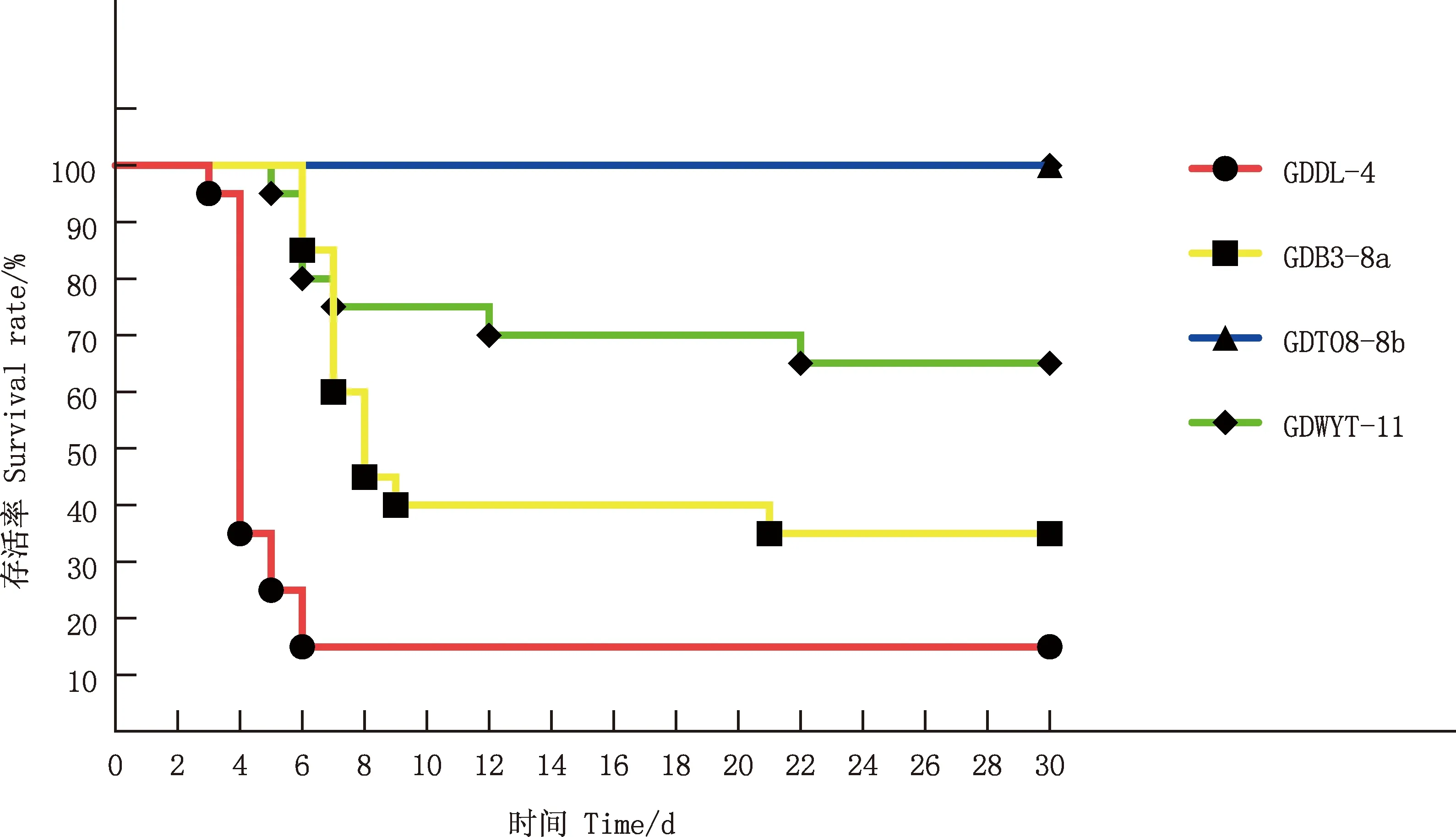
图1 感染雏鸡存活率曲线Fig.1 Survival rate curve of infected chicks
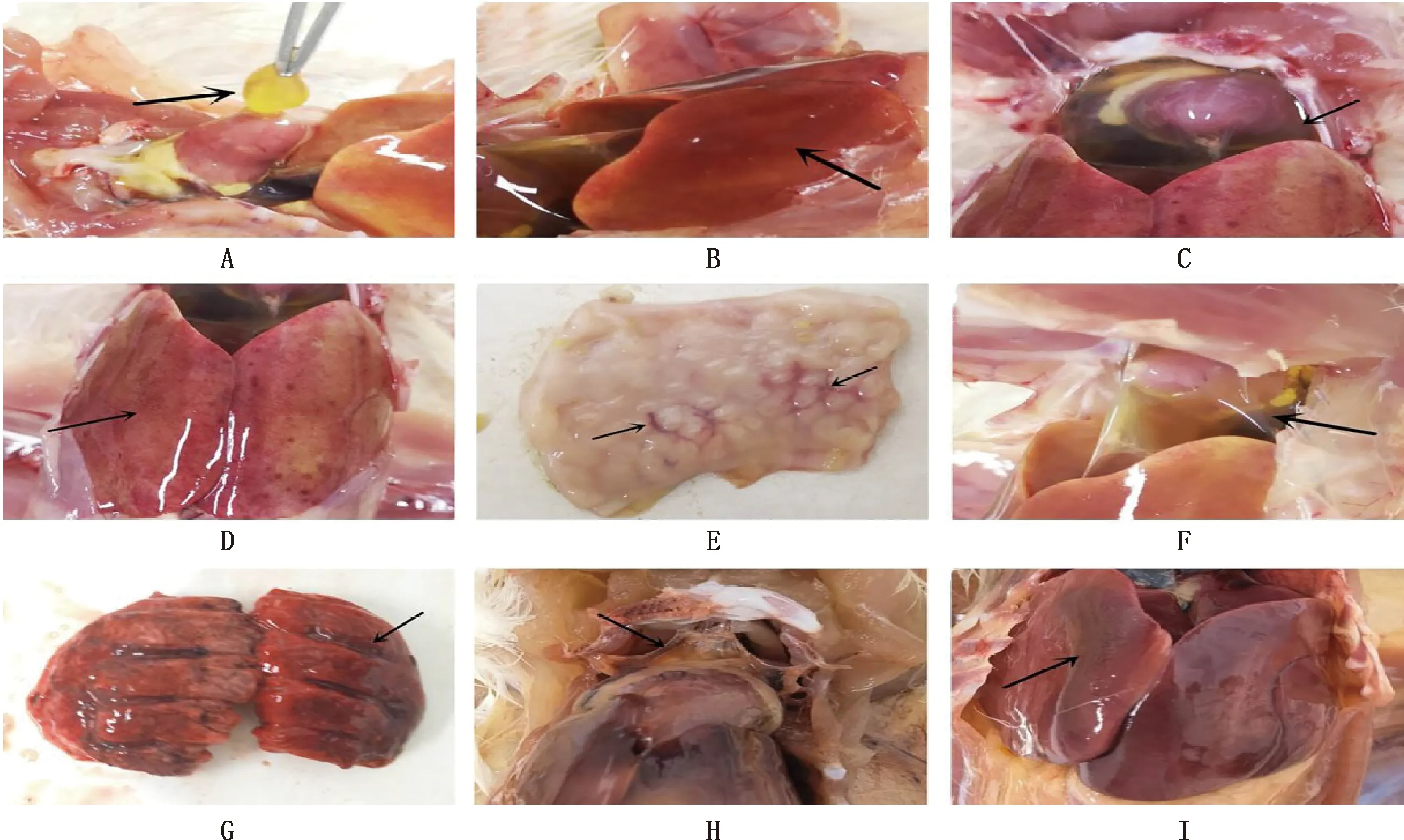
A,GDDL-4组心包积液;B,GDDL-4组肝脏刷状出血;C,GDB3-8a组心包积液;D,GDB3-8a组肝脏出血;E,GDB3-8a组腺胃出血;F,GDT08-8b组心包积液;G,GDT08-8b组肺脏出血;H,GDWYT-11组少量心包积液;I,GDWYT-11组肝脏出血A,Hydropericardium in GDDL-4 group;B,Liver hemorrhage in GDDL-4 group;C,Hydropericardium in GDB3-8a group;D,Liver hemorrhage in GDB3-8a group;E,Glandular stomach hemorrhage in GDB3-8a group;F,Hydropericardium in GDT08-8b group;G,Lung congestion in GDT08-8b group;H,Hydropericardium in GDWYT-11 group;I,Liver hemorrhage in GDWYT-11 group图2 FAdV攻毒后雏鸡病理变化Fig.2 Pathological changes of chicks after challenged with FAdV

表1 病理变化统计
2.2 抗体分析
攻毒后每周采血并进行抗体检测,结果显示,所有攻毒组血清抗体均在14 d时转为阳性(S/P值≥0.500,效价范围≥1 071,抗体判定为阳性),在21 d时抗体滴度达到最高。
2.3 排毒分析
由图3可知,各攻毒组在接种5 d后的病毒拷贝数仅为1.0×102~1.0×103拷贝/μL,含毒量较少;在10 d时,GDDL-4与GDB3-8a组的排毒量提高,于20 d时达到最高峰,最高排毒量分别为1.3×106、6.1×105拷贝/μL;GDT08-8b与GDWYT-11组雏鸡排毒量较少,范围均在2.0×102~5.0×103拷贝/μL。GDDL-4与GDB3-8a组排毒量远远高于GDT08-8b与GDWYT-11组。
2.4 器官指数
由表2可知,GDDL-4、GDB3-8a及GDWYT-11组的心脏、肝脏、肺脏及肾脏指数均极显著大于对照组(P<0.01),GDT08-8b组各器官指数与对照组无明显差异(P>0.05);GDDL-4和GDB3-8a组的脾脏指数极显著大于对照组(P<0.01), GDWYT-11组
脾脏指数显著大于对照组(P<0.05);除GDDL-4组法氏囊指数极显著小于对照组外(P<0.01),其余组与对照组间均无明显差异(P>0.05)。

图3 FAdV攻毒组排毒分析Fig.3 Analysis of detoxification in FAdV challenge groups
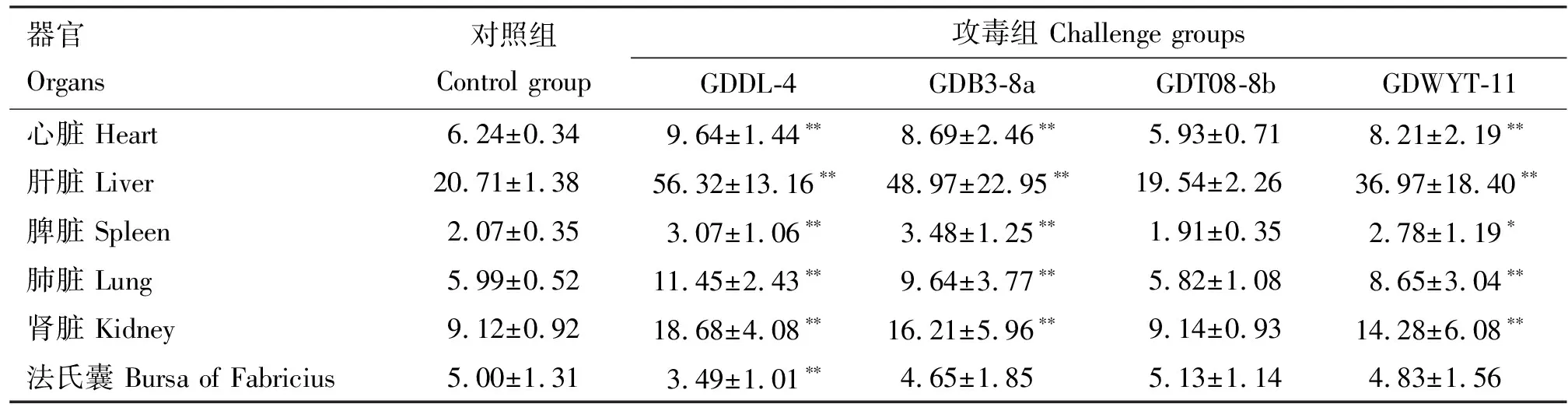
表2 器官指数统计学分析(n=5)
2.5 组织病理学观察
组织病理学切片观察结果显示,GDDL-4组:肝脏出现严重的包涵体肝炎,肝细胞间隙变大,有大量淋巴细胞浸润,肝索间隙有红细胞浸润,部分肝细胞变性坏死;肾间质出血充血、肾小球萎缩退化,肾小管边缘不整齐,肾小管上皮细胞脱落坏死;法氏囊淋巴细胞坏死。GDB3-8a组:肝细胞间隙出血、有大量淋巴细胞浸润,出现包涵体肝炎;肾间质出血、肾间质有少量淋巴细胞;法氏囊淋巴细胞变性坏死。GDT08-8b组:肝细胞出现少量包涵体肝炎;肾间质出血;其余无明显变化。GDWYT-11组:肝细胞间质出血、有包涵体肝炎出现;肾间质增大、出血、肾小球萎缩变小;法氏囊淋巴细胞坏死。详细病理切片图见图4~6。
2.6 病毒载量分析
由图7可知,FAdV在雏鸡各个组织器官中广泛存在,GDDL-4与GDWYT-11组在肝脏中病毒滴度最高,可达1010~1011拷贝/mg;GDB3-8a与GDT08-8b组在十二指肠中病毒滴度最高,可达109~1010拷贝/mg。

A~D,GDDL-4、GDB3-8a、GDT08-8b、GDWYT-11组包涵体肝炎;E,对照组A-D,Inclusion body hepatitis in GDDL-4,GDB3-8a,GDT08-8b and GDWYT-11 groups,respectively;E,Control group图4 肝脏组织病理学观察(400×)Fig.4 Histopathological observation of liver (400×)
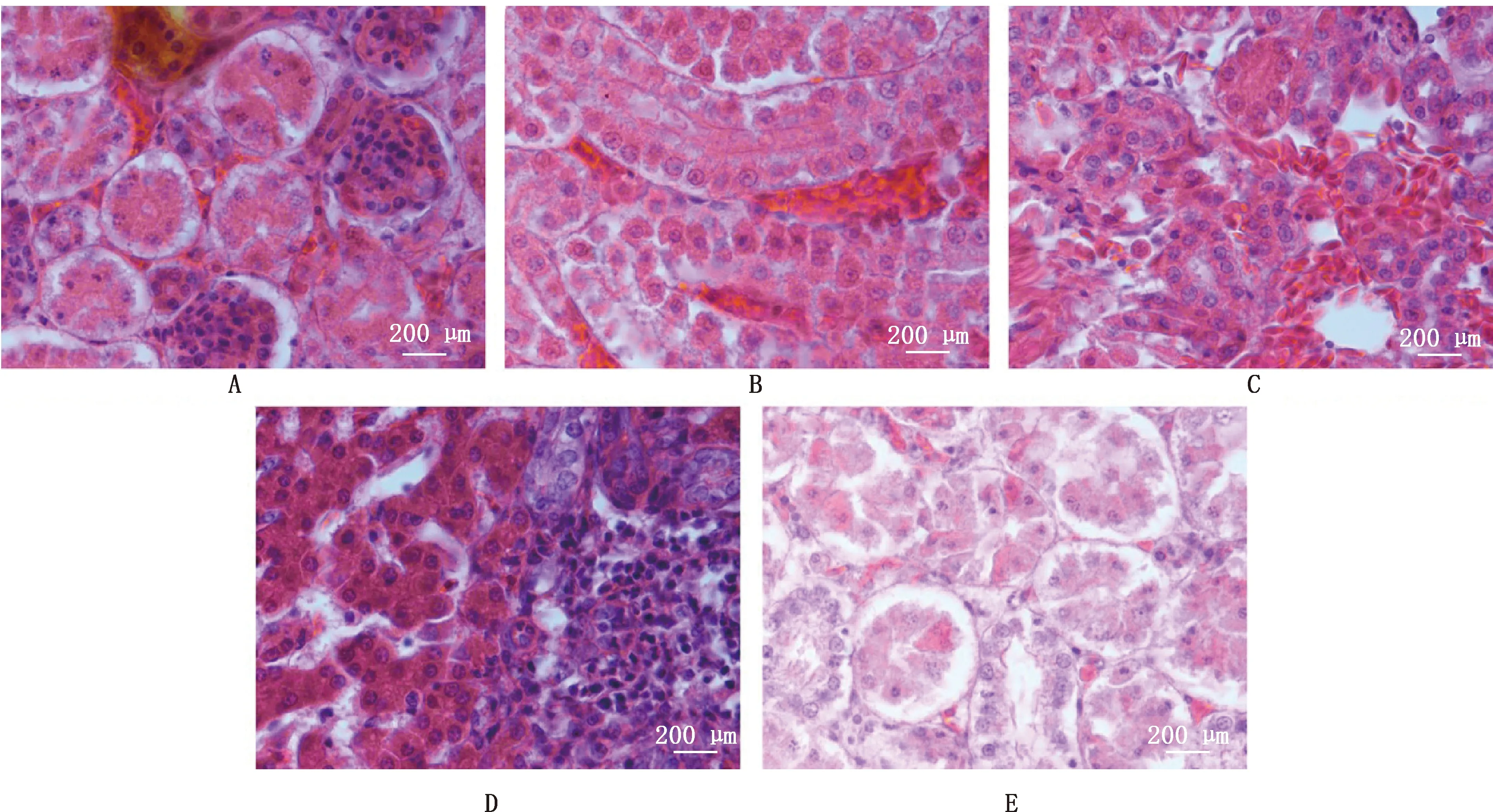
A,GDDL-4组肾脏出血;B,GDB3-8a组肾间质出血/充血;C,GDT08-8b组肾脏充血;D,GDWYT-11组肾间质出血;E,对照组A,Renal hemorrhage in GDDL-4 group;B,Renal interstitial hemorrhage and congestion in GDB3-8a group;C,Renal congestion in GDT08-8b group;D,Renal interstitial hemorrhage in GDWYT-11 group;E,Control group图5 肾脏组织病理学观察(400×)Fig.5 Histopathological observation of kidney (400×)

A、B、D,GDDL-4、GDB3-8a、GDWYT-11组淋巴细胞变性坏死;,组淋巴细胞变性坏死;C,GDT08-8b组少量淋巴细胞坏死;E,对照组A,B and D,Lymphocyte necrosis in GDDL-4,GDB3-8a and GDWYT-11 groups,respectively;C,A little of lymphocyte necrosis in GDT08-8b group;E,Control group图6 法氏囊组织病理学观察(400×)Fig.6 Histopathological observation of bursa of Fabricius tissue section (400×)

图7 病毒载量分析Fig.7 Viral load analysis
3 讨 论
近年来,国内养禽业FAdV的感染呈上升趋势,其主要流行的血清型为FAdV-4、FAdV-8a、FAdV-8b和FAdV-11。其中,由FAdV-4引起的心包积液综合征(hydropericardium syndrome,HPS)具有较高的致病率和死亡率,给养殖户造成了不少的损失。本研究通过4株FAdV流行株对SPF雏鸡致病力的影响,反映出4个血清型的病理特点及致病力的差异性。本试验结果发现,除了GDDL-4株能引起雏鸡发生HPS以外,其他3株毒株也能引起雏鸡发生不同程度的HPS,进一步证实了宋文平[18]和Sahindokuyucu等[19]的报道。说明FAdV在进化过程中可能发生了变异,也可能与不同地区毒株之间存在差异有关[20-21]。本研究采用肌内注射途径接种病毒[22],从死亡率上看,除了GDT08-8b组无死亡外,GDDL-4、GDB3-8a和GDWYT-11组的死亡率分别为85%、65%和35%,与Chen等[23]、宋文平[18]和王娟[24]研究结果相比,FAdV致病性有了明显的提升。
从剖检结果中发现,4株毒株主要侵害心脏与肝脏,表现为明显的心包积液和肝脏刷状出血。除此之外,GDB3-8a组还出现了明显的腺胃出血,结合组织病毒载量分析可得出,GDB3-8a和GDT08-8b对宿主的消化道有明显的偏嗜性,因此,腺胃是分离这2种血清型病毒的最佳组织器官[18],FAdV-4和FAdV-11则应考虑从肝脏组织中进行分离。同时,组织病毒载量结果也间接提示了4株分离株具有广泛的组织嗜性,且各组织的病毒载量相对较高,造成这种现象的原因除了毒力差异外,可能与试验动物的日龄及免疫系统的完善程度有关。组织学病理观察结果表明,不同血清型的病变特征相似,各攻毒组均出现包涵体肝炎,部分肾脏间质出血,部分法氏囊淋巴细胞坏死,单从临床症状和组织学病变上很难对这4种毒株进行诊断。另外,临床上也存在混合感染和基因重组导致的变异毒株[25],这也说明面对当前复杂的临床环境,除了做好日常的饲养管理以外,还需要通过实验室检测手段定期监测养殖场中FAdV的流行情况,从而选择合适的疫苗进行预防。从器官指数分析结果可以看出,各攻毒组与对照组大部分器官指数存在显著差异(显著升高或下降),表明FAdV会阻碍机体器官正常发育,或导致机体器官异常肿大,即便出现带毒不发病的情况,家禽的品质也会受到一定的影响。从排毒量分析可发现,GDDL-4和GDB3-8a组排毒量较大,GDT08-8b和GDWYT-11组排毒量较少,4组攻毒组接种后全程在排毒,存在泄殖腔排毒传播的风险。因此,除了及时淘汰发病鸡外,还应使用适当比例(1∶1 000)稀释的甲醛溶液对饲养环境进行消毒[26],从传染源途径切断病原的传播。
简而言之,对于毒力增强的流行株,养禽业应加以重视,除了做好日常的饲养管理之外,疫苗工作也不可懈怠。面对血清型众多的FAdV,应加快推进多价疫苗的研发工作,利用疫苗手段保护易感群体。本试验对FAdV分离株进行致病性研究,可为后续从事相关疫苗研发和制定有效的防控措施提供数据支持和理论依据。
4 结 论
本试验通过探究4株FAdV流行株对SPF雏鸡的致病性,进一步了解了家禽在感染FAdV后的临床症状、剖检病变、组织病理学变化、排毒量及病毒载量等病理特征,4株分离株均可导致雏鸡肝脏出现包涵体肝炎的病理变化,均可反复排毒,在肝脏和十二指肠中病毒载量最高。
