感染鲤浮肿病毒镜鲤的组织病理变化及病毒分布规律研究
2022-03-17吕晓楠徐立蒲王小亮王静波
吕晓楠,徐立蒲,张 文,王 娜,曹 欢,王小亮,王 姝,王静波
(1.北京市水产技术推广站,北京 100176;2.中国检验检疫科学研究院,北京 100176)
鲤是全球养殖最广泛的鱼类,也是水产养殖中最具经济价值的品种之一。中国是鲤养殖大国,2019年其养殖产量约300万t[1]。锦鲤为鲤的变种,在中国同样具有重要的市场价值[2]。近十年来,在中国多地鲤、锦鲤养殖场暴发一种新发重大流行疫病—鲤浮肿病(Carp edema virus disease,CEVD),部分地区发病率高达50%,死亡率为50%~90%[3-6]。因缺乏有效防控措施,严重影响中国鲤、锦鲤养殖业的发展。
鲤浮肿病是由鲤浮肿病毒(Carp edema virus,CEV)感染鲤科鱼类引起的一种高度传染性流行病毒病[7-8]。患病鱼出现烂鳃、凹眼、昏睡等临床症状并急性死亡。鲤浮肿病于1970年首次在日本锦鲤中发现并很长一段时间仅在日本流行,后扩散到英国、德国、荷兰、意大利、美国等国家,中国于2016年首次报道了鲤浮肿病发生,目前国内主要流行的基因型为Ⅱa基因型[3-8]。该病发现的时间较短,易感宿主细胞和全基因组序列等基础研究相对落后,使得人们对CEV的易感宿主、流行病学和发病机制等认识尚浅。至今有关CEV的生物学和流行病学特性还有许多未解之谜,各国学者都在研究当中。CEV主要检测方法是根据典型症状进行初步诊断,再通过套式PCR或实时荧光定量PCR确诊[9-10],原位杂交、免疫组织化学、免疫荧光、ELISA等诊断方法仍处于空白阶段[8,11-13]。
目前,免疫组织化学和原位杂交技术已在人类、畜牧疾病检测及诊断广泛应用。近几年也逐渐应用在水生动物疾病的诊断上,为疾病防治奠定了基础。李嘉波等[14]采用免疫组织化学检测人工感染罗非鱼湖病毒 (TiLV) 的吉富罗非鱼肝脏、脾脏、头肾、体肾、脑和鳃组织,发现病毒在所有组织中均有分布,其中脾脏、头肾和鳃中的病毒丰度高于肝脏、体肾和脑组织。检测人工感染传染性胰脏坏死症病毒 (IPNV) 的庸鲽(Hippoglossushippoglossus)卵黄囊仔鱼,在肠、肝脏和肾脏均有病毒存在,靶位点是感染细胞的胞质[15]。目前鲜有对鲤浮肿病病理变化进行原位杂交、免疫组织化学确定CEV在病鱼体内的分布的相关研究报道。本研究通过对患病镜鲤烂鳃、眼球凹陷的临床症状观察,同时采用组织病理学(HE染色)、免疫组织化学、原位杂交等多种方法系统地对发病镜鲤的7种组织部位进行病理变化和CEV感染的分布研究,并采用实时荧光定量PCR对各组织中的CEV含量进行测定,以确定CEV在病鱼体内的分布,以期为今后进一步研究提供参考。
1 材料与方法
1.1 材料
1.1.1 样品 2020年5月下旬河北省唐山市玉田县某养殖场镜鲤发生大面积死亡,累积死亡率高达80%以上。经现场调查,发病鱼行动迟缓,呈昏睡症状,疑似感染鲤浮肿病,故收集濒死镜鲤(感染组)作为研究样本。健康镜鲤(对照组)经实验室检测证明其无CEV、鲤春病毒血症(Spring viremia of carp virus,SVCV)、锦鲤疱疹病毒(Koi herpesvirus,KHV)感染。
1.1.2 主要试剂及仪器 DNA抽提试剂盒购自QIAGEN公司;DNA扩增试剂盒购自北京百泰克生物技术有限公司;即用型DAPI染液购自江苏凯基生物技术股份有限公司;HE染色液和Scott蓝化液均购自Solarbio公司;超净高级封片胶购自BASO公司;兔抗CEV一抗(CEV P4a片段)由北京市水产技术推广站制备;苏木素染液和HRP标山羊抗兔IgG(H+L)均购自北京中杉金桥生物技术有限公司;DAB显色试剂盒、中性树脂均购自CWBIO公司;M199细胞培养液、胎牛血清(FBS)、牛血清白蛋白(BSA)均购自Gibco公司。电热恒温鼓风干燥箱(HGZF-101-1)购自上海跃进医疗器械有限公司;热恒温培养箱(DHP-9054)购自山东博科生物有限公司;实时荧光定量PCR仪(AB7500)购自Life Technologies公司;光学显微镜(Axio Vert.A1)购自Zessi公司。
1.2 方法
1.2.1 样品处理 将疑似感染鲤浮肿病的濒死镜鲤现场剖检,选取具有烂鳃、眼球凹陷等临床症状明显的病鱼17尾。取7尾病鱼,分别取心脏、肝脏、脾脏、肾脏、脑、皮肤、鳃,用4%多聚甲醛固定后石蜡包埋待用。剩余10尾病鱼,分别取上述组织,每尾鱼逐个组织制样,制备方法是称取0.5 g组织,充分匀浆后与500 μL含10% FBS的M199培养液混合,-20 ℃保存待测。
1.2.2 组织病理切片制备 取出用4%多聚甲醛固定的组织,用流水冲洗数小时,经70%、80%、90%乙醇溶液脱水,纯酒精、二甲苯等量混合液15 min,二甲苯Ⅰ、Ⅱ各15 min,至透明为止。放入二甲苯和石蜡各半的混合液15 min,再放入石蜡Ⅰ、Ⅱ透蜡各50~60 min,最后用石蜡包埋、切片。将石蜡切片进行烤片,然后脱蜡、水化。将水化后的切片放入苏木精水溶液中染色3 min,盐酸乙醇(0.5%)分化液分化15 s,水洗后用返蓝液返蓝15 s,流水冲洗,HE染色3 min,流水冲洗,脱水,透明,封片,正置显微镜观察并拍照。
1.2.3 免疫组织化学检测CEV P4a蛋白的分布和表达 将组织切片放入65 ℃烤箱中烤2 h,然后在二甲苯中放置10 min,更换二甲苯再放置10 min。将切片依次放入100%乙醇、100%乙醇、95%乙醇、80%乙醇和纯净水中各5 min。将切片放入修复盒中,加入抗原修复液(柠檬酸缓冲液),高压锅加热到自动放气,2 min后离开热源自然冷却,弃抗原修复液,将切片用PBS淋洗。将切片移入湿盒中,加入新配制的3%双氧水,以去除内源性过氧化物酶封闭液,室温孵育10 min,PBS充分淋洗。PBS浸洗切片3次,每次5 min,吸水纸吸干组织周围的PBS,在玻片上滴加5% BSA,37 ℃封闭30 min。用吸水纸吸掉组织周围的封闭液,每张切片滴加兔抗CEV一抗(1∶200),湿盒中4 ℃孵育过夜。取出4 ℃孵育过夜湿盒,室温静置45 min,PBS浸洗切片3次,每次5 min,滴加HRP标记山羊抗兔IgG(H+L)(1∶200),37 ℃孵育30 min,PBS充分淋洗。DAB显色5~10 min,在体视显微镜下观察染色程度,PBS或自来水冲洗1 min。苏木精复染3 min,1%盐酸酒精分化,返蓝;自来水冲洗1 min,脱水、透明、封片、光学显微镜观察并采集图像。
1.2.4 原位杂交检测CEVP4a基因的分布及表达 根据原位杂交探针设计原则,以NCBI数据库中CEVP4a基因序列(登录号:MH645915.1、KX254001.1、KX254004.1、KX254003.1、KX253997.1)共同保守区域为靶位点,采用DNAMAN 6.0软件进行序列比对分析,选取同源性高的片段,设计3条探针,于5′-端标记FAM。探针粉末5 000 r/min离心15 s,加入杂交液配制成探针,3条探针等量混合使用。探针序列如下:
Probe-1:5′-[FAM]+GCCCAAGAGTTTTC-TTCTCATCGTTTGTTACC-3′;
Probe-2:5′-[FAM]+GCAACTCCTTGAGG-AATATGATCTAGAATTCC-3′;
Probe-3:5′-[FAM]+GAACATAACATTTG-CAATTTTAACTTGCTCTGG-3′。
将制备好的石蜡切片常规脱蜡水化,用PBS洗涤3次,每次5 min。先煮沸15 min,滴加蛋白酶K(20 μL/mL)室温消化20 min,蒸馏水洗1次,PBS重复洗3次,每次5 min。随后滴加适量预杂交液,置于42 ℃恒温培养箱中2~3 h,吸去多余液体后,滴加适量杂交液,37 ℃恒温过夜。37 ℃条件下经梯度SSC洗涤(2×SSC洗涤10 min,1次;1×SSC洗涤10 min,2次;0.5×SSC洗涤10 min,1次)。滴加DAPI避光孵育5 min对标本进行染核,用PBS冲洗多余的DAPI。最后用50%甘油封片,通过荧光显微镜和图像采集系统观察并采集图片。
1.2.5 实时荧光定量PCR检测病毒载量 将1.2.1匀浆好的各组织液1 000 r/min离心10 min,取上清200 μL。采用DNA抽提试剂盒抽提样品核酸,按照SC/T7229—2019[9]中实时荧光定量PCR方法进行鲤浮肿病毒检测。 引物为qF1:5′-AGTT-TTGTAKATTGTAGCATTTCC-3′,qR1:5′-GA-TTCCTCAAGGAGTTDCAGTAAA-3′,荧光探针为:5′-FAMAGAGTTTGTTTCTTGCCATACAA-ACTBHQ1-3′,检测中采用的引物及探针均由生工生物工程(上海)股份有限公司合成。PCR反应体系:2×预混合液(2×Probe Master Mix) 10 μL,上、下游引物各0.8 μL,探针0.4 μL,模板2.5 μL,加ddH2O水至20 μL。PCR反应程序:95 ℃预变性2 min;95 ℃变性5 s,56 ℃退火31 s,共40个循环。组织的病毒载量按徐立蒲等[16]的方法计算。
病毒载量/(个/ng)=[(10(Ct值-38.73)/-3.3606×PCR反应终体积20 μL/PCR体系加入的模板量2.5 μL)×抽提DNA终体积200 μL]/抽提核酸用组织量
1.3 数据统计与分析
用SPSS 16.0对1.2.5各组织的病毒载量结果进行单因素方差分析,并采用Fisher法进行多重比较。结果用平均值±标准差表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 感染CEV镜鲤各组织的病变情况
利用HE染色观察发病镜鲤心脏、肝脏、皮肤、脾脏、肾脏、脑、鳃7个组织的病理改变,结果如图1所示。由图1可知,与健康镜鲤相比,患病镜鲤心脏、皮肤、脑没有明显的病理变化;患病镜鲤的肝脏细胞深染萎缩,胆小管出血(如箭头所示);健康鱼的脾脏组织结构完整,患病鱼脾脏组织出现明显间隙并伴有出血(如箭头所示);健康镜鲤肾脏组织的肾小管结构清晰,患病镜鲤肾脏组织充血明显,肾小管有明显闭合现象(如箭头所示);健康镜鲤鳃丝组织结构清晰分明,未见肿胀断裂等现象,患病镜鲤可以看见鳃丝肿胀、充血,鳃丝间有脱落堆积的红细胞和炎性细胞(如箭头所示)。
2.2 CEV P4a蛋白在镜鲤各组织中的表达情况
利用免疫组织化学检测CEV在发病镜鲤各组织的分布和蛋白表达情况,结果如图2所示。由图2可知,在健康镜鲤组织未见CEV P4a蛋白表达,在患病镜鲤的肝脏和鳃中可见CEV P4a蛋白大量表达,在心脏、脾脏、肾脏中少量表达。
2.3 CEV P4a核酸在镜鲤各组织中的表达情况
利用原位杂交检测CEVP4a基因在发病镜鲤各组织中的分布和核酸表达量的变化,结果如图3所示。由图3可知,在健康镜鲤各组织未见CEV P4a表达;在发病镜鲤鳃组织中CEV P4a大量表达,皮肤、肝脏、脾脏和肾脏少量表达,心脏、脑几乎不表达。
2.4 CEV P4a基因在镜鲤各组织中的病毒载量
病毒载量结果分析表明,CEV在鳃组织中的载量极显著高于在肝脏、脑、脾脏、肾脏、心脏、皮肤组织(P<0.01),但肝脏、脑、脾脏、肾脏、心脏、皮肤组织之间的载量分布差异不显著(P>0.05)(表1)。
3 讨 论
目前,鲤浮肿病是危害鲤和锦鲤养殖业最为严重的动物疫病之一,带来了巨大的经济损失,严重阻碍了鲤科鱼类养殖业的健康发展[3-4,8,17-18]。据国内外已有报道,其发病水温范围较广,在7~27 ℃时均可发病[3-8,17-18]。对中国河南等地区以往发生鲤浮肿病养殖场的流行病学调查显示,发病一般有2个高峰,5~6月和9月,这2个时间段养殖水温为20~27 ℃[3]。本次发病的养殖场位于河北省唐山市玉田县,发病时间为5月下旬,发病水温为20~22 ℃,死亡率>80%,与之前的流行病学调查显示的发病高峰时间和水温相一致,提示养殖场特别是在鲤浮肿病发病高峰之际要做好预防措施。本次发病镜鲤临床症状与之前报道相似[3-4,7-8,17-20],主要表现为行动迟缓、有时呈昏睡状、体表糜烂、出血、烂鳃、眼球凹陷等病症。
组织病理学是研究病毒靶器官和靶细胞的第一步,同时也是研究病毒致病机理的基础。目前关于CEV引起鲤的组织病理变化较多,但大多数只研究了鳃组织损伤,自然感染引起鲤的组织病理学观察缺乏系统的比较研究。不同组织有不同的病理特征,本研究中鳃组织病理变化表现与前人研究结果一致[16,21]。在自然发病镜鲤中,鳃作为CEV进入宿主体内的重要门户,鳃组织充血、肿胀,鳃小片融合、增生,严重影响气体交换,导致缺氧和鳃血液循环功能受阻,从而造成镜鲤大量死亡。肝脏、脾脏和肾脏也有不同程度的损伤。肝脏是主要的代谢器官,参与污染物的生物转化、脱氧、肝糖的储存盒分泌蛋白的合成。脾脏作为血库,还产生免疫球蛋白、补体和其他参与免疫功能的物质。中肾清除有害代谢物,维持电解质稳态。头肾是重要的造血器官和免疫器官,在这些组织中,CEV均可引起严重的空泡化和细胞坏死,导致机体肾脏和脾脏组织的免疫和造血功能减弱,同时削弱了肝脏的代谢功能和解毒能力,最终导致病毒大量扩散和增殖。因此,推测CEV主要破坏血液循环系统和实质器官,感染CEV的镜鲤死于循环系统紊乱和多器官衰竭。

图1 镜鲤各组织的病变情况(HE,400×)Fig.1 The pathological changes in different tissues of mirror carps (HE,400×)
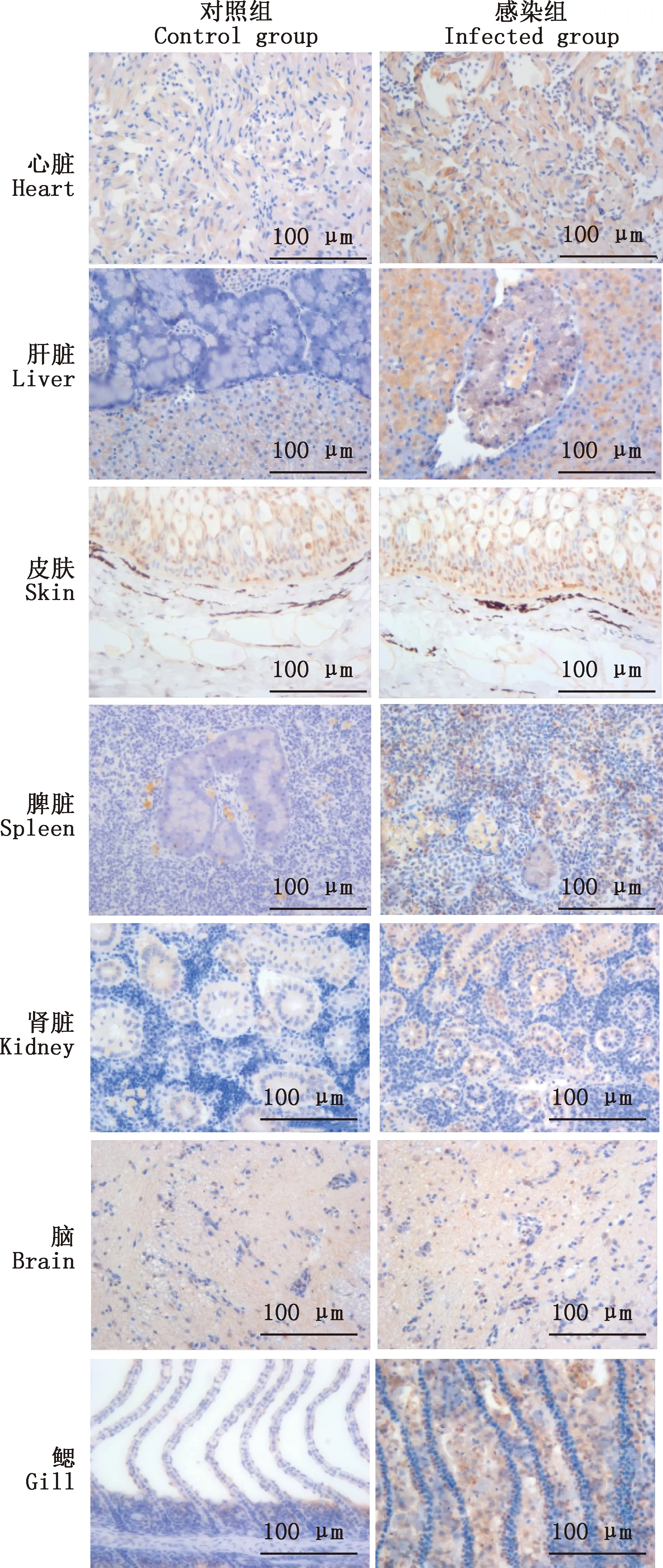
图2 CEV P4a蛋白在镜鲤各组织中的表达情况(400×)Fig.2 Expression of CEV P4a protein in different tissues of mirror carps (400×)

图3 CEV P4a在镜鲤各组织中核酸表达情况(400×)Fig.3 Expression of CEV P4a nucleic acid in different tissues of mirror carps (400×)

表1 感染镜鲤各组织中CEV病毒载量
免疫组化可在对病毒性疾病进行常规病理诊断的基础上,在相应组织原位对感染病毒做出特异、明确的定位诊断。原位杂交技术可检测特定基因显微或亚显微水平的时空表达情况。本研究同时采用免疫组化和原位杂交的方法对鲤浮肿病自然感染镜鲤的7个组织进行研究,在国内外均属首次报道。本试验结果发现,无论是蛋白水平还是核酸水平,鳃组织的P4a均呈现大量表达。推测在自然发病镜鲤中,鳃作为CEV进入宿主体内的主要通道之一,鳃组织中病毒的存在也表明镜鲤通过过滤和呼吸作用与水体进行物质交换,导致CEV感染鳃血管细胞后,在该细胞中增殖并释放到血液中,进而随着血液循环感染脾脏、头肾等免疫器官,导致疾病发生。此外,免疫组化结果表明,健康镜鲤的脑、皮肤、心脏出现了一些非特异性的显色信号,这提示采用的兔抗CEV多克隆抗体在特异性方面可能存在不足。实时荧光定量PCR检测表明,鳃组织病毒载量极显著高于其他部分,这与徐立蒲等[16]研究结果一致。诸多证据均显示鳃是鲤浮肿病攻击的重要靶器官,为疫病监测确定采样部位提供基础依据的同时,也阐明了感染CEV造成镜鲤大面积死亡的直接原因。
疾病的发展是一个动态的过程,因此在不同时间、不同器官会先后遭到不同程度的攻击而损伤。不同体质的镜鲤受到病毒不同强度的攻击也会在不同时间和不同器官上出现不同程度的病理变化。本试验所展示的是鲤浮肿病发病动态发展的一个截面,但即使是截面,也能从4种方法中得到同一个结论,即鳃的病理变化最大,病毒抗原和核酸量也最多。说明鳃是CEV增殖的最主要靶器官。鳃丝末端细胞增生会严重影响到血液的气体交换,导致鱼缺氧、浮头、反应迟缓、代谢紊乱等,出现“浮肿”和“昏睡”的临床症状,推测鳃组织的病理变化可能是导致镜鲤缺氧死亡的主要原因。
在鳃组织的坏死部位病毒含量较高,说明病毒能通过鳃丝进入鱼体并在鳃中复制,从而导致呼吸上皮细胞脱落和坏死,但如需进一步了解鳃损伤的致病机制,仍需研究宿主与病毒在鳃中的相互作用。鳃丝上较高的病毒载量也说明了CEV能通过鳃丝释放到水中进行传播,这种方式能很好地解释鲤浮肿病传播速度快的特性。由于该病的危害极大,若防控不力则极有可能造成鲤浮肿病的进一步扩散和流行。
4 结 论
本研究确诊唐山某养殖场镜鲤发生大面积、急性死亡的病原为CEV,感染后鳃丝肿胀、充血,肝脏、脾脏等内脏组织不同程度充血、出血,病毒主要分布在鳃组织。表明鳃是CEV增殖的最主要靶器官,结果可为鲤浮肿病诊断和防控提供参考。
