肺腺癌患者经培美曲塞联合顺铂及吉西他滨术前新辅助化疗对其肺功能指标及神经元特异性烯醇化酶、细胞角蛋白-19片段抗原水平的影响
2022-03-09赵旭
赵 旭
肺癌是全球范围内发病率位居首位的恶性肿瘤,多见于老年患者,且预后往往较差[1]。腺癌属于肺癌的重要病理类型之一,其发病早期具有极强的隐匿性,增加了临床诊断的难度,且易发生血行转移,大部分患者一经确诊便已丧失手术根治的时机[2]。新辅助化疗是近年来所开发的一种肿瘤治疗方案,可为晚期肿瘤患者创造手术治疗机会,且患者术后的生存率往往高于单纯接受放化疗患者,已成为国内外临床研究的热点[3]。寻找一种具有较高治疗指数以及安全性的化疗方案对患者进行治疗显得尤为重要,亦是目前临床广大医务人员共同关注的热点。目前,临床上用于肺腺癌术前新辅助化疗的药物较多,包括吉西他滨、培美曲塞、顺铂以及紫杉醇等,不同的新辅助化疗方案临床效果迥异,对患者预后转归的影响不尽相同[4]。鉴于此,本研究就肺腺癌患者采用培美曲塞联合顺铂及吉西他滨术前新辅助化疗对其肺功能指标及神经元特异性烯醇化酶(NSE)、细胞角蛋白-19片段抗原(CYFRA21-1)水平的影响进行分析。现报道如下。
1 资料与方法
1.1 一般资料
选取2018年1月至2020年1月朝阳市第二医院收治的80例肺腺癌患者作为研究对象,按随机数字表法分为试验组与对照组,每组40例。试验组男24例,女16例;年龄30~76岁,平均(50.16±6.55)岁;病理分期:Ⅲa期19例,Ⅲb期21例。对照组男23例,女17例;年龄31~78岁,平均(50.52±6.49)岁;病理分期:Ⅲa期17例,Ⅲb期23例。两组患者一般资料比较,差异无统计学意义(P>0.05)。具有可比性。
纳入标准:1)经病理活检确诊为肺腺癌晚期;2)预计生存期在3个月以上[5];3)入院前未接受放化疗等相关抗肿瘤治疗。排除标准:1)心、肝、肾等重要脏器发生严重病变;2)对本研究药物过敏;3)无法正常交流沟通或合并神经系统疾病;4)研究过程中因各种原因退出或失访。
1.2 治疗方法
对照组实施吉西他滨联合顺铂化疗,治疗方案如下:吉西他滨(美国礼来公司,注册证号H20110535)1 000 ng/m2+顺铂(齐鲁制药有限公司,国药准字H20023461)60 mg/m2。分1~3次静脉滴注,以21 d为1个治疗周期,连续治疗4个周期。试验组则实施培美曲塞联合顺铂化疗,治疗方案如下:培美曲塞(美国礼来公司,注册证号H20140662)500 mg/m²+顺铂90~100 mg,给药方式为静脉滴注,以21 d为1个治疗周期,连续治疗4个周期。培美曲塞给药前1 d予以400 μg叶酸以及1 000 mg多元维生素辅助干预,1次/d;同时予以1 000 μg剂量的维生素B12肌内注射,每2个月给药1次;化疗期间连续使用地塞米松4 mg/次,2次/d。标本采集:分别选择治疗前1 d以及治疗2个周期后,采集所有受试者清晨空腹静脉血4 ml,以8 cm为离心半径,进行10 min的3 000 r/min离心处理。获取血清保存在-80 ℃冰箱中备用。
1.3 临床评价
1)疗效判定标准:完全缓解(CR),病灶完全消失,且持续时间>30 d;部分缓解(PR),病灶缩小50%以上,且持续时间>30 d;稳定,肿块缩小25%~50%;恶化(PD),肿块缩小<25%或出现新病灶[6]。客观有效率(%)=CR例数+PR例数/总例数×100%;疾病控制率(%)=CR例数+PR例数+PD例数/总例数×100%。2)不良反应:主要包括恶心呕吐、血小板减少、白细胞减少、贫血以及肝肾功能异常。3)肺功能指标:包括第一秒钟用力呼气容积(FEV1)、用力肺活量(FVC)以及两者比值(FEV1/FVC),采用Platinum Elite DL型肺功能测定仪进行检测,检测时间为治疗前1 d以及治疗结束后1 d。4)血清NSE、CYFRA21-1水平:检测方式为酶联免疫吸附试验法,操作按照试剂盒(购自深圳晶美生物科技有限公司)说明书完成。
1.4 统计学分析
采用SPSS 22.0统计软件进行数据分析,计数资料以百分率表示,组间比较采用χ2检验,计量资料以±s表示,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
试验组客观有效率及疾病控制率明显高于对照组(P<0.05)。见表1。
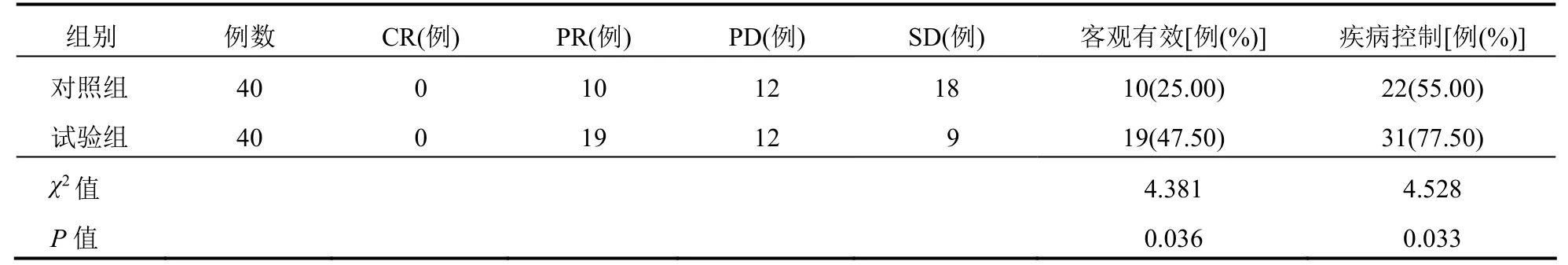
表1 两组患者临床疗效比较
2.2 两组不良反应比较
试验组血小板减少、白细胞减少以及贫血发生率低于对照组(P<0.05)。见表2。
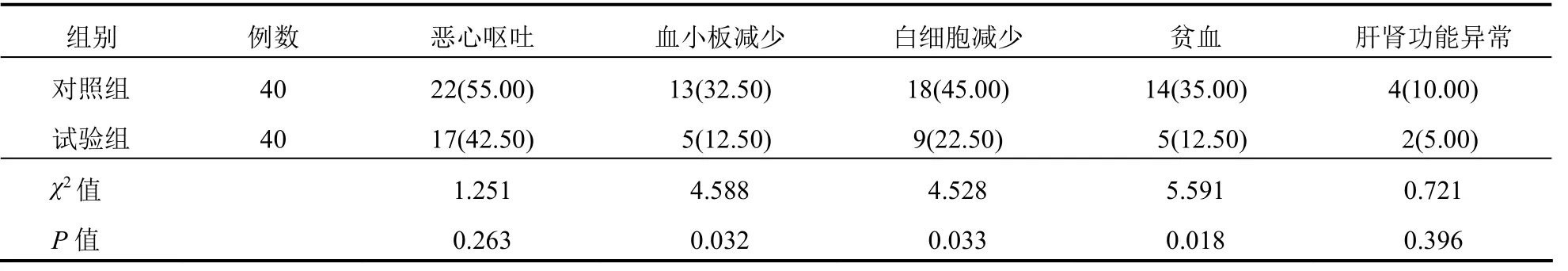
表2 两组患者不良反应比较[例(%)]
2.3 治疗前后两组肺功能指标水平
治疗后,两组FEV1、FVC高于治疗前(P<0.05);两组治疗前后各项肺功能指标水平比较差异无统计学意义(P>0.05)。见表3。
表3 两组患者FEV1、FVC、FEV1/FVC水平比较(±s)
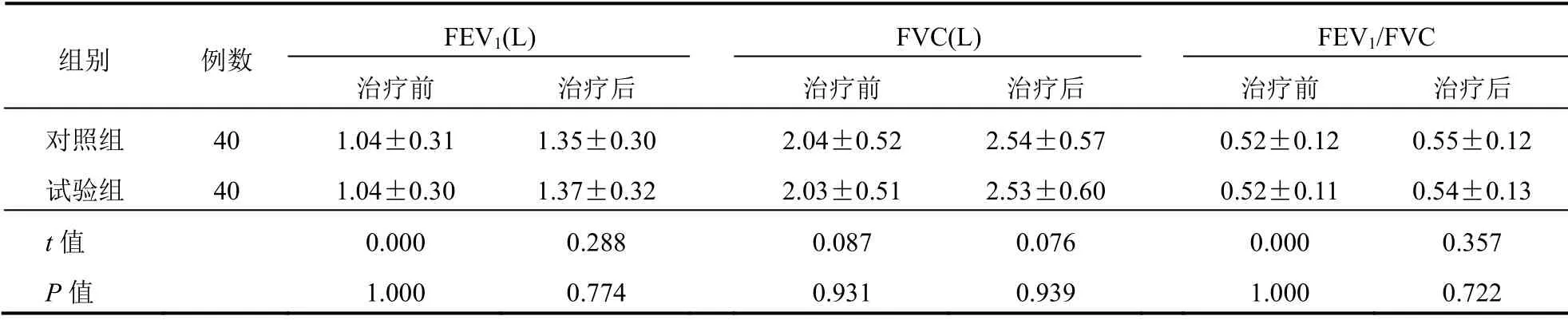
表3 两组患者FEV1、FVC、FEV1/FVC水平比较(±s)
FEV1(L) FVC(L) FEV1/FVC组别 例数治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组 40 1.04±0.31 1.35±0.30 2.04±0.52 2.54±0.57 0.52±0.12 0.55±0.12试验组 40 1.04±0.30 1.37±0.32 2.03±0.51 2.53±0.60 0.52±0.11 0.54±0.13 t值 0.000 0.288 0.087 0.076 0.000 0.357 P值 1.000 0.774 0.931 0.939 1.000 0.722
2.4 两组血清NSE以及CYFRA21-1水平比较
治疗后试验组血清NSE以及CYFRA21-1水平低于对照组(P<0.05)。见表4。
表4 两组患者血清NSE以及CYFRA21-1水平比较(±s)
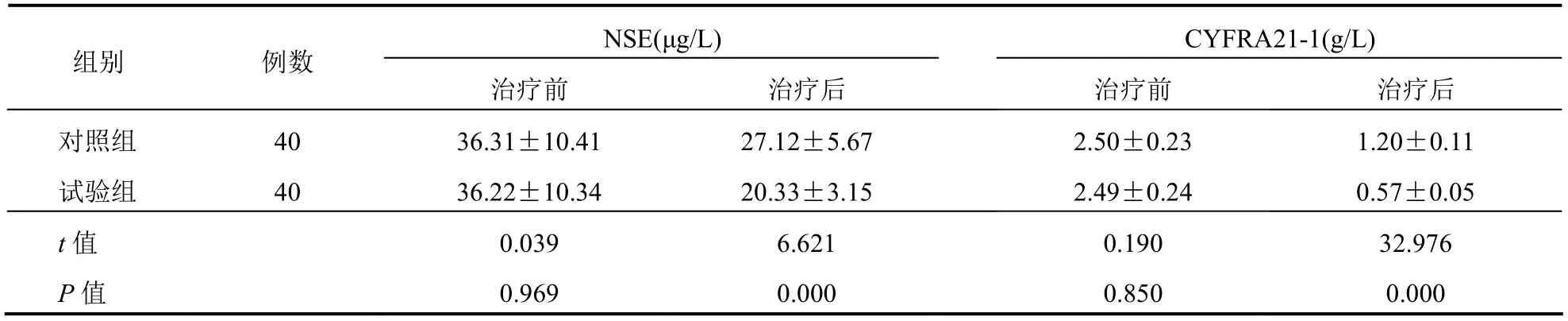
表4 两组患者血清NSE以及CYFRA21-1水平比较(±s)
NSE(μg/L) CYFRA21-1(g/L)组别 例数治疗前 治疗后治疗前 治疗后对照组 40 36.31±10.41 27.12±5.67 2.50±0.23 1.20±0.11试验组 40 36.22±10.34 20.33±3.15 2.49±0.24 0.57±0.05 t值 0.039 6.621 0.190 32.976 P值 0.969 0.000 0.850 0.000
3 讨论
目前,临床上针对肺腺癌具体病因以及发病机制的研究报道层出不穷,尚无统一定论,主要认为环境因素、肺部慢性疾病以及遗传因素等与肺腺癌的发生、发展密切相关[7-9]。吉西他滨是一种新型抑制肿瘤细胞代谢的化疗药物,可通过降低三磷酸核苷酸以及二磷酸核苷酸的表达,继而抑制核苷酸还原酶活性,进一步降低DNA的复制,诱导肿瘤细胞DNA凋亡[10-12]。顺铂则是经典铂类金属化合物之一,属于细胞周期抑制剂,具有一定的非特异性抗肿瘤功效,主要是通过结合肿瘤细胞的DNA碱基,继而影响肿瘤细胞的DNA复制以及转录,最终达到抑制肿瘤细胞增殖的目的[13-14]。两药联合的化疗方案是目前临床上广泛应用于肺腺癌术前新辅助化疗中的方案,虽可获得一定的效果,但并不十分理想。近年来,随着相关研究的日益深入,越来越多的学者发现培美曲塞联合顺铂可作为中国除鳞癌类型以外的肺癌一线治疗药物,且在疗效方面可能优于吉西他滨,并具有更低的血液学毒性。
本研究发现,试验组客观有效率及疾病控制率明显高于对照组。这在郭静等[15]的研究报道中得以佐证:培美曲塞联合顺铂方案用于治疗晚期肺腺癌患者的临床客观有效率和疾病控制率分别为43.64%、78.18%,明显高于吉西他滨+顺铂或多西他赛+顺铂或紫杉醇+顺铂方案治疗组的26.15%、60.00%。培美曲塞是一种多靶点抗代谢药物,其主要作用机制在于可对叶酸代谢所需的胸苷酸合成酶具有一定的抑制作用,同时可不同程度地抑制甘氨核苷酸甲酰基转移酶以及二氢叶酸还原酶,进一步促使DNA合成速度的降低,最终达到抑制DNA复制以及肿瘤生长的目的。此外,试验组血小板减少、白细胞减少以及贫血发生率低于对照组。这在既往研究报道中得以佐证[16],提示培美曲塞联合顺铂术前新辅助化疗应用于肺腺癌患者的安全性较佳。主要原因是培美曲塞进入细胞后在叶酰多谷氨酸合成酶的作用下转化为多谷氨酸的形式,继而长时间存在于肿瘤细胞中,对胸苷酸合成酶、甘氨核苷酸甲酰基转移酶的活性产生抑制作用,但其在正常细胞中往往水平较低,因此作用时间较长,不良反应较小,安全性较佳。另外,本研究发现,肺腺癌患者经培美曲塞联合顺铂术前新辅助化疗后的肺功能改善效果更为理想。原因可能是和上述化疗方案的抗肿瘤作用较佳以及不良反应较少有关。本研究中,治疗后试验组血清NSE以及CYFRA21-1水平低于对照组。其中NSE以及CYFRA21-1水平在肺腺癌患者血清中异常高表达,且其表达水平和患者病情以及预后密切相关。因此,上述两项血清学指标水平的降低为培美曲塞联合顺铂方案的有效性增添了强有力的证据。
综上所述,培美曲塞联合顺铂术前新辅助化疗应用于肺腺癌患者中的临床疗效较佳,且不良反应发生率较低,可有效改善肺功能以及血清NSE、CYFRA21-1水平。
